實時熒光PCR 法檢測芝麻醬中的芝麻成分
李 娟,陳茵茵,梅 巖,陳雪華,王 達,黃嘉文
(1.廣東省食品藥品職業技術學校,廣東廣州 510000;2.廣東省食品檢驗所,廣東廣州 510000)
芝麻又稱胡麻,既是油料作物,又可直接食用。芝麻醬是由芝麻炒熟、磨碎制成,其香味濃郁,色澤金黃,口感細滑,是廣大消費者喜愛的一種調味品[1]。芝麻醬的營養豐富,含有不飽和脂肪酸、蛋白質、維生素E、礦物質、鐵等對人體有益的營養物質[2]。芝麻醬的制作工藝簡單,不需要特殊的大型設備,但因市場準入門檻低等使得生產企業生產的產品質量相差很大,各種摻假方式層出不窮,如摻入其他油料作物、用淀粉香精調制等[3]。因此,芝麻醬作為消費者生活中必不可少的調味品,其摻假檢測非常必要。
目前,芝麻醬的摻偽鑒定還未有相關標準出臺,最常用的芝麻醬摻偽鑒別方式是感官鑒別,對其色、香、味、形進行判定,但一般消費者并不具備相關的知識導致難以分辨是否摻偽。國內學者對于芝麻醬的研究也較少,其鑒定指標/技術有采用色譜法測定脂肪酸、采用氣質聯用技術測定特征風味物質[4]、分子生物學技術PCR 法等[5]。分子生物學技術現在已廣泛應用于多種動植物產品摻假鑒定中,本項目應用的實時熒光PCR 技術可直接判讀芝麻醬產品是否含有芝麻源性成分或其他標簽未標識的其他源性成分,靈敏度高、操作簡便。
1 材料與方法
1.1 材料與儀器
熒 光PCR 試 劑:Takara Premix Ex Taq(Probe qPCR)RR390A,分析純;異丙醇,分析純;DNA提取試劑:QIAGEN DNeasy mericon Food Kit(Code No.69514),分析純,德國QIAGEN 公司;引物,生工生物上海有限公司。
Bio-rad CFX96 熒光定量PCR 儀,美國Bio-rad公司;Biospec-nano 核酸蛋白測定儀,日本島津公司;1300 系列A2 級別生物安全柜,美國Thermofisher 公司;Sorvall ST 8 離心機,美國Thermofisher 公司。
1.2 實驗方法
將芝麻醬樣品進行均質,按照優化后的植物DNA 提取流程或成品的試劑盒DNA 提取流程進行DNA 的提取,之后以提取的DNA 為模板,采用2S albumim mRNA 基因的特異性引物、探針進行實時熒光PCR 檢測,觀察是否出現實時熒光PCR 的增幅現象,判斷待檢樣品中是否含有芝麻源性成分,實現芝麻源性成分的鑒定。
1.2.1 樣品前處理
將芝麻醬樣品中析出的上層油質去除,盡量去除干凈,否則影響芝麻醬DNA 的提取,用潔凈的玻璃棒攪拌均勻,取芝麻醬樣品約500 mg 置于離心管中,4 ℃冷凍離心,去上清留沉淀,置于-20 ℃冰箱中保存,以備下一步進行核酸提取。
1.2.2 DNA 提取
試劑盒優化法:①取經過前處理后的樣品約1 000 mg,加入等體積的異丙醇溶液,輕輕渦旋振蕩;②振蕩后將其置于4 ℃冰箱中靜置30 min,后取出于4 ℃冷凍離心;③按照商業化DNA 提取試劑盒說明書中的要求進行DNA 提取。提取過程中設置提取對照,以滅菌去離子水代替樣品進行DNA 提取。
1.2.3 DNA 濃度測定
采用Biospec-nano 核酸蛋白分析儀對提取的DNA 進行濃度測定。
1.2.4 實時熒光PCR 擴增及其質控設置
芝 麻 源 性 成 分 檢 測2S albumim mRNA基因的特異性引物探針序列, 上游引物:CCAGAGGGCTAGGGACCTTC; 下 游 引 物:CTCGGAATTGGCATTGCTG; 探 針 序 列:FAMTCGCAGGTGCAACATGCGACC- TAMRA。
芝麻源性成分檢測實時熒光PCR 反應體系采用25 μL 反應體系,PCR 緩沖液加入2.5 μL,其工作濃度為10 倍Buあer;上下游引物、探針各加1 μL,其工作濃度均為10 μmol·L-1;dNTPs 加入2 μL,其工作濃度均為10 μmol·L-1,Taq DNA 聚合酶加入0.2 μL,其工作濃度為2.5 U·μL-1;DNA模板加入量為10~100 ng,最后用滅菌去離子水補足25 μL 反應體系。
芝麻源性成分檢測實時熒光PCR 反應程序:50 ℃/2 min,1 個循環;95 ℃/15 min,1 個循環;95 ℃/15 s,60 ℃/1 min,40 個循環;在每次循環退火時收集熒光信號。反應參數可根據基因擴增儀型號以及所使用試劑的不同進行適當的調整。
以芝麻中提取的DNA 為陽性對照,以花生提取的DNA 為陰性對照,以滅菌水為空白對照,以水為樣品進行提取作為提取過程的對照。
1.2.5 熒光PCR 擴增結果判斷與表述
閾值的設定根據儀器噪聲情況進行調整,以閾值線剛好超過正常陰性對照擴增曲線(無規則的噪音線)的最高點,且Ct 值不出現任何數值為準。
(1)各對照結果應符合以下要求。①陰性對照:無熒光增幅現象。②提取對照及空白對照:無熒光增幅現象。③陽性對照:有明顯的熒光增幅現象。④內參照:有明顯的熒光增幅現象。⑤以上指標有一項不符合均視為此次實驗無效。
(2)結果判定。①同時進行的內參照、陰性、陽性、空白和提取對照實驗結果正常,檢測樣品無熒光增幅現象,Ct 值>40.0,判斷被檢樣品陰性,未檢出芝麻源性成分。②同時進行的內參照、陰性、陽性、空白、提取對照實驗結果正常,檢測樣品有明顯的熒光增幅曲線,且Ct 值<35.0,判斷被檢樣品陽性,檢出芝麻源性成分。③同時進行的內參照、陰性、陽性、空白、提取對照實驗結果正常,且檢測樣品熒光增幅曲線的Ct值在35.0~40.0,則應重新進行實時熒光PCR反應。再次擴增出的結果Ct 值仍在35.0 ~40.0,可判斷被檢樣品可疑,否則可判斷被檢樣品陰性。
1.2.6 方法特異性研究
在芝麻醬產品中可能會摻雜花生成分[1],為驗證該方法的特異性,以花生樣品提取的DNA 為模板,以本研究中芝麻的上下游引物、探針進行擴增,查看擴增結果是否出現非特異性擴增。
1.2.7 方法檢出限研究
樣品中若芝麻成分含量少,提取到的DNA 濃度過低,可能會導致檢測不出芝麻源性成分,因此需要對本研究中的上下游引物、探針進行檢出限的驗證。對芝麻樣品提取的DNA 進行稀釋,濃度分別為提取后濃度的10%、1%、0.1%、0.01%,以不同比例稀釋后的DNA 為模板進行實時熒光PCR 擴增。
2 結果與分析
2.1 方法特異性驗證結果
從圖1 中看出,以花生樣品提取的DNA 為陰性對照進行擴增后,無熒光增幅現象,說明本研究中應用的上下游引物、探針具有特異性,可特異性擴增芝麻源性成分。
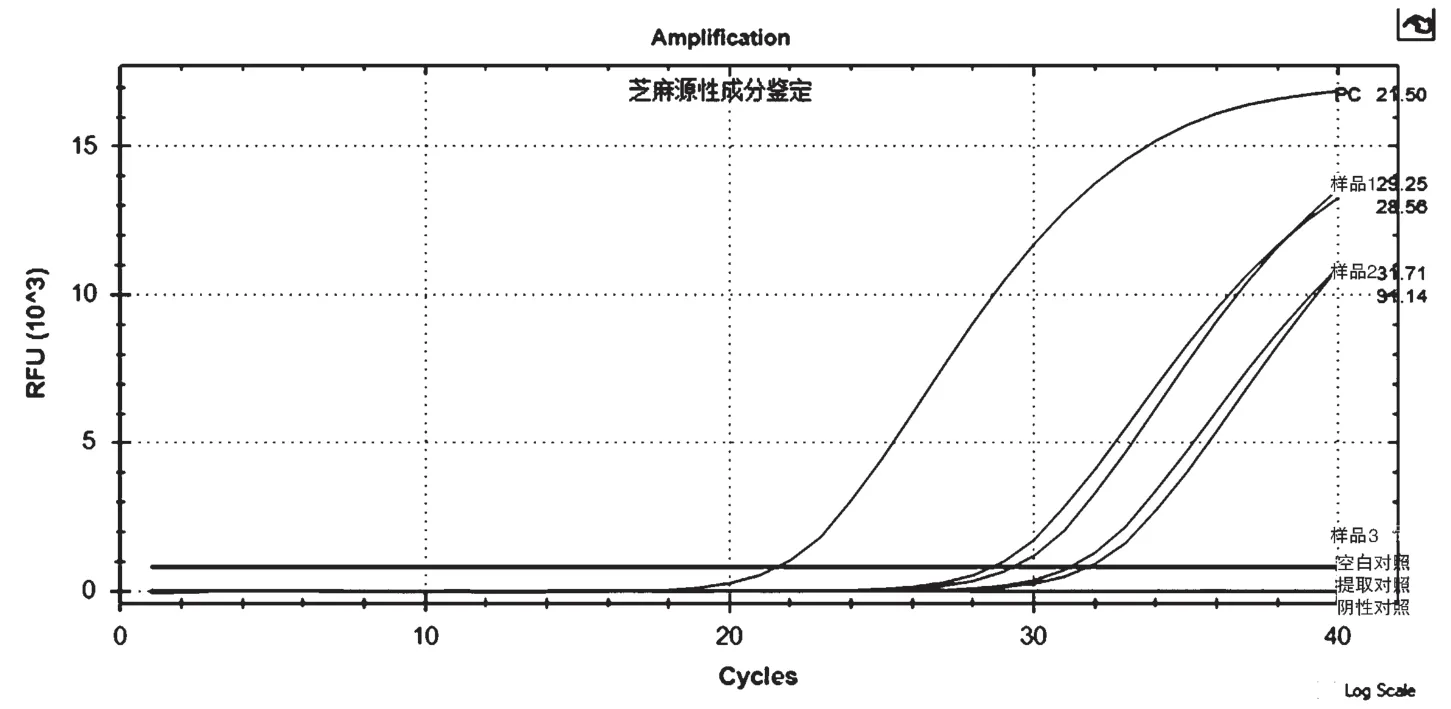
圖1 芝麻源性成分2S albumim mRNA 基因檢測
2.2 方法檢出限驗證結果
對芝麻樣品提取的DNA 進行稀釋后,濃度分別為原濃度的10%、1%、0.1%、0.01%,以此為模板擴增,結果見圖2。從圖中可看出,在DNA 濃度為0.01%時仍有熒光增幅現象,且Ct 值<35,說明該方法的最低檢出限(LOD)為0.01%。
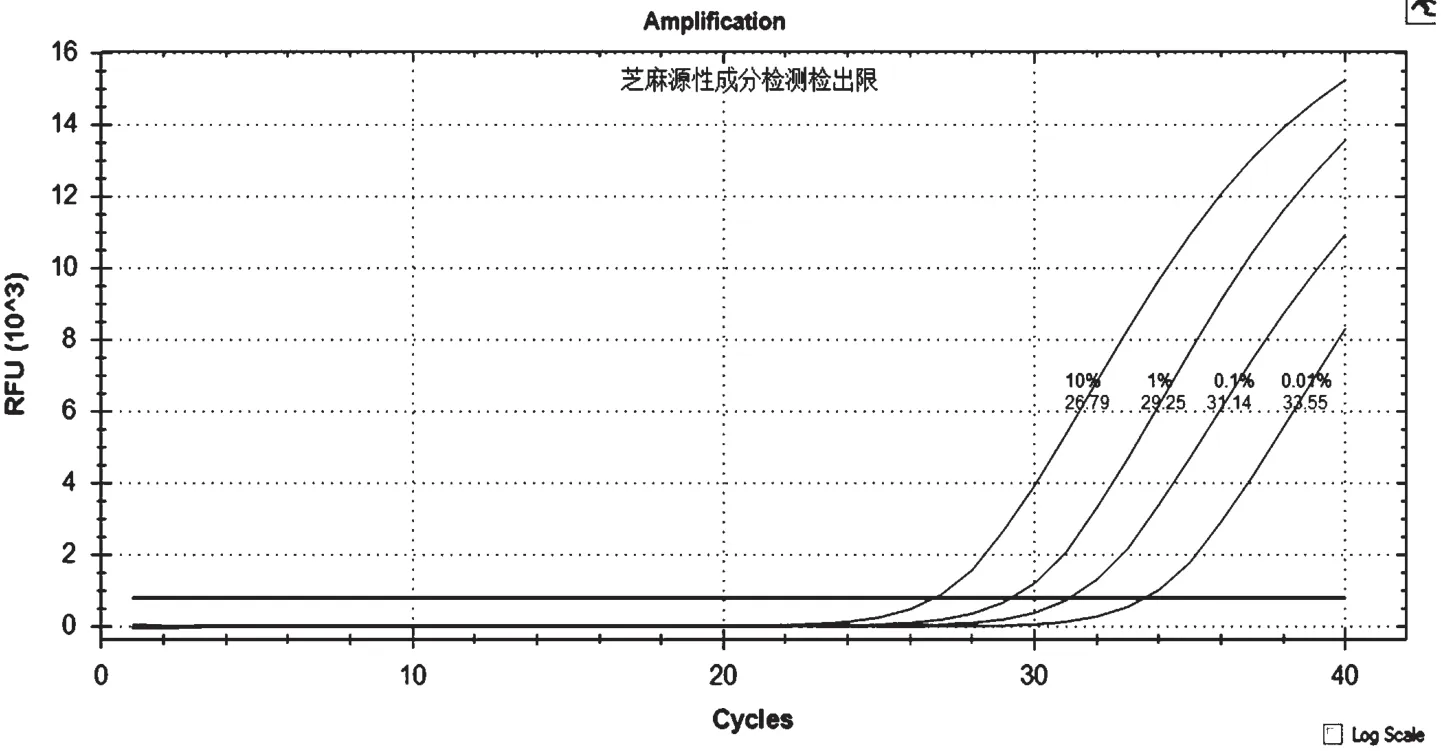
圖2 芝麻源性成分檢測檢出限
2.3 市售樣品檢測結果
超市購買芝麻醬待檢品3 份,產品均有明確的標簽標識,其中2 份標識含有芝麻源性成分和花生源性成分,一份標識僅含有花生源性成分。用本方法進行芝麻源性成分的鑒定,結果見圖1 及表1,結果顯示同時進行的陰性、陽性、空白、提取對照實驗結果正常,兩份樣品能檢測出芝麻源性成分,標簽僅含花生源性成分的樣品未檢出芝麻源性成分。

表1 實際樣品檢測結果
3 結論
本研究建立了利用實時熒光PCR 法對芝麻源性成分進行檢測的方法,并利用該方法對市售樣品進行了檢測。經過驗證,該方法的特異性及檢出限均能滿足檢測要求,市售樣品檢測結果均符合產品標簽,說明該方法檢測結果可靠。

