矢志方激活Sirt1-Foxo1 通路調控內質網應激相關蛋白改善高尿酸血癥小鼠腎損傷*
楊楓,王傳旭,吳志遠,張栩銘,高建東
(上海中醫藥大學附屬曙光醫院,上海中醫藥大學中醫腎病研究所,上海中醫藥大學肝腎疾病病證教育部重點實驗室,上海市中醫臨床重點實驗室,上海 201203)
高尿酸血癥(HUA)是由于嘌呤代謝紊亂導致血清尿酸(UA)升高的代謝綜合征,對人體心腦血管、關節、腎臟等器官造成損害[1-2]。隨著人們生活水平的提高,HUA 的發病率逐年升高,UA 長期堆積在腎臟會引起腎小管間質纖維化,從而引發UA 性腎病[3]。臨床一線降UA 藥物如黃嘌呤氧化酶抑制劑非布司他、別嘌呤醇,促進UA 排泄藥物苯溴馬隆等,長期服用存在一定副作用、血清UA 控制不佳等問題[4]。
沉默信息調節因子1(Sirt1)/叉頭轉錄因子1(Foxo1)信號通路與腎臟病理生理發展密切相關。Sirt1 在腎臟中廣泛存在,激活Sirt1 可抑制Foxo1 乙酰化水平,對腎臟起保護作用。Sirt1 表達增加可減輕草酸鈣晶體誘導的腎損傷[5],緩解脂多糖所導致的氧化應激引起的腎損傷[6]。內質網應激(ERS)是維持細胞內穩態的重要細胞器,腎小管上皮細胞損傷是一種病理和生理的改變,在HUA 早期和進展期發揮關鍵作用[7]。在正常情況下,適度ERS 能保護細胞活性,如果長時間高UA 刺激則會超出內質網代償能力,造成細胞損傷[8]。
矢志方是上海中醫藥大學附屬曙光醫院腎病科臨床經驗方。臨床療效較好,能顯著降低痰濁瘀阻型HUA 的UA 水平[9]。前期大量基礎實驗研究表明,矢志方能降低HUA 小鼠和HUA 大鼠UA 水平、改善HUA 小鼠和HUA 大鼠腎功能[10-13]。基于本課題組前期研究基礎,本實驗通過建立HUA 小鼠模型,觀察基于Sirt1-Foxo1 通路矢志方對HUA 小鼠腎組織和高UA 誘導HK2 細胞ERS 相關蛋白表達的影響,以期為矢志方的臨床應用提供更多實驗依據。
1 實驗材料
1.1 動物 選取32 只8 周齡SPF 級雄性BALB/c小鼠,體質量12~22 g,購自上海斯萊克實驗動物,動物許可證號SCXK(滬)2017-0005,倫理證號PZSHUTCM211227011。在上海中醫藥大學實驗動物中心飼養,溫度25 ℃左右,濕度45%左右,12 h 光照,普通飲食飲水喂養。
1.2 實驗細胞 人腎小管上皮細胞HK2,購自中國科學院細胞庫。
1.3 實驗藥物 動物用藥:矢志方(車前子30 g,芥子15 g,王不留行15 g,冬葵子15 g),飲片購自上海中醫藥大學附屬曙光醫院,并委托國家中藥制藥工程技術研究中心制備成中藥復方顆粒劑(1 g 顆粒相當于原方20 g),用蒸餾水配制成70 mg/mL 藥液。非布司他片,40 mg/片,江蘇恒瑞醫藥股份有限公司,批號H20130081,用蒸餾水配制成0.75 mg/mL藥液。
矢志方凍干粉制作流程:稱取炒王不留行、炒芥子各3.6 kg,炒車前子7.2 kg,冬葵子3.6 kg,混合均勻,打粉,粉碎后加入藥材10 倍體積純凈水包煎,先煮1 h,過濾,再加8 倍水浸泡1 h,加熱回流提取2 次,每次1 h。最終得到凍干粉0.9 kg。
細胞用藥矢志方溶液配制:50 mL 試管中加入10 mL 含10%胎牛血清(FBS)、1%P/S 的F12/DMEM完全培養基,稱取矢志方干粉600 mg,加入到試管中,細胞裂解儀30%功率5 min 促進干粉溶解,矢志方溶液終濃度為60 mg/mL。
UA 配置:稱取100 mg UA 加入10 mL 雙蒸水,震蕩混勻充分溶解后濾過使用,UA 溶液終濃度為10 mg/mL。
1.4 主要試劑與儀器 氧嗪酸鉀、羧甲基纖維素鈉(CMCC-Na),上海麥克林生化科技有限公司,貨號分別為P831461、C10097951;UA,美國Sigma 公司,貨號u2875-5 g;Sirt1,美國CST 公司(貨號8469s);內質網跨膜蛋白肌醇酶1α(IRE1α),美國CST 公司(貨號3294s)、武漢Abclonal 公司(貨號A17940);天冬氨酸特異性半胱氨酸蛋白酶(Caspase)12,美國Signalway Antibody 公司(貨號48277)、武漢Abclonal 公司(貨號A22864);增強子結合蛋白同源蛋白(Chop),美國CST 公司(貨號2895s)、武漢Abclonal 公司(貨號A113466);Foxo1,美國CST 公司(貨號2880s);GAPDH,美國Proteintech 公司(貨號60004-I-Ig);α-Tubulin,上海碧云天公司,貨號AF2827;HRP 標記山羊抗小鼠IgG、HRP 標記山羊抗兔IgG,上海碧云天公司,貨號分別為A0216、A0208;PVDF 膜,美國Millipore 公司,貨號IPVH00005。離心機,美國Beckman 公司,型號Avanti J-E;凝膠成像系統,上海天能生命科學有限公司,型號Tanon-5200;生物組織冷凍包埋機,浙江省金華市科迪儀器設備有限公司,型號KD-BM;烘片機,浙江省金華市科迪儀器設備有限公司,型號KD-H;酶標儀,美國BioTek 公司,型號Synergy 2;組織勻漿器,上海凈信科技有限公司,型號JY-24;顯微鏡,日本奧林巴斯公司,型號CX33。
2 實驗方法
2.1 動物分組、造模與給藥 造模及給藥方法參考文獻[8],32 只小鼠適應性飼養1 周后,隨機分為正常組、模型組、非布司他組和矢志方組,每組8 只。正常組用同等體積生理鹽水灌胃,其余各組采用250 mg/kg 氧嗪酸鉀溶液灌胃建立HUA 小鼠模型。4 h 后給予藥物干預即非布司他組灌胃非布司他藥液6 mg/kg,矢志方組灌胃矢志方藥液562.5 mg/kg,參考《中藥藥理實驗方法學》的人與小鼠藥物換算方式和本課題組前期實驗,每只小鼠每10 g 灌胃0.2 mL,每日1 次,正常組和模型組予等體積生理鹽水灌胃,造模與給藥同時進行,連續2 周。
2.2 細胞培養與造模方法 將HK2 細胞用含10%FBS 和1%雙抗的DMEM/F12 培養基于5%CO2、37 ℃恒溫培養箱中培養,細胞密度為90%時進行細胞傳代,取對數生長期細胞進行細胞鋪板,細胞貼壁后用含0.5%FBS 的DMEM/F12 培養基饑餓處理12 h,再進行相應干預,干預24 h 后處理細胞進行后續實驗。將細胞分為正常組,模型組(200 μg/mL UA),中藥組(200 μg/mL UA+300 μg/mL 失志方)。
2.3 取材 第14 日給藥結束后,0.8%戊巴比妥鈉腹腔注射麻醉小鼠,摘取雙側腎臟分別用于病理觀察、蛋白免疫印跡法(Western blot)實驗和免疫熒光染色。
2.4 病理觀察 小鼠腎臟組織經4%多聚甲醛組織固定液固定24 h,梯度脫水、浸蠟、包埋,4 μm 厚度切片,37 ℃烤片12 h,然后進行蘇木精-伊紅(HE)染色、Masson 染色,中性樹脂封片,顯微鏡下觀察小鼠腎臟組織病理形態。
2.5 Western blot 檢測 取20 mg 小鼠腎組織,加入RIPA 裂解液200 μL,勻漿機65 Hz 勻漿1 min,4 ℃、12 000 rpm 離心15 min,離心半徑6 cm。BCA 法測定蛋白濃度,加入上樣緩沖液和生理鹽水配制成濃度為40 μg/μL 的等量蛋白樣品。上樣,120 V 電泳1 h,300 mA、1 h 30 min 轉至PVDF 膜,5%脫脂奶粉室溫封閉1 h,分別加入IRE1α 一抗(1∶1 000)、Sirt1一抗(1∶1 000)、Foxo1 一抗(1∶1 000)、Caspase 12 一抗(1∶1 000)、Chop 一抗(1∶1 000)、α-Tubulin 一抗(1∶1 000)、GAPDH 一抗(1∶5 000),4 ℃孵育過夜;PBST 洗膜3 次,加入HRP 標記的山羊抗小鼠IgG(1∶1 000)、山羊抗兔IgG(1∶1 000),室溫孵育1 h;PBST 洗膜3 次,ECL 化學發光法顯影,凝膠成像系統拍攝。以GAPDH 和α-Tubulin 為內參,計算目的蛋白相對表達量。
2.6 免疫熒光染色 細胞經爬片、干預結束后,4%多聚甲醛室溫固定爬片細胞30 min,室溫通透細胞20 min,加入1%BSA 室溫封閉60 min,加入稀釋的IRE1α 一抗(1∶200)、Sirt1 一抗(1∶1 000)、Foxo1 一抗(1∶1 000)、Caspase 12 一抗(1∶400)、Chop 一抗(1∶400),4 ℃孵育過夜;加入熒光二抗(1∶500),避光孵育1 h,加入DAPI 染細胞核5 min,甘油封片,熒光顯微鏡下觀察。
2.7 免疫組化染色 腎組織石蠟切片脫蠟至水,抗原修復,3%牛血清白蛋白溶液(BSA)室溫封閉30min,加入IRE1α 一抗(1∶100)、Sirt1 一抗(1∶100)、Foxo1一抗(1∶100)、Caspase12 一抗(1∶100)、Chop 一抗(1∶100)。4 ℃孵育過夜,加二抗室溫孵育50 min,二氨基聯苯胺(DAB)顯色,中性樹脂封片,光鏡下觀察,以棕黃色顆粒為陽性表達。
3 統計學方法
采用SPSS22.0 統計軟件和Image J 1.8 軟件進行分析。實驗數據以均數±標準差(±s)表示,多重比較采用單因素方差分析(one-way ANOVA)。P<0.05 表示有統計學意義。
4 結果
4.1 矢志方對模型小鼠腎組織病理形態的影響 與正常組比較,模型組小鼠腎組織結構紊亂,腎小管管腔擴張、管壁變薄,腎間質炎性細胞浸潤,大量藍色膠原纖維沉積;與模型組比較,矢志方組和非布司他組小鼠腎小管管腔擴張、炎性細胞浸潤、藍色膠原纖維集聚程度減少。見圖1。
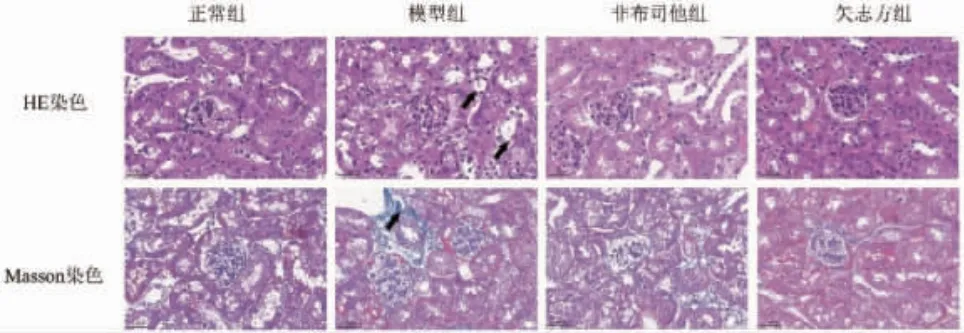
圖1 各組小鼠腎組織形態(×400)Fig.1 Pathological changes of mouse kidney tissue in each group(×400)
4.2 矢志方對高UA 小鼠腎組織和高UA 誘導HK2 細胞Sirt1、IRE1α、Foxo1、Caspase 12、Chop 蛋白表達的影響 Western blot 結果顯示,與正常組比較,模型組小鼠腎組織IRE1α、Foxo1、Caspase12、Chop 蛋白表達顯著升高(P<0.01 或P<0.001),Sirt1蛋白表達顯著降低(P<0.001);與模型組比較,非布司他組小鼠腎組織和矢志方組小鼠腎組織IRE1α、Foxo1、Caspase 12、Chop 蛋白表達顯著降低(P<0.001),Sirt1 蛋白表達顯著升高(P<0.001)。細胞Western blot 結果與HUA 小鼠腎組織Western blot結果趨勢一致,見圖2,圖3。
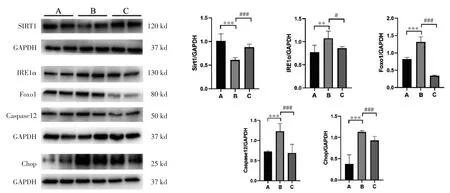
圖2 各組HK2 細胞Sirt1、IRE1α、Foxo1、Caspase 12、Chop 蛋白表達情況(±s)Fig.2 Protein expressions of Sirt1、IRE1α、Foxo1、Caspase 12、Chop in HK2 cells of each group(±s)
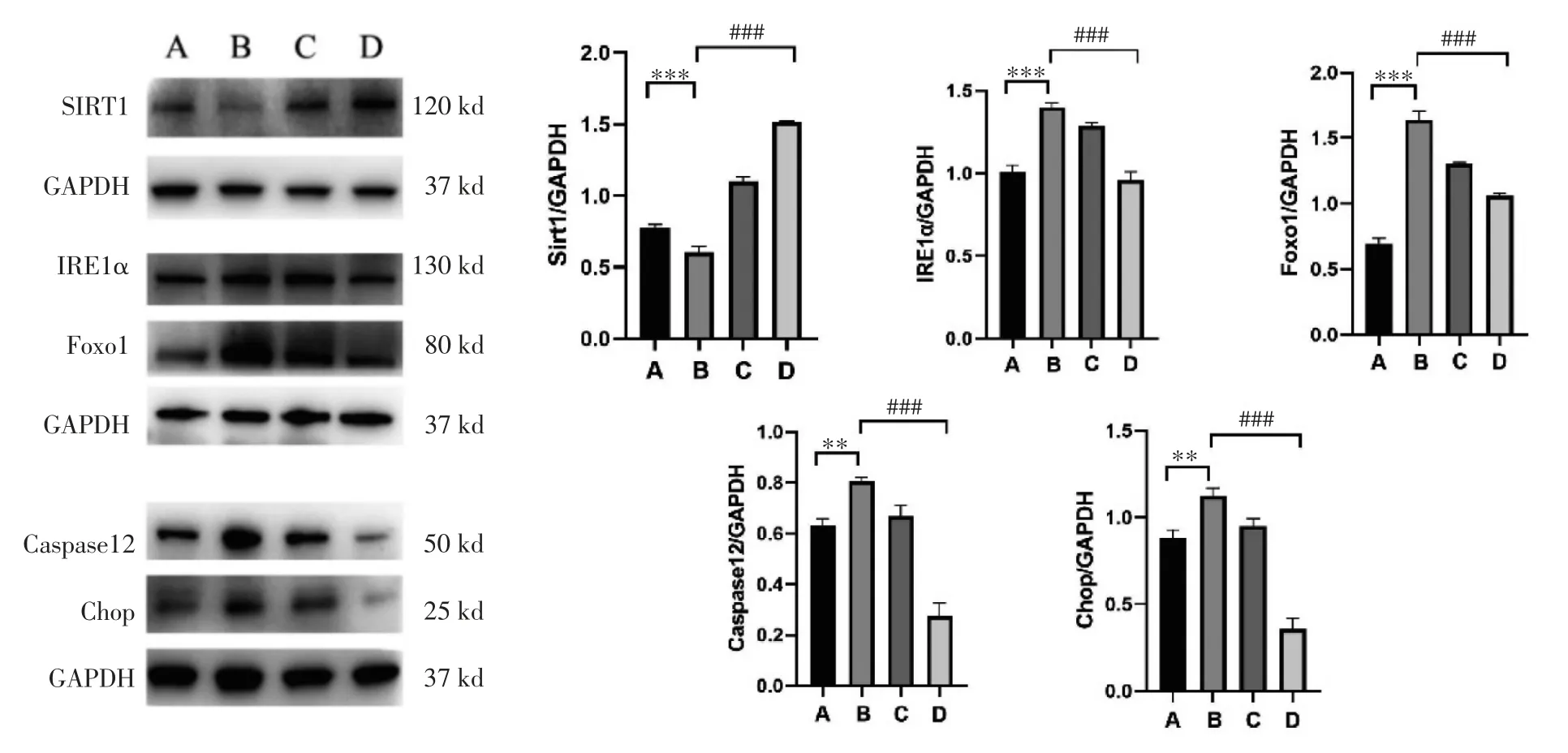
圖3 各組小鼠腎組織Sirt1、IRE1α、Foxo1、Caspase 12、Chop 蛋白表達情況(±s)Fig.3 Protein expressions of Sirt1、IRE1α、Foxo1、Caspase 12、Chop in mouse kidney tissue of each group(±s)
4.3 矢志方對高UA 小鼠小鼠腎組織Sirt1、IRE1α、Foxo1、Caspase 12、Chop 表達的影響 免疫組化染色結果顯示,與正常組比較,模型組小鼠腎組織IRE1α、Foxo1、Caspase 12、Chop 表達顯著升高(P<0.01 或P<0.001),Sirt1 表達顯著降低(P<0.001);與模型組比較,非布司他組和矢志方組小鼠腎組織IRE1α、Foxo1、Caspase 12、Chop 表達顯著降低(P<0.05,P<0.01 或P<0.001),Sirt1 表達顯著升高(P<0.05)。見圖4。
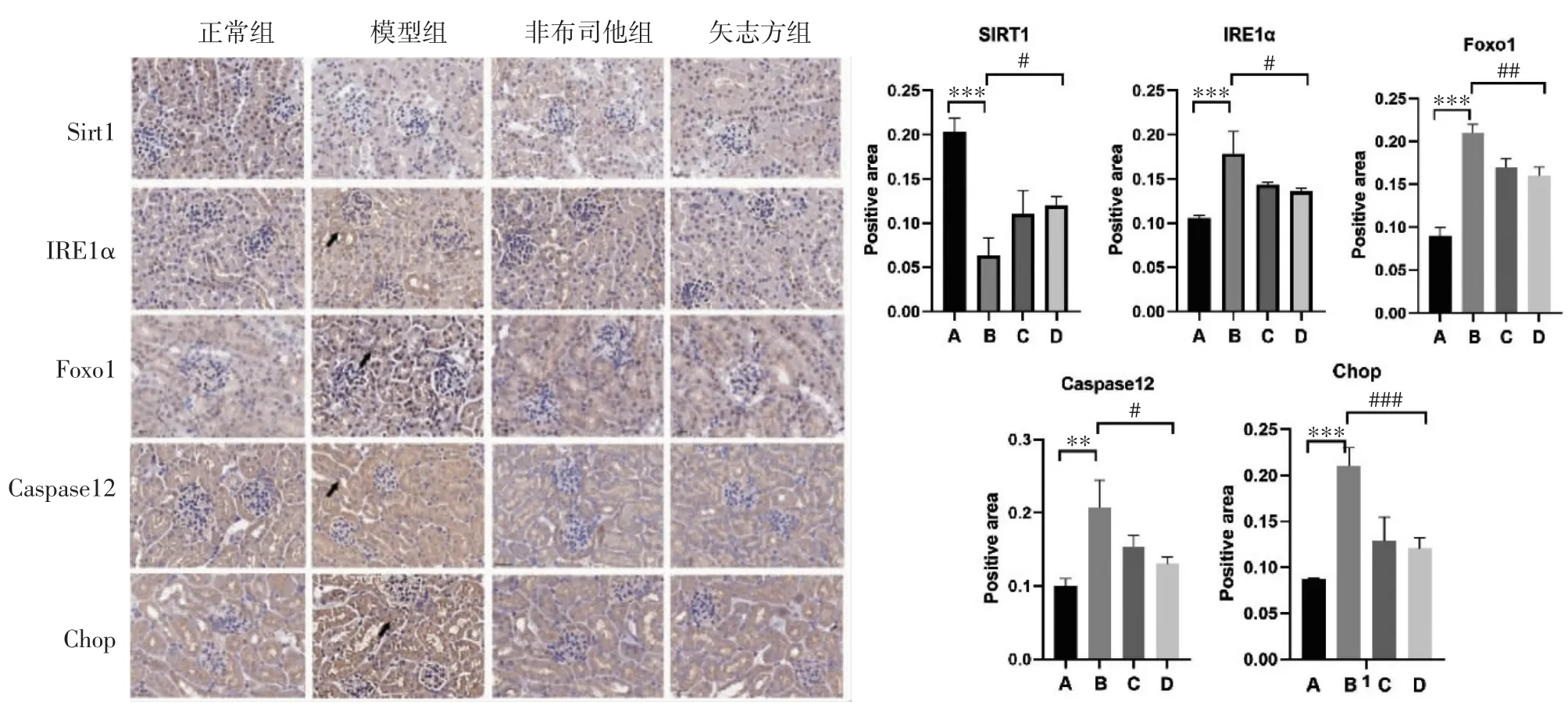
圖4 各組小鼠腎組織Sirt1、IRE1α、Foxo1、Caspase12、Chop 陽性表達情況(免疫組化染色,×400)Fig.4 Postive expressions of Sirt1、IRE1α、Foxo1、Caspase12、Chop in mouse kidney tissue of each group(Immunohistochemical staining,×400)
4.4 矢志方對高UA 誘導HK2 細胞Sirt1、IRE1α、Foxo1、Caspase12、Chop 表達的影響 免疫熒光染色結果顯示,與正常組比較,模型組細胞IRE1α、Foxo1、Caspase 12、Chop 表達顯著升高,Sirt1 表達顯著降低;與模型組比較,矢志方組細胞IRE1α、Foxo1、Caspase 12、Chop 表達顯著降低,Sirt1 表達顯著升高。見圖5-9。
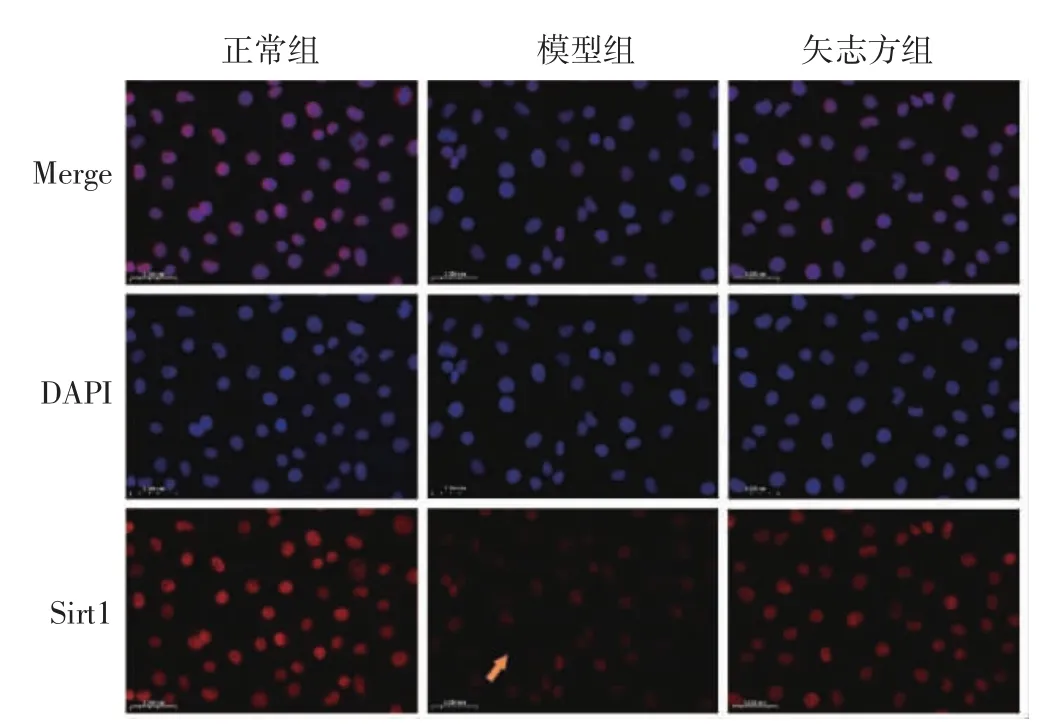
圖5 各組HK2 細胞Sirt1 陽性表達(免疫熒光染色,×400)Fig.5 Postive expressions of Sirt1 in HK2 cells of each group(Immunofluorescence staining,×400)
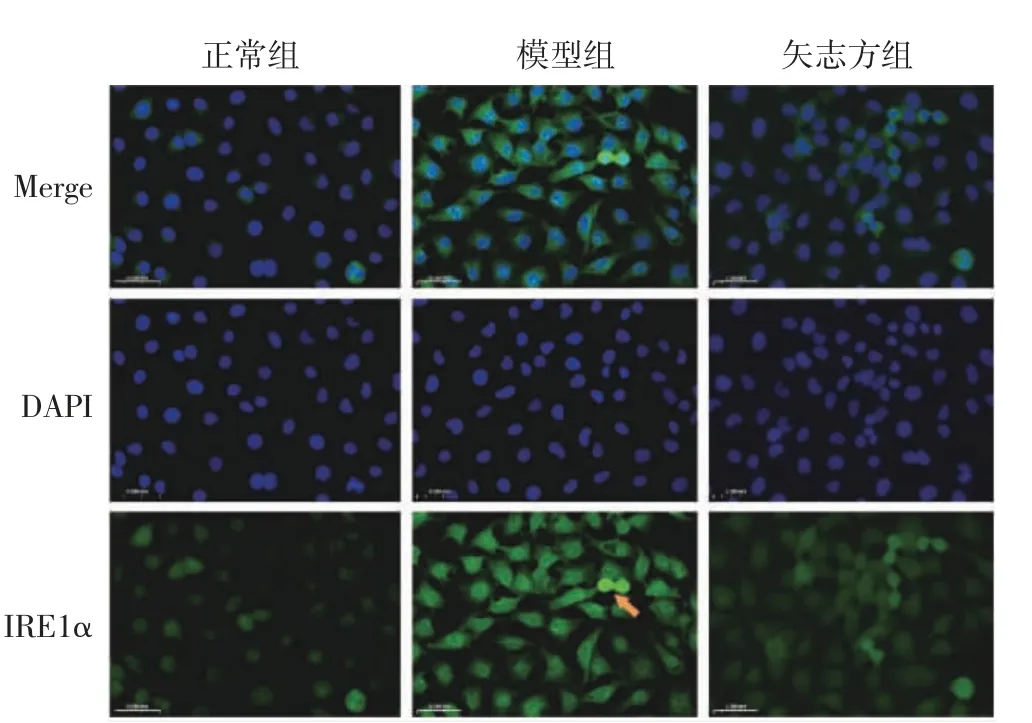
圖6 各組HK2 細胞IRE1α 陽性表達(免疫熒光染色,×400)Fig.6 Postive expressions of IRE1α in HK2 cells of each group(Immunofluorescence staining,×400)
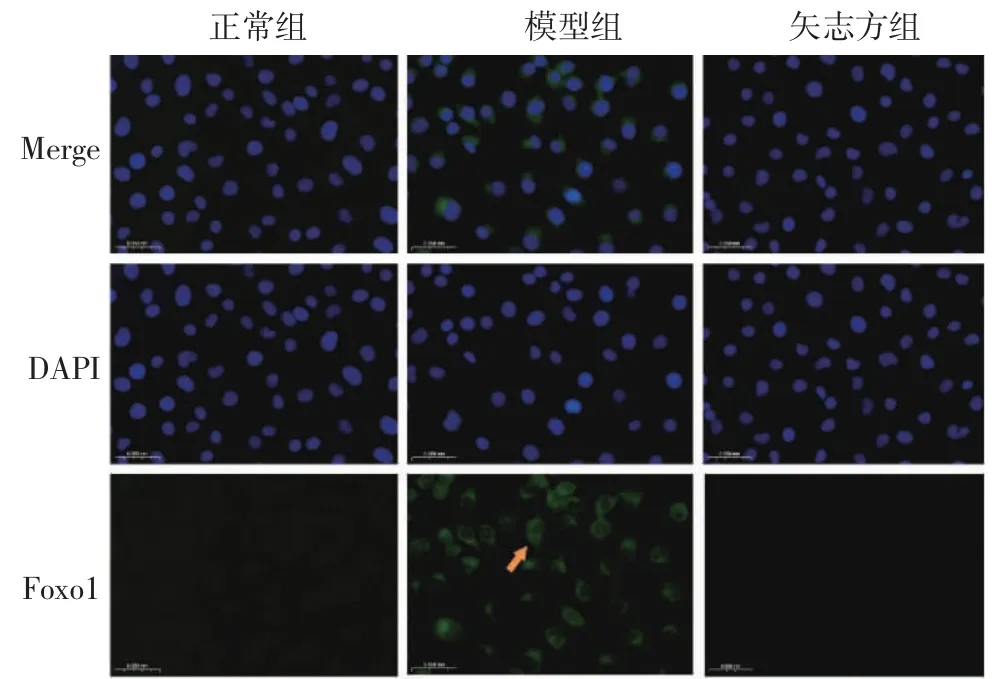
圖7 各組HK2 細胞Foxo1 陽性表達(免疫熒光染色,×400)Fig.7 Postive expressions of Foxo1 in HK2 cells of each group(Immunofluorescence staining,×400)
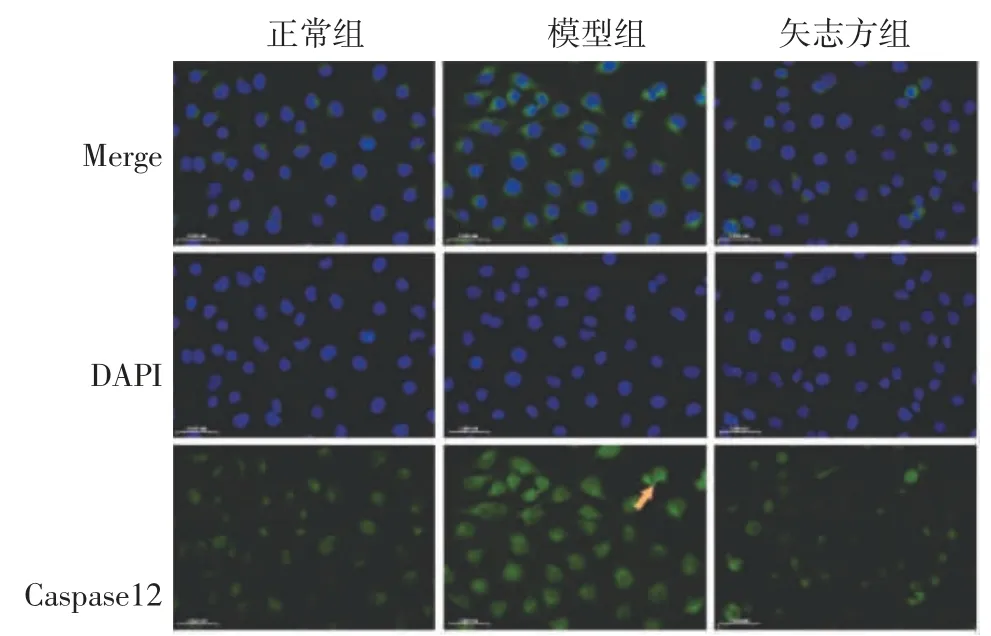
圖8 各組HK2 細胞Caspase 12 陽性表達(免疫熒光染色,×400)Fig.8 Postive expressions of Caspase 12 in HK2 cells of each group(Immunofluorescence staining,×400)

圖9 各組HK2 細胞Chop 陽性表達(免疫熒光染色,×400)Fig.9 Postive expressions of Chop in HK2 cells of each group(Immunofluorescence staining,×400)
5 討論
HUA 引起腎損傷的機制十分復雜,主要包括氧化應激、內皮功能障礙、腎纖維化和炎癥[3]。本課題組前期研究發現矢志方臨床療效顯著,前期基礎實驗研究表明,矢志方能抑制白細胞介素-1β(IL-1β)IL-1β 表達、促進有機陰離子轉運蛋白1/3(OAT1/3)、肝細胞核因子1α/4α(HNF1α/4α)表達減輕HUA 小鼠腎臟損傷。ERS 與腎損傷密切相關[14-15],本研究中發現ERS 的調節因子Sirt1 在HUA 小鼠腎組織中顯著下調,給予矢志方干預后能上調Sirt1 表達水平、矢志方還能抑制ERS、改善腎損傷和間質纖維化。因此,Sirt1 和ERS 可能是HUA 誘導的腎間質纖維化的潛在治療靶點。
內質網是一個表型和功能多樣的傳感平臺,與調節蛋白沉積、脂質代謝、糖異生和鈣信號傳導等多種細胞功能密切相關,是維持和恢復代謝健康的重要組成部分。內質網穩態的紊亂通常被稱為ERS,ERS 是一種功能失衡狀態,通過激活內質網激酶(PERK)/真核起始因子2α(eIF2α)途徑中C/EBP同源蛋白(Chop)、IRE1α-凋亡信號調節激酶1(ASK1)-c-Jun N 端激酶(JNK)通路、IRE1α-X 盒結合蛋白1(XBP1)-Chop 通路、激活Caspase 12 通路調控細胞凋亡。輕度ERS 時,內質網可通過激活未折疊蛋白反應途徑(UPR)啟動自噬以恢復內質網穩態,促使細胞存活;當ERS 刺激過強且持續存在時,會過度誘導自噬或激活凋亡途徑使細胞死亡。
UPR 包括重建內質網穩態的途徑以及觸發凋亡的途徑,即轉錄因子依賴和Caspase 12 依賴的途徑[16]。在轉錄因子依賴的途徑中,葡萄糖調節蛋白78(GRP78)在ERS 激活時與IRE1 解離,IRE1α 的管腔結構域感知未折疊蛋白的積累,從而導致其二聚化和自身磷酸化。這激活了其胞質內核糖核酸酶活性,啟動了兩個獨立的事件來恢復蛋白沉積。一個是通過調節的IRE1 依賴性衰變(RIDD)降解mRNAs,通過IRE1α 切割并去穩定內質網定位的mRNAs,從而減少新合成的蛋白質進入內質網腔所產生的折疊負擔。另一種是X 盒結合蛋白-1(XB P1)mRNA 的非規范特異性剪接[17],XBP1s 還通過絲裂原活化蛋白激酶14(MAPK14)信號的磷酸化在蛋白質水平上受到調節[18]。UPR 的IRE1α-XBP1 途徑是維持代謝穩態的關鍵因素[19-22]。在Caspase 12 依賴性途徑中,鈣離子(Ca2+)從細胞內儲存到胞質溶膠,導致鈣蛋白酶轉移到內質網,使Caspase 12 活化,然后通過Caspase 9 的激活,誘導Caspase 3 依賴的凋亡途徑,以促進細胞凋亡[23]。另外,IRE1 通過上調Chop 轉錄因子,一方面,活化的Chop 上調B 淋巴細胞瘤-2 基因(Bcl-2)家族促凋亡蛋白Bax 發揮促凋亡作用;另一方面,Chop 促進TRAIL 受體2(DR5)的轉錄,活化Caspase 8 依賴的外源途徑的細胞凋亡。表明Chop 在靶向ERS 激誘導的細胞凋亡中發揮了關鍵作用[24]。本研究發現矢志方能在體內體外下調IRE1α、Foxo1、Caspase 12、Chop 蛋白表達水平,表明矢志方能通過抑制ERS 緩解腎臟損傷。
Sirt1 是一種依賴于煙酰胺腺嘌呤二核苷酸(NAD+)的組蛋白去乙酰化酶,參與代謝、衰老、細胞存活、自噬和糖尿病的調節。Sirt1 通過去乙酰化激活各種蛋白質和轉錄因子。Foxo1 是其中一個被Sirt1 去乙酰化的轉錄因子,參與細胞的氧化應激抵抗、細胞凋亡、細胞周期阻滯、胰島素信號轉導和代謝等[25]。有研究報道,Sirt1 存在于細胞核中,但它可以穿梭到細胞質中,作為組蛋白的去乙酰化酶,以及許多非組蛋白靶點[26]。受Sirt11 調控的Foxo 轉錄因子的乙酰化狀態可以選擇性地將Foxos 定向到特定的靶點,是代謝和應激反應的另一個調控途徑[27]。進一步的研究報道,Foxo1 被Sirt1 介導的賴氨酸242、245 和262 的脫乙酰化激活[28]。因為到目前為止已經證明Sirt1 通過調節Foxos 的表達來防止ROS 產生和氧化應激,但是也已經提出增加的氧化應激可以反過來控制Sirt1 活性,但是Foxo 參與該活性的可能性還不清楚[29]。Sirt1 在調節ERS 方面發揮了重要作用,它可通過調控內質網相關分子PERK、GRP78 緩解ERS 減輕阿霉素引起的心臟毒性[30]。本研究結果表明Sirt1 在受高UA 刺激后表達降低,而矢志方能顯著激活Sirt1 水平,改善腎臟損傷,并且下調ERS 相關蛋白,說明Sirt1 可通過調控ERS 減輕HUA 所導致的腎損傷。
綜上所述,矢志方可減輕HUA 小鼠腎臟損傷,其機制與激活Sirt1-Foxo1 通路抑制ERS 相關蛋白及下游Chop、Caspase 12 蛋白表達有關。然而,HUA引發ERS,以及進一步導致腎損傷并沒有完全了解,還有待進一步研究。

