基于加權基因共表達網絡分析探究養肺方治療非小細胞肺癌的作用機制及實驗驗證*
莊垚雪,林事成,劉殿娜,高磊,孫靜宜,魏佳,李泉旺
1.北京中醫藥大學,北京 100029; 2.北京中醫藥大學東方醫院,北京 100078
肺癌是全球范圍內發病率較高的一類疾病,其死亡率位居各類癌癥的第一名,非小細胞肺癌(non-small cell lung cancer,NSCLC)約占肺癌的85%[1-2]。NSCLC早期治療以根治性手術聯合放化療為主,中晚期治療以放化療為主,復發率較高,生存期不佳[3]。多項國內外研究證明,中醫藥具有較好的抗腫瘤輔助治療及對癥支持治療療效,能夠顯著提高腫瘤患者的總生存期[4-6]。首都名醫王沛教授認為肺癌的主要病機是正氣內虛,從而導致肺絡受損、痰瘀毒聚,故以益氣養陰為法,以“扶正”作為治療之本,以沙參麥冬湯為基礎,自擬養肺方以滋陰扶正、解毒散結,臨床觀察表明具有較高的安全性及較好的臨床療效[7-8]。本文首先通過網絡藥理學聯合加權基因共表達網絡分析(weighted correlation network analysis,WGCNA)初步探究養肺方治療非小細胞肺癌的核心靶點、關鍵通路,然后基于非小細胞肺癌PC9細胞進行實驗驗證,以期為臨床養肺方抗肺癌的應用及中醫藥防癌治癌機制的闡明提供參考。
1 基于網絡藥理學和加權基因共表達網絡分析探究養肺方治療非小細胞肺癌的作用機制
1.1 資料與方法
1.1.1 養肺方活性成分、靶點的篩選在中藥系統藥理學數據庫與分析平臺(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)[9-10]查找養肺方組方中藥的化學成分,篩選條件為口服生物利用度(oral bioavailability,OB)≥30%、類藥性指數(drug-likeness,DL)≥0.18,確定養肺方的活性成分。利用中醫藥百科全書(the encyclopedia of traditional Chinese medicine,ETCM)預測養肺方活性成分相關靶點[11],以Tanimoto>0.8作為篩選標準,獲得養肺方的總靶點。
1.1.2 差異基因分析運用GEO平臺[12]下載基因芯片GSE118370。采用GEO2R歸一化數據并分析差異基因,差異基因篩選標準:|logFC|≥1且P<0.05。R包ggplot2[3.3.3版本]繪制PCA圖、熱圖和火山圖。
1.1.3 WGCNA分析WGCNA是用于描述不同樣本之間基因關聯模式的生物學方法[13]。運用 WGCNA R studio函數(R包)構建共表達網絡,軟閾值估算運用pick Soft Threshold 函數。根據基因的內部連通性和軟閾值,將mRNA聚集成不同的共表達模塊,進而構建拓撲重疊矩陣(topological overlap matrix,TOM),利用hclust函數對TOM進行層次聚類,并根據拓撲重疊異度(1-TOM)對基因進行分組,最后利用dynamic tree cut算法來確定基因模塊。Module member ship(MM)是基于基因表達水平的不同,通過計算模塊中基因與模塊特征基因的相關性的高低,從而確定模塊中的關鍵基因,MM值高說明模塊中的基因關聯性越高[11]。
1.1.4 “藥物-成分-靶點”網絡的構建利用Cytoscape 3.7.2軟件,導入養肺方組方中藥、有效成分及相關靶點基因和NSCLC差異基因構建的“藥物-活性成分-靶點”網絡文件,進而構建“藥物-活性成分-靶點”可視化網絡。網絡圖的節點(node)分別為藥物、活性成分、靶點。各節點之間的相互關系以邊(edge)表示。利用 CytoNCA 插件對網絡圖進行分析,設置“節度值(Dgree DC)>2倍中位數”,篩選養肺方治療NSCLC的有效藥效成分。
1.1.5 蛋白相互作用(protein-protein interaction networks,PPI)網絡的構建將WGCNA中篩選出的Hub基因與藥物靶點取交集得到治療靶點,導入STRING11.15平臺[11,14]進行PPI網絡構建,通過Cytoscape 3.7.2中的CytoHubba[15]篩選出核心治療靶點。
1.1.6 富集分析利用ClusterProfiler R包[16]進行基因本體(gene ontology,GO)功能富集分析和京都基因與基因組百科全書(kyoto encyclopedia of genes and genomes,KEGG)信號通路富集分析,Org.Hs.eg.db包用于ID轉換。GO分析主要包括生物過程(biological process,BP)和分子功能(molecular function,MF)及細胞組分(cellular component,CC),以P<0.05為篩選標準,選取前20條GO條目及KEGG信號通路進行可視化,并采用ggplot2包進行氣泡圖繪制。
1.2 結果
1.2.1 養肺方活性成分及靶點在TCMSP數據庫中篩選出65個養肺方活性成分;通過ETCM數據庫對活性成分靶點進行進一步預測,共獲得283個藥物靶點。

表1 養肺方治療NSCLC有效藥效成分信息
1.2.2 NSCLC差異基因分析運用GEO平臺下載基因芯片GSE118370后,利用GEO2R歸一化數據并分析差異基因,以|logFC|≥1且P<0.05為條件進行篩選,共獲得差異基因1 192個,其中上調基因314個,下調基因878個。采用R包ggplot2[3.3.3版本]繪制差異基因的火山圖、PCA圖及熱圖。見圖1。

注:A:基因歸一化圖;B:差異基因火山圖;C:差異基因PCA圖;D:差異基因熱圖。
1.2.3 WGCNA分析運用 WGCNA R studio函數(R包)構建共表達網絡,軟閾值β標準為R2>0.50,β=9,最終獲得14個不同表達類型歸納的模塊,grey模塊被認為是無法被分配給任何模塊的基因集合。以模塊特征屬性為基礎,計算其與臨床表型關聯,發現darkgreen模塊與吸煙表型的相關性最大,其中差異基因32個,相關系數為 0.94(P<0.01)。darkgreen模塊與吸煙表型的相關性最大這一結果可同樣通過模塊-臨床表型聚類分析獲得,以|MM|>0.8及|GS|>0.1為篩選條件,對darkgreen模塊中的32個核心基因進行篩選,共篩選出30個基因。將283個藥物靶點與WGCNA篩選出的30個核心基因取交集,獲得交集靶點基因10個。見圖2。

注:A:標度獨立性圖;B:平均連通性圖;C:模塊特征向量聚類圖;D:基因聚類圖;E:模塊與表型相關熱圖;F:樣本聚類圖;G:GS與MM相關散點圖;H:差異基因圖;I:養肺方靶點及核心差異基因韋恩圖。
1.2.4 “藥物-成分-靶點”網絡利用Cytoscape軟件構建 “藥物-成分-靶點”相互作用關系網絡,見圖3,該網絡包括359個節點和933條邊,其中靶基因節點283個,活性成分節點65個。
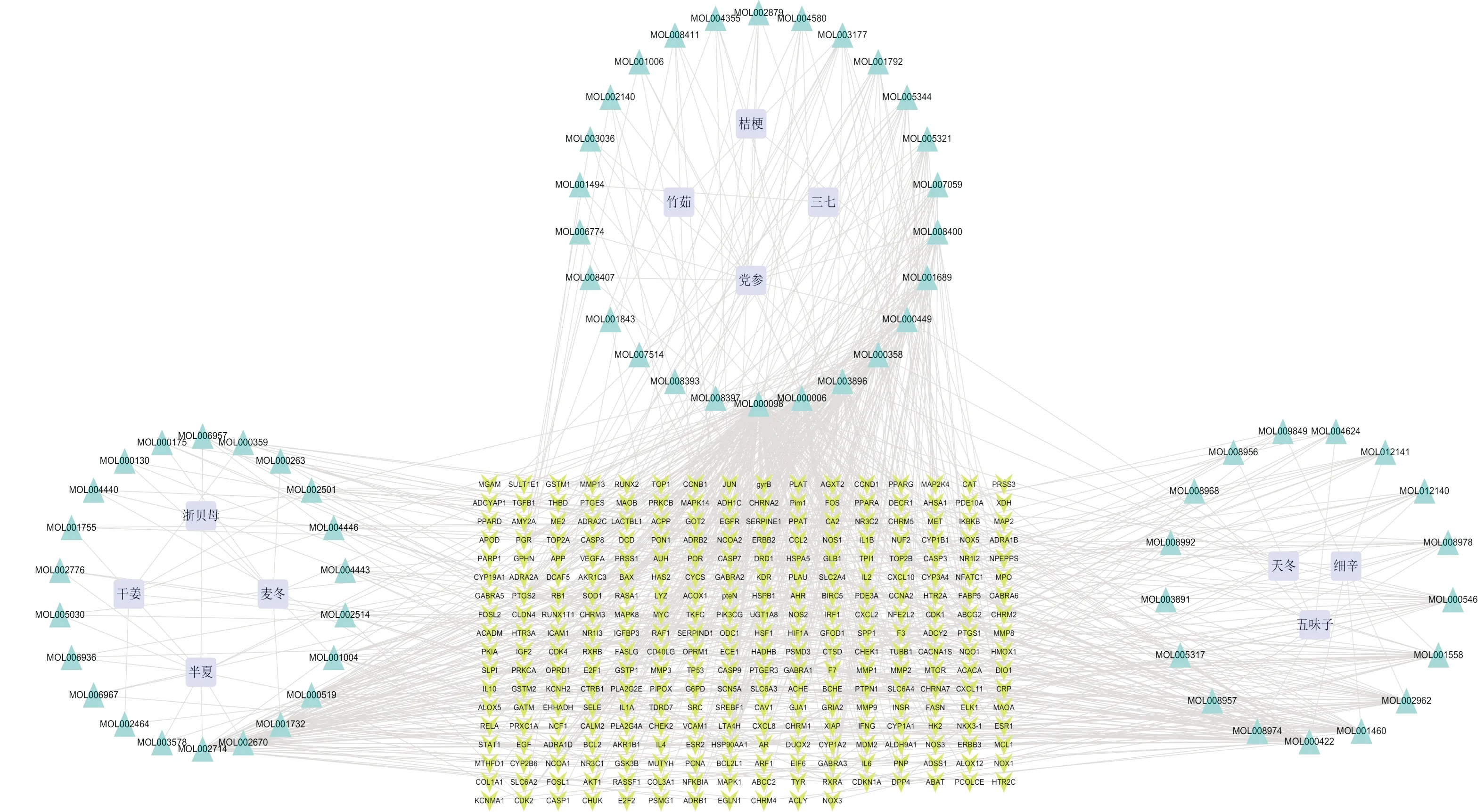
圖3 “藥物-成分-靶點”網絡圖
1.2.5 PPI網絡將10個交集靶點導入STRING網絡平臺構建PPI網絡,該網絡共有8個節點及19條邊,下載網絡文件導入Cytoscape軟件進行可視化,運用CytoHubba計算核心靶點,選取Degree值前5位的靶點,得到核心靶點基因為IL-6、PPARG、TP53、MAPK14、CASP9。見圖4。

圖4 PPI網絡圖及核心靶點圖
1.2.6 富集分析將10個基因利用ClusterProfiler包[17]進行KEGG和GO分析,P<0.05作為篩選標準,共篩選出869個BP條目,70個MF條目(未能富集出符合標準的細胞組分)及82個KEGG富集條目,前20個條目見圖5。BP主要涉及對炎癥反應的調節作用(regulation of inflammatory response)、類固醇激素反應(response to steroid hormone)、細胞對環境刺激的反應(cellular response to environmental stimulus)、白細胞凋亡過程(leukocyte apoptotic process)等;MF主要涉及磷酸酶結合(phosphatase binding)、蛋白磷酸酶結合(protein phosphatase binding)、泛素-樣蛋白連接酶結合(ubiquitin-like protein ligase binding)、泛素蛋白連接酶結合(ubiquitin protein ligase binding)及RNA聚合酶II轉錄因子結合(RNA polymerase II transcription factor binding)等;KEGG富集通路主要為Wnt信號通路(Wnt signaling pathway)、PI3K-Akt信號通路(PI3K-Akt signaling pathway)、Notch信號通路(Notch signaling pathway)、MAPK信號通路(MAPK signaling pathway)等。
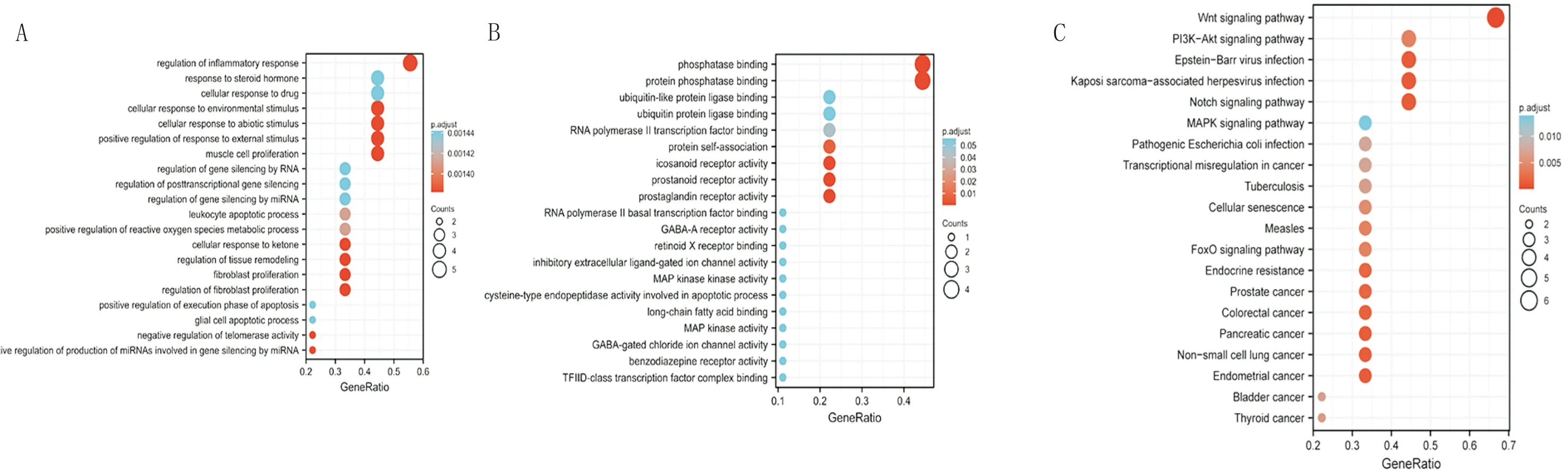
注:A:GO富集分析BP條目氣泡圖;B:GO富集分析MF條目氣泡圖;C:KEGG富集分析氣泡圖。
2 基于PI3K/AKT通路研究養肺方對NSCLC PC9細胞凋亡的影響
2.1 材料
2.1.1 動物與細胞人肺腺癌PC9細胞株(浙江美森細胞科技有限公司,貨號:CTCC-400-0185)。Wistar大鼠,雄性,40只,體質量為(200±20)g,購自斯貝福生物技術有限公司,許可證號為SCXK(京)2019-0010。Wistar大鼠購回后飼養于北京中醫藥大學東方醫院實驗動物中心SPF級動物房,飼養條件:溫度(24±2) ℃,濕度50%±10%,標準飼料喂養,自由進食水,晝夜12 h交替。本次實驗得到北京中醫藥大學東方醫院實驗動物倫理委員會批準,倫理審查號為202020。
2.1.2 藥物與試劑養肺方(顆粒劑,北京康仁堂藥業有限公司)。胎牛血清、胰蛋白酶、青霉素/鏈霉素(美國GIBCO公司,貨號:10099141、25200056、15140122);DMEM高糖培養基(美國 Hyclone公司,貨號:SH30022.01);RIPA(強)裂解液(上海碧云天生物技術有限公司,貨號:P0013K);BCA蛋白定量試劑盒(江蘇凱基生物技術股份有限公司,貨號:KGP902);Reveraid First Strand cDNA Synthesis Kit試劑盒(美國Thermo Fisher Scientific公司,貨號:K1622);SYBR qPCR SuPerMixPlus試劑盒(蘇州近岸蛋白質科技股份有限公司,貨號:E096-01a);NucleoZol RNA提取試劑(基因科技公司,貨號:740404.6);Tunel檢測試劑盒(北京基譜生物科技有限公司公司,貨號:GPB1829);p-蛋白激酶B(protein kinase B,AKT)多克隆抗體(美國Cell Signaling Technology公司,貨號:4060);p-磷脂酰肌醇 3-激酶(phosphatidylinositol 3-kinases,PI3K)多克隆抗體(美國Abcam公司,貨號:ab182651);山羊抗兔IgG、山羊抗鼠IgG(美國Proteintech公司,貨號:30000-0-AP、SA00001-1)。
2.1.3 儀器熒光定量PCR儀(美國Thermo Fisher Scientific公司,型號:ABI7300);小型垂直電泳轉印系統(美國 BIO-RAD公司,型號:1658033);多功能酶標儀(美國MD公司,型號:MK3)。
2.2 方法
2.2.1 含藥血清制備黨參15 g,天冬12 g,麥冬15 g,五味子6 g,浙貝母12 g,清半夏15 g,細辛 3 g,干姜6 g,竹茹9 g,三七6 g,桔梗9 g,顆粒沖泡,制成濃度為40 g·mL-1的藥液。適應性喂養大鼠3 d,隨機分為養肺方組和空白組,每組20只。養肺方組大鼠每日灌胃養肺方溶液,空白組大鼠每日灌胃蒸餾水,每日灌胃2次,灌胃體積為10 mL·kg-1,連續灌胃7 d,最后1次灌胃1 h后腹主動脈取血,末次給藥灌胃前一晚禁食不禁水。腹主動脈取血離心滅菌后獲得含藥血清。
2.2.2 細胞培養PC9培養條件為37 ℃、5%CO2,根據實驗安排將細胞隨機分為對照組及養肺方組。完全培養基含10%胎牛血清或不同比例含藥血清及1%青霉素/鏈霉素。待細胞生長90%~100%時以13比例傳代。取對數生長期的細胞進行實驗。
2.2.3 細胞活力測定將PC9細胞接種到96孔板中,每孔5 000個細胞,每組設置3個重復孔,并設空孔組。培養12 h后細胞分別用不同濃度含藥血清(20%空白組大鼠血清、2.5%含藥大鼠血清+17.5%空白組大鼠血清、5%含藥大鼠血清+15%空白組大鼠血清、10%含藥大鼠血清+10%空白組大鼠血清、15%含藥大鼠血清+5%空白組大鼠血清、20%含藥大鼠血清)的培養基處理。在處理24 h后,棄培養基,并向每個孔中加入含10 μL CCK8試劑的新鮮培養基100 μL。繼續培養4 h后采用酶標儀檢測每組細胞在450 nm處的光密度(optical density,OD)值,計算各組細胞的細胞活力。細胞活力(%)=[(實驗組OD值-空白孔OD值)/(對照組OD值-空白孔OD值)]×100%[17]。
2.2.4 蛋白質免疫印跡分析細胞分為對照(20%空白組大鼠血清)組及養肺方組(10%含藥大鼠血清+10%空白組大鼠血清),培養于6孔板中。給藥完畢后,將裂解溶液加入孔中以收集樣品。在12 000×g,4 ℃離心20 min后采用BCA蛋白濃度測定法測定各樣本蛋白濃度,依據測定結果將所有樣本總蛋白濃度統一調至1 g·L-1。100 ℃高溫煮沸10 min使蛋白變性以便于保存。SDS-PAGE電泳,取10 μL樣本上樣,80 V恒壓電泳,條帶至底部時停止電泳,100 mA恒流電轉100 min,已完成電泳電轉的PVDF膜加入快速封閉液封閉30 min結合PVDF膜上無關蛋白反應位點,加入11 000、12 000 稀釋的p-PI3K、p-AKT一抗工作液及15 000 稀釋的GAPDH 4 ℃過夜,加入15 000 稀釋的山羊抗兔(鼠)二抗室溫孵育1 h,超敏ECL發光液孵育后顯影,ImageJ軟件分析條帶灰度值。
2.2.5 實時定量熒光PCR分析細胞分為對照組(20%空白組大鼠血清)及養肺方組(10%含藥大鼠血清+10%空白組大鼠血清)。總RNA提取及濃度測定依據NucleoZol RNA提取試劑說明書完成。反轉錄獲得cDNA后進行擴增,擴增反應體系為2×NovoStart?SYBR qPCR SμperMix Plμs 10μL,上下游引物各1 μL,模版cDNA 1 μL,ROX I 0.4 μL,RNase Free Water 6.6 μL。使用ABI 7300 qRT-PCR系統檢測相關mRNA的表達,反應條件:95 ℃ 1 min,95 ℃ 20 s,60 ℃ 1 min,共 40個循環,最后一步 60 ℃時記錄熒光信號,依程序設定溶解曲線,按照 2-ΔΔCt計算mRNA的相對表達量。引物序列為:PI3K:上游引物:5′-ACTGAAGCAGATGTTGAACAAC-3′,下游引物:5′-CATCGATCATTTCCAAGTCCAC-3′;AKT:上游引物:5′-TGACCATGAACGAGTTTGAGTA-3′,下游引物:5′-GAGGATCTTCATGGCGTAGTAG-3′。β-ACTIN:上游引物:5′-CCTGGCACCCAGCACAAT-3′,下游引物:5′-GGGCCGGACTCGTCATAC-3′。
2.2.6 細胞凋亡檢測細胞分為對照組(20%空白組大鼠血清)及養肺方組(10%含藥大鼠血清+10%空白組大鼠血清)。分組給藥后,收集細胞,制備細胞爬片,4%多聚甲醛固定,PBS漂洗后加入500 μL 透膜液,室溫水平搖床孵育15 min。PBS漂洗后,滴加50 μL Tunel檢測液37 ℃孵育5 min。棄去檢測液,PBS漂洗,滴加50 μL Tunel試劑于濕盒內37 ℃孵育90 min。棄掉Tunel試劑,PBS漂洗,滴加50 μL FITC試劑工作液37 ℃避光孵育30min。PBS漂洗,爬片稍甩干后用抗熒光淬滅封片劑(含DAPI)封片。樣本于熒光顯微鏡下觀察,每個樣本隨機挑選3個視野,計算細胞總數及陽性細胞數。DAPI染出來的細胞核為藍色,TUNEL陽性表達的細胞為綠色。
2.3 結果
2.3.1 CCK8結果各實驗組PC9細胞經過 24 h 不同濃度養肺方含藥血清干預后,與對照組比較,細胞活力明顯下降(P<0.05),且不具有濃度依賴性,養肺方含藥血清濃度為10%時,細胞活力最差,且具有統計學差異(P<0.05),因此后續實驗選定養肺方組的藥物干預方式為10%含藥血清。見圖6及表2。
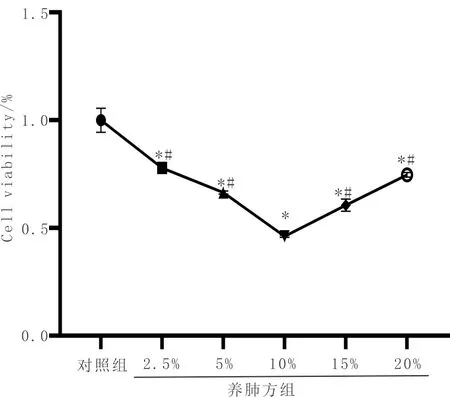
圖6 細胞活力圖
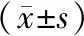
表2 CCK8法檢測細胞活力
2.3.2 養肺方降低PC9細胞PI3K及AKT表達并誘導細胞凋亡與對照組比較,養肺方組p-PI3K、p-AKT蛋白及PI3K、AKT的mRNA表達水平均降低,且差異具有統計學意義(P<0.05、P<0.01)。見圖7、表3及表4。與對照組比較,養肺方組TUNEL染色陽性細胞數增加(P<0.05)。見圖8及表4。

圖7 PI3K/AKT通路相關蛋白條帶圖

圖8 細胞凋亡圖
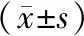
表3 PI3K、AKT蛋白及mRNA表達水平比較
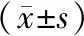
表4 兩組細胞凋亡率比較
3 討論
肺癌為難治性、高發性、高致死性的一類惡性腫瘤,主要治療手段仍為外科手術聯合放、化療,然而放化療在殺滅腫瘤細胞、控制與縮小腫瘤的同時,其嚴重的毒副反應常給患者帶來極大的痛苦,且有效率仍不理想,使患者身心受到嚴重的打擊。因此,在保證一定生存質量的前提下,尋求有效延長生存期的治療方案尤為迫切。前期臨床研究表明,養肺方聯合治療可延長患者生存期,改善臨床癥狀并有效提高生存質量,然其作用機制尚不明晰。故本研究選用人肺腺癌細胞株PC9探討養肺方抑制NSCLC發展的機制。
肺癌在中醫中屬于“積病”“癥瘕”等范疇,治療時可以扶正益氣、化痰散結、養陰生津為基本治則,王沛教授以沙參麥冬湯為基礎方進行加減化裁,以益氣養陰為基礎,佐以扶正化痰之品,最終形成以黨參、麥冬、天冬、五味子、干姜、細辛、清半夏、浙貝母、竹茹、桔梗、三七粉為主要成分的養肺方。方中黨參味甘、性平,主歸脾、肺二經,具有補脾益肺、養陰生津之效,補而不燥故為君藥。麥冬、天冬甘寒質潤,主入肺經,與黨參同用增潤肺生津之效、清甘補之燥烈,故為臣藥。五味子酸甘性溫,主入肺、腎、心經,為補虛強壯收澀之要藥,上可斂肺止咳、下可固腎平喘、內能生津安神、外能固表止汗,與黨參、麥冬、天冬相合則津液得生、諸氣得復,正氣存內而邪不可干;癌多為痰、瘀互結而成,故予半夏燥濕化痰、消痞散結,浙貝母清熱化痰、解毒散結,竹茹清熱化痰、止咳平喘以增強化痰散結之力;然而痰邪久羈最易耗氣傷血,故純用散痰消積之品唯恐耗傷肺氣,取張仲景“病痰飲者,當以溫藥和之”的治療原則,以干姜、細辛溫化痰飲又合五味子以斂肺止咳平喘,則痰飲消、咳喘止、肺氣不傷;三七粉活血而不耗氣、止血而不留瘀;諸藥相合共奏化痰散結、止咳化瘀之效,共為佐藥。桔梗以其升散之力載諸藥上行,主歸肺經引諸藥入肺,又有宣肺化痰之效,故為佐使藥。半夏、貝母、三七均被證明有較好的抗腫瘤療效,然作用機制繁雜,據此本研究先以加權基因共表達聯合網絡藥理學挖掘養肺方治療NSCLC的機制,進而進行體外實驗驗證。
通過挖掘養肺方活性成分及靶點發現,除中藥中常見成分槲皮素、山柰酚、木犀草素、黃芩苷等發揮作用,薯蕷皂苷元、金合歡素及人參皂苷 Rh2同樣作為主要活性成分發揮重要藥理作用,可以抗血管生成、抑制腫瘤細胞侵襲遷移、抗腫瘤細胞增殖并誘導腫瘤細胞凋亡,且主要通過PI3K/AKT信號通路發揮相關作用[18-23]。核心靶點IL-6、PPARG、TP53、MAPK14、CASP9。IL-6、MAPK14、CASP9的高表達與NSCLC的不良預后密切相關[24-26],PPARG、TP53的高表達被證明可抑制NSCLC的發生發展[27-28]。
通過對交集靶點的KEGG富集分析發現,主要包括PI3K/AKT、Wnt、Notch、MAPK等通路,其中PI3K/AKT通路不僅對腫瘤細胞的增殖凋亡、侵襲遷移起到重要作用,并且可以干預上下游靶點或通路以促進腫瘤細胞的增殖及相關藥物耐藥,靶向PI3K/AKT通路的藥物部分已被批準于臨床使用,并取得一定療效[29-31]。在肺腺癌中,IL-6被認為可能是PI3K/AKT通路的上游因子,抑制IL-6/PI3K/AKT信號通路可以抑制肺腺癌細胞的增殖[32]。劉曉麗等[33]研究發現,沉默TP53基因表達可介導PI3K/PTEN/AKT信號通路從而抑制腎透明細胞癌侵襲轉移。Verma等[34]研究發現,MAPK/RAS/RAF/MEK/ERK、PI3K/Akt/mTOR及PPARG下游靶點具有相互串擾的作用。MAPK及PI3K/AKT信號通路在腫瘤中起到協同作用,PI3K/AKT通路的高表達可以激活MAPK通路[35]。PI3K/AKT通路可以誘導糖原合成激酶-3β(GSK-3β)磷酸化[36],磷酸化的GSK-3β可以與β-catenin結合并促進Wnt/β-catenin通路的激活,進而促進肺癌的發生發展并誘導上皮間充質轉化[37]。在NSCLC中Notch1和Notch3的激活突變會促進腫瘤的發生發展及誘導轉移,同時抑制P53的表達從而抑制腫瘤細胞凋亡,Notch信號中的細胞內結構域(NICD)則可以在細胞質或細胞核內與AKT、Wnt等途徑相互作用,以調節靶基因的轉錄[38]。由此推斷,PI3K/AKT通路為本研究富集通路中的關鍵通路,故本研究針對PI3K/AKT通路,應用PC9細胞,初步驗證養肺方抗非小細胞肺癌的作用機制。結合PI3K/AKT通路可以串擾其他相關通路及誘導腫瘤細胞凋亡的作用,推測養肺方可能通過抑制PI3K/AKT通路誘導細胞凋亡。
綜上所述,養肺方治療NSCLC的主要成分分別為槲皮素、山柰酚、木犀草素、黃芩苷、薯蕷皂苷元、金合歡素及人參皂苷 Rh2,主要靶點為IL-6、PPARG、TP53、MAPK14、CASP9,主要通路包括PI3K/AKT、Wnt、Notch、MAPK等通路。體外實驗證明養肺方可以抑制NSCLC PC9細胞活性,并可能通過抑制PI3K/AKT通路誘導腫瘤細胞凋亡。NSCLC的發生發展為多條信號通路的協同串擾作用,并涉及多種細胞因子,本研究初步檢測養肺方發揮抑癌作用的關鍵通路,后續仍需進一步檢測養肺方化合物并分析有效成分,并深入探析相關信號通路間的機制,進一步探究癌細胞凋亡機制,依次驗證活性成分-預測靶點-預測細胞通路的分子機制,并進行體內驗證。

