山東省保健食品生產許可書面審查環節常見問題匯總與對策建議
劉修齊 劉婷婷 王明慧 白潤超 胡曉彤 牛玲曉
摘 要:目的:為提升保健食品生產許可申報資料質量,促進申報企業順利通過保健食品生產許可書面審查,提升審評質量與效率。方法:通過對山東省2021年保健食品生產許可書面審查意見的匯總分析,發現申報資料中存在的共性問題,提出合理建議。結論:企業應強化主體責任意識、加強人員培訓,監管審評部門應加強監督培訓,暢通信息交流渠道,通過高效率審評,切實服務好企業,促進保健食品企業的高質量發展。
關鍵詞:保健食品;生產許可;書面審查;高質量發展
Abstract: Objective: In order to improve the quality of health food license application materials, help health food enterprises to get licenses successfully, improve the quality and efficiency of the review effectively. Method: Through the summary and analysis of the written review opinions on the production license of health food in Shandong province in 2021, the common problems in the application materials were found and reasonable suggestions were put forward. Conclusion: Enterprises should strengthen the awareness of main responsibility, strengthen personnel training, supervision and evaluation departments should strengthen supervision and training, smooth the channels of information exchange, through efficient evaluation, effectively serve enterprises, and promote the high-quality development of health food enterprises.
Keywords: health food; production licence; written review; high quality development
近年來,隨著經濟的發展,人均可支配收入增加,我國人口老齡化速度加快,居民亞健康狀況日益嚴重,國內保健品市場迅速擴大,保健食品的監管越來越受到社會各界的關注[1]。為規范保健食品生產許可審查工作,督促落實企業主體責任,保障保健食品質量安全,原國家食品藥品監督管理總局組織制定了《保健食品生產許可審查細則》(以下簡稱《細則》),自2017年1月1日起施行[2]。根據《細則》要求,保健食品生產許可包含受理、技術審查、行政審批3部分。其中,技術審查包含書面審查和現場核查2個環節。書面審查作為保健食品生產許可技術審查的重要環節之一,依據《細則》要求,需要進行主體資質、生產條件、委托生產情況的審查。本文以山東省2021年開展的保健食品生產許可書面審查情況為數據支持,統計匯總書面審查常見的問題缺陷項,找出共性缺陷問題,提出合理建議,為提升企業申報材料質量、提高審評質量與效率提供技術支持與建議。
1 總體情況
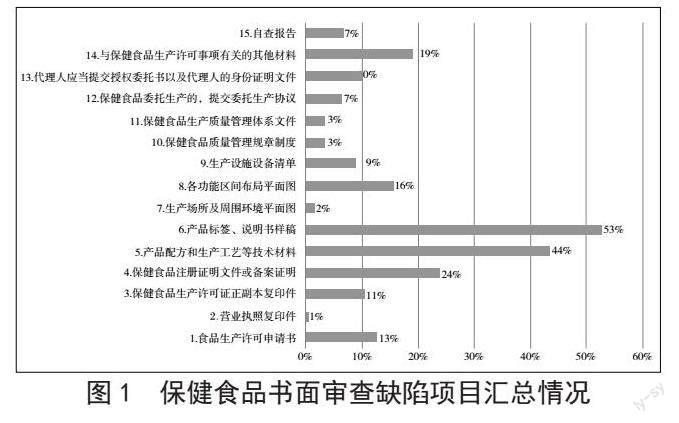
2021年,山東省共計完成保健食品生產許可書面審查313家次,累計2 363個品次。其中,書面審查環節共發起補正189家次,書面補正比例為60.38%。本文按照《保健食品審查許可審查細則》中附件3《保健食品生產許可書面審查記錄表》的內容,將書面審查發現的缺陷項目分類并計算占比,將缺陷問題分為15個模塊,分別為食品生產許可申請書、營業執照復印件、保健食品生產許可證正副本復印件、保健食品注冊證明文件或備案證明、產品配方和生產工藝等技術資料、產品標簽、說明書樣稿、生產場所及周圍環境平面圖、各功能區間布局平面圖、生產設施設備清單、保健食品質量管理規章制度、保健食品生產質量管理體系文件、保健食品委托生產的提交委托生產協議、代理人應當提交授權委托書及代理人身份證明文件、與保健食品生產許可事項有關的其他資料和自查報告。數據統計分析得出,排名前5位的缺陷項目分別為產品、標簽說明書樣稿,占比53%;產品配方及生產工藝等技術資料,占比44%;保健食品注冊證明文件或備案證明,占比24%;與保健食品生產許可事項有關的其他材料(如產品工藝實質性等同的聲明資料等),占比19%;各功能區間布局平面圖,占比16%(見圖1)。
2 存在的主要問題
對189家次書面審查意見進行匯總分析,發現主要存在5個共性缺陷項目。
2.1 標簽說明書樣稿問題
未按照《保健食品標識規定》[3]要求標注。“不適宜人群”內容未略大于“適宜人群”的內容,“不適宜人群”內容未緊跟“適宜人群”內容,藍帽子信息標注不完善,備案產品與注冊產品存在混亂標注的情況。輻照食品的標注方式存在問題。法規要求經電離輻射處理過的保健食品必須在“主要展示版面”的保健食品名稱附近標明“輻照食品”或“本產品經輻照”;經電離輻射處理過的任何配料,必須在該配料名稱后標明“經輻照”。保健食品功能聲稱規范性存在問題。未能及時按照國家食品藥品監督管理總局2018年第23號文的要求[4],自行規范保健食品功能聲稱標識。警示用語規范標注存在問題。未按照《保健食品標注警示用語指南的公告》[5]要求標注“保健食品不是藥物,不能代替藥物治療疾病”警示用語,未劃定警示用語區,或警示用語區所占面積小于銷售包裝主要展示版面所在面面積的20%,未按照相關要求在標簽上標注“投訴服務電話”“服務時段”等信息。
2.2 產品配方和生產工藝等技術資料問題
提交資料的完整性存在問題。無法完整提供出申報產品的配方、工藝流程圖及簡要工藝說明資料,未能明確標注生產工藝中的關鍵控制參數,如干燥工序的溫度控制參數等關鍵信息;配方中原料名稱書寫不規范,配方中預混料及包衣劑的配方組分填報不完整。提交資料的前后一致性存在問題,提交的產品配方及生產工藝與保健食品注冊證書或備案憑證上標注的內容不一致,存在提交的產品配方信息與提交的生產工藝說明或工藝流程圖中的內容不一致的情形。
2.3 保健食品注冊證明文件或備案證明問題
注冊批準證書或備案憑證完整性存在問題,提交的注冊批準證書或備案憑證未包含所有的附件資料。注冊批準證書或備案憑證的有效性存在問題,注冊批準證書上的持有人信息(名稱及地址信息)與現行營業執照不一致,若批準證書或備案憑證發生過變更,未能提交相應的變更證明資料。
2.4 與申報相關的其他資料
申請工藝實質性等同存在問題,申請同劑型免于現場核查的企業未提交產品工藝實質性等同的聲明資料或提交的工藝實質性等同的聲明中內容不完整(未明確已經批準且經過現場核查的同劑型產品名稱)。生產條件未發生變化的聲明資料存在問題,申請免于現場核查的企業未能提交生產條件未發生變化的聲明資料或提交的生產條件未發生變化的聲明資料內容未填報完整,未主動告知企業保健食品監督抽檢及企業是否存在違法生產經營被立案查處的情況。
2.5 各功能區間布局平面圖問題
各功能區間布局圖完整性存在問題,提交的各功能區間平面圖不清晰、功能區間布局圖未包含所有申報劑型及功能區間布局圖未能包含所有生產工序(尤其是具有原料前處理工序的產品)[6]。功能區間布局圖一致性存在問題,企業提交的生產車間平面布局圖、設施設備平面布局圖及凈化空氣流向布局圖無法一一對應,提交的設施設備平面布局圖與申報系統內填報的設施設備等信息無法對應一致。
3 原因分析與應對措施
通過申報日常業務咨詢等途徑的反饋,發現出現上述缺陷問題的原因主要有3點。①企業對于法規的學習不及時、不系統,對于部分法規正式實施的時間節點不夠清晰。例如,法規要求標簽上應標注警示用語,企業均知曉需要標注警示用語這一行為,但對細節上的要求并不清晰,包括警示用語面積要求,字體要求等細節,導致在法規執行上有所折扣。②企業材料申報人員流動性大,人員素質參差不齊。對提出的審核意見的理解存在偏差,部分人員對待審核資料準備的態度有待加強。③溝通渠道及方式較為單一。企業多采取電話咨詢的方式,審評意見溝通因客觀原因存在延時情況。
針對企業申報現狀及常見問題,應從企業及監管兩個方面分別施力,方可迅速有效地提升企業書面審查資料申報效率,有效降低書面補正率,有效提升審評審批速度,切實做好服務企業工作,促進保健食品行業高質量發展。
對于申報企業而言,申報人員的基本素質及企業對于產品生產過程中的質量控制及風險意識始終占據重要位置。①企業應主動擔負起企業主體責任,對申報資料的真實性負責,認真如實準備申報資料,反映企業的真實管理狀況[7]。②產品生產工藝始終是審核的重點,建議企業應理清擬申報產品批件信息,擬申報產品的配方、工藝等技術資料應與批件證書所載內容一致[8]。嚴格遵照法規要求,按照注冊批件或備案憑證載明的信息進行生產。③企業應時刻注重法規的學習與更新,了解最新法規要求,及時做好產品相關申報資料的完善及修改工作。
監管審評部門應認清省內保健食品生產企業的基本發展現狀,了解保健食品企業從業人員的基本情況,通過多種形式進行法規的宣貫與培訓工作,建議利用多媒體手段,有效聯合協會等第三方力量,形成合力。創新法規宣貫方式,如在重要法規實施節點發布通知提醒信息、開展法規知識問答競賽、模范企業評選等形式,增強企業自主學習了解法規的動力。暢通咨詢溝通渠道[9],鑒于保健食品生產劑型的多樣性,企業在申報保健食品生產許可時遇到的問題呈現多樣性,企業本身存在大量的溝通交流需求,在共性問題上,建議審評機構通過積極構建信息定期披露等機制,定期出臺“明白紙”“常見問題解答”等專欄信息,幫助企業解決“燃眉之急”。建議搭建固定平臺,選派固定人員固定時間解答企業咨詢問題,切實提升日常工作中的咨詢服務效率。監管審評人員需要及時更新自身的知識體系[10],掌握最新的法規動態要求,以便更好地指導與服務企業。
4 結語
發展保健食品行業對山東省經濟及和諧社會建設有重要意義。本文從保健食品生產許可書面審查環節的常見缺陷及問題入手,切實為企業提出了技術上的指導與建議。希望在企業及監管審評部門的共同努力下,山東省保健食品企業可以經受住法規帶來的挑戰與機遇,實現山東省內保健食品行業的高質量發展。
參考文獻
[1]耿莉萍.當前我國保健食品市場存在的問題與監管對策[J].食品科學技術學報,2013,31(3):7-12.
[2]國家食品藥品監督管理總局.國家食品藥品監督管理總局關于印發保健食品生產許可審查細則的通知(食藥監食監三〔2016〕151號)[EB/OL].(2016-11-28)[2023-05-11].http://law.foodmate.net/show-189600.html.
[3]衛生部.保健食品標識規定(衛監發〔1996〕第38號)[EB/OL].(1996-07-18)[2023-05-11].http://www.cfe-samr.org.cn/zcfg/bjsp_134/gfxwj/202104/t20210409_684.html.
[4]國家食品藥品監督管理總局.總局關于規范保健食品功能聲稱標識的公告(2018年第23號)[EB/OL].(2018-02-13)[2023-05-11].http://law.foodmate.net/show-193188.html.
[5]國家市場監督管理總局.市場監管總局關于發布《保健食品標注警示用語指南》的公告(國家市場監督管理總局2019年第29號)[EB/OL].(2019-08-20)[2023-05-11].http://law.foodmate.net/show-197642.html.
[6]陳雪嬌.食品生產許可審查視角下的普通食品和保健食品[J].現代食品,2021(7):33-35.
[7]孫淼,胡曉彤,劉修齊,等.《保健食品生產許可審查細則》新規執行中存在的問題與對策建議[J].中國食品藥品監管,2019(4):59-62.
[8]張毅貞,吳天美.廣東省保健食品生產許可技術審查現狀分析[J].科技創業月刊,2018,31(5):126-128.
[9]張毅貞,梁立.保健食品生產許可技術審查變革與應對[J].科技創業月刊,2017(11):97-98.
[10]吳文華,王麗娜,王賀,等.安徽省保健食品生產許可現場檢查情況分析[J].安徽農業科學,2017,45(23):75-79.

