16p13.11 微重復包含NDE1 基因的變異性質在產前診斷中的研究
張苗苗 方玉琴 唐俊湘 王朝紅 孫玉秀 朱健生
安徽醫科大學附屬婦幼保健院(合肥 230000)
隨著檢測技術的提高,染色體微陣列分析(chromosome microarray analysis,CMA)逐漸擴展到產前診斷領域,成為先天性異常和神經發育障礙的一線檢測[1]。因此,發現了越來越多的拷貝數變異(copy number variations,CNVs)。16 號染色體含有很多的低拷貝重復序列,其p 臂10%的區域是由高度同源的片段組成,這些重復片段介導的非等位基因同源重組易形成CNVs。16 號染色體p 臂的復雜結構表明它是新的微重復綜合征的候選區域[2-3]。
16p13.11 屬于神經易感區域,包含14 個已知的編碼蛋白質的基因,其中NDE1 是與神經系統表型相關的最強候選基因[4]。因此,16p13.11 微重復常見的表型為語言遲緩、智力低下、顱面畸形和行為異常,骨骼系統、循環系統、泌尿和消化系統的異常較少見[5-10]。然而,在表型正常的個體中也發現了該重復的攜帶者。有證據表明,16p13.11 微缺失是致病的,而其復制是良性變異[11],也有學者認為,該重復在表型上存在性別差異,男性攜帶者的病變率高于女性[4]。雖然這個區域的缺失是明確與精神障礙性疾病相關,但重復的病例卻很少見導致它的臨床表現達成共識是一個很大的挑戰,并且報道多見于產后病例,而針對產前的較少。因此,本研究旨在探討16p13.11 微重復的基因型-表型的相關性,綜合分析臨床和細胞遺傳學,并評估其在產前診斷中的致病性質,以期為遺傳咨詢提供幫助。
1 資料與方法
1.1 研究對象 本研究共納入2017年1月至2022年8 月在安徽醫科大學附屬婦幼保健院遺傳中心接受CMA 檢測的6 722 例樣本(6 312 份羊水和410 份外周血)。排除517 例具有明確致病表型的變異病例,在排除的病例中未檢測到16p13.11 微重復。剩余6 205 例根據不同的產前診斷指征分為3 組:(1)神經認知障礙患者組,包括61 例精神障礙患者(發育遲緩、智力低下等),但無神經系統結構異常;(2)神經系統異常產前組,包括356 例B 超顯示胎兒神經系統異常(小頭畸形、側腦室增寬等)的孕婦;(3)神經系統無異常產前組,包括5 788 例因其他原因(無創產前檢查高風險、產婦高齡等)行CMA 檢測的孕婦。所有家庭在檢測前都接受了遺傳咨詢,并簽署了知情同意書。本研究得到安徽省婦幼保健院倫理委員會的批準(倫理批號:2207560)。
1.2 檢測方法
1.2.1 CMA 檢測 在孕婦進行羊膜腔穿刺術時抽取羊水,同時從疑似異常的患者中抽取外周血進行CMA 檢測。根據制造商說明書[12],使用Affymetrix CytoScan 750K(Affymetrix,USA)進行SNP 檢測,并使用Affymetrix CytoScan 750K 微陣列分析平臺進行分析。查閱DGV、Decipher、OMIM、UCSC、ISCA和PubMed 等公共數據庫,評估檢測結果的臨床意義,參考已發表的病例報告和病例對照研究進行全面分析。
1.2.2 隨訪 對攜帶16p13.11 微重復的胎兒及父母進行了電話隨訪,并查閱電子醫療記錄。隨訪標準參照Gesell 量表、Wechsler 成人智力量表和0 ~6 歲兒童神經心理發育量表[13],身高和體重以《兒科學》第八版兒童生長曲線為依據。
1.3 統計學方法 數據使用SPSS 20.0 版(IBM,USA)進行分析,采用χ2檢驗確定重復病例的概率。P<0.05 為差異有統計學意義。
2 結果
2.1 CMA 檢測結果 神經認知障礙患者組和神經系統異常產前組均無16p13.11 微重復病例。神經系統無異常產前組中共檢出13 例(case1-13)攜帶16p13.11 微重復的胎兒,所有病例都有相似的該重復,涉及全部的NDE1 基因(chr16:14,892,975-18,172,468)。13 例孕婦的產前診斷指征主要為:唐氏和愛德華氏綜合征高風險(7/13),其中3 例父母進行了CMA 驗證,結果顯示1 例(病例5)變異是新發突變,另外兩例(病例3 和11)是遺傳自表型正常的母親(表1 和圖1 和圖2)。

圖1 染色體16P13.11 微重復區域的表示Fig.1 Scale representation of the microduplication region of chromosome 16P13.11

圖2 染色體16P13.11 微重復胎兒(病例3、5、11 和13)的家族譜系Fig.2 Family pedigree of fetuses(case 3,5,11 and 13)with microduplications of chromosome 16P13.11
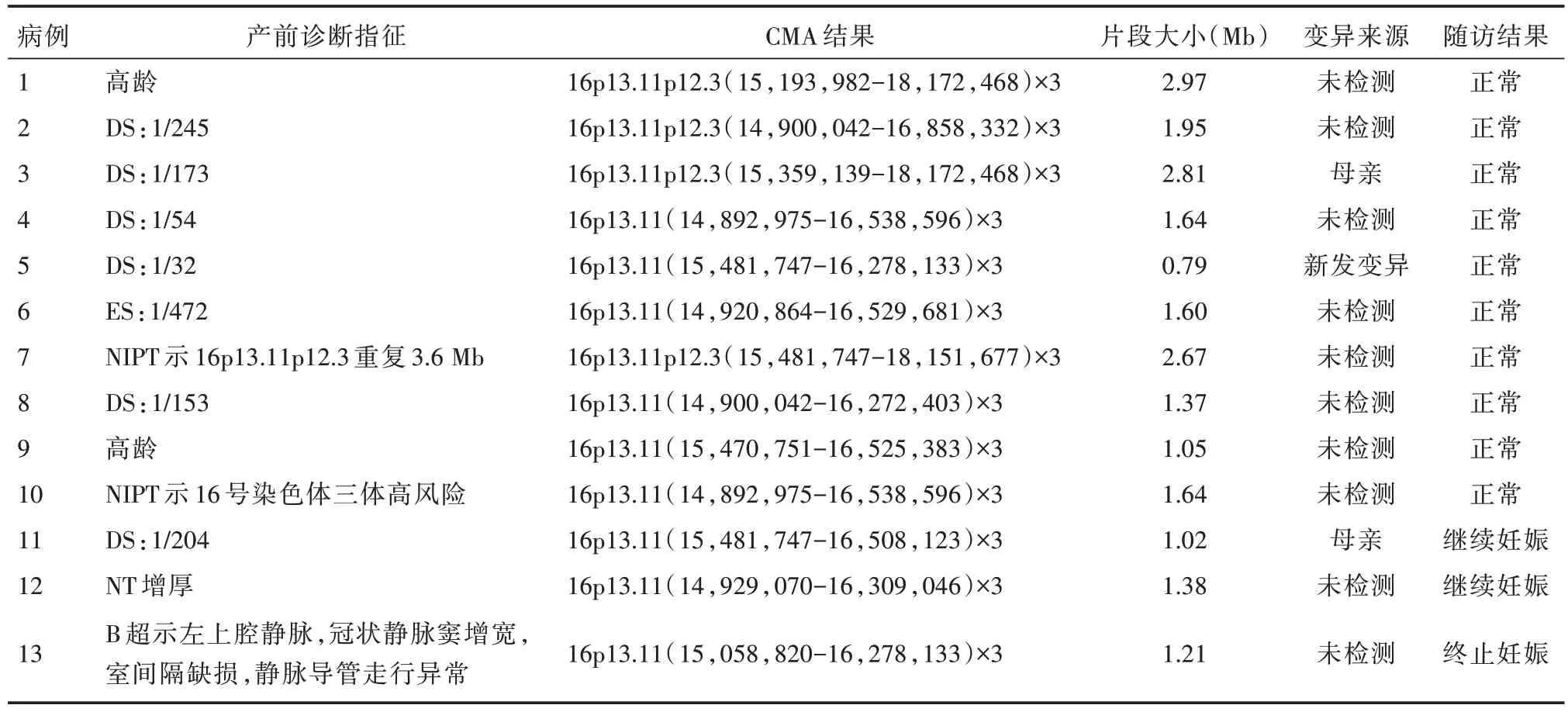
表1 在神經系統無異常產前組中13 例攜帶16p13.11 微重復的病例信息Tab.1 Information of the 13 cases with 16p13.11 microduplication in the prenatal group without abnormal nervous system
2.2 隨訪結果 隨訪13 例攜帶16p13.11 微重復胎兒的妊娠結局。病例13 的父母因為胎兒心臟異常而選擇終止妊娠,病例11 和病例12 的父母繼續妊娠中,且在后期的產檢中未觀察到其他結構異常。其余10 例胎兒(病例1-10)足月出生。我們對胎兒的產后健康進行追蹤,主要關注神經心理發育、顱面畸形、先天性缺陷和骨骼異常等。在這些胎兒中未觀察到明顯的異常,并且他們的生長和發育符合同齡標準,但仍需長期的隨訪調查(表1)。
2.3 16p13.11 微重復檢出率的比較 在神經認知障礙患者組和神經系統異常產前組中未檢測到16p13.11 微重復。神經認知障礙患者組(0.00%)與神經系統無異常產前組(0.22%)的檢出率進行比較,差異無統計學意義(P= 0.711)。由于患者組的樣本量較小,我們將神經系統無異常產前組的檢出率與文獻[4,14]中的患者組進行比較(P=0.489),兩組間的差異也無統計學意義(表2)。
3 討論
CMA 具有高分辨率,準確性高,不需要進行組織培養從而縮短實驗時間的特點,因此特別適合產前檢測[15]。但CMA 的臨床應用存在一定局限性,由于基因型和表型不完全對應,特定CNV 的潛在功能意義可能是未知的,被稱為臨床意義不明(variants of uncertain significance,VOUS)的變異體,最初將3 個區域(16p13.11、15q13bp1-5 和近端1q21)的重復序列歸類為VOUS[16]。由于復雜的臨床異質性以及在“看似”正常的個體中發現相似或相同的微重復,導致在家系研究后,16P13.11 微重復的臨床表型尚存在爭議。因此,本研究通過對病例隊列和對照人群的大數據分析比較,將特定基因組區域與疾病聯系起來,這將極大地提高我們對整個基因組和中樞神經系統功能重要性的認識,并且據我們所知,這是第一篇關于16p13.11 微重復在產前檢測中的臨床致病性報道。
從分子角度來看,NDE1 是16p13.11 片段上與神經系統表型相關的最強候選基因,它是由10 個外顯子組成,編碼中心體蛋白,該蛋白質參與大腦發育過程中的有絲分裂、神經元遷移,在人腦的皮質生長過程中發揮關鍵作用。該蛋白質含有自結合結構域、LIS1 相互作用結構域和C 端保守結構域[17]。NDE1/LIS1/NDEL1 復合物介導細胞內轉運活動,是精神分裂癥通路的一部分[18]。NDE1 基因突變會導致無腦畸形,這是一種以大腦皮層缺乏褶皺、嚴重腦萎縮、小頭畸形和嚴重認知障礙為特征的疾病。然而FUJITANI 等[19]通過NDE1 和FOPNL 的過表達,進行功能獲得性實驗,發現它們的過表達未改變皮質腦室下區,徑向膠質細胞或基底祖細胞的數量。雖然這些基因的拷貝數缺失已經導致了動物模型的神經學表現,但拷貝數增加的表型后果仍然不清楚。因此,這些基因的重復在行為和認知障礙中的作用只是推測,進一步描述這些基因的潛在影響將增強我們對相關臨床表型的理解。
從臨床表型來看,16p13.11 微重復患者具有廣泛的臨床表型并且嚴重程度不同[20-24]。一項研究總結了10 例攜帶16p13.11 微重復患者的臨床表型顯示,5 例患有運動和語言發育遲緩,6 例患有行為異常,2 例患有社交障礙[5]。然而,關于16p13.11 微重復與臨床的相關性不確定,因為攜帶者可能異常,也可能完全正常。HANNES 等[11]發現該變異與正常表型相容,并認為該重復可能是真正的良性變異。我們的發現與其一致,因為在我們的研究中,神經認知障礙患者組或神經系統異常產前組中未檢測到16p13.11 微重復。相反,13 例16p13.11 微重復的攜帶者屬于神經系統無異常產前組。此外,患者組和對照組之間的檢出率沒有顯著差異。由于本研究中患者組的樣本量較小,我們將神經系統無異常產前組的檢出率與文獻中患者組的檢出率進行比較,差異也無統計學意義。特別是1 ~10 例胎兒在出生后未觀察到特異的臨床表型,這支持了我們的假設,即產前檢測到的16p13.11 微重復可能是良性的。這可能與環境因素、不完全外顯率或可變表達有關。但是,我們在產前就發現了這些微重復,需要長期的隨訪來確認該重復是否會有其他臨床癥狀。
我們的病例中有1 例因為胎兒心臟異常而引產。SHIMOJIMA 等[25]描述了1 例并發19p13.3 微缺失的嬰兒,在3 個月大時患有室間隔和主動脈瓣缺損,但在16p13.11 片段上尚未發現與這些疾病相關的基因。16p13.11 微重復臨床表型的多樣性可能與“二次打擊”學說相關,或調節元件microRNA(hsa-miR1972 和hsa-miR484)與其他基因修飾物相互作用導致的[5]。由此可見,16p13.11微重復的致病性復雜,但具體機制尚不清楚。在本研究中,我們將6 722 例樣本匯聚在一起,以確定16p13.11 微重復攜帶者會有哪些臨床表型。具有以下優勢:(1)這是第一篇關于16P13.11 微重復在產前診斷的研究,在孕婦進行遺傳咨詢時,我們的研究有一定的參考價值。(2)我們不僅探討了16p13.11 微重復的臨床表型,并且將臨床表型與分子機制聯系起來,以期幫助對此片段進行更深層次的遺傳學研究。本研究的局限性:(1)缺乏對因心臟異常而引產胎兒的病理學研究,探討其潛在的分子機制。(2)由于父母的焦慮情緒,我們無法獲得更多的樣本進行父母驗證。在后續的研究中,我們將會更加注重樣本的留取和保存,以期在分子機制上有更進一步的研究和發現。
綜上所述,我們在產前檢測中發現了13 例攜帶16p13.11 微重復包含NDE1 基因的胎兒,除1 例引產外,其余12 例均健康。鑒于16p13.11 微重復的低外顯率特征,我們認為16p13.11 微重復很可能是良性的。然而,16p13.11 微重復的可變表達是復雜的,需要進一步研究。此外,盡管所有分娩的嬰兒在撰寫本文時仍保持健康,但這些個體需要持續隨訪。
【Author contributions】ZHANG Miaomiao performed the experiments and wrote the article.FANG Yuqin performed the experiments.TANG Junxiang and WANG Chaohong revised the article.SUN Yuxiu and ZHU Jiansheng designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.

