苦杏仁苷減少冠狀動脈內皮細胞焦亡并改善載脂蛋白E 缺陷小鼠動脈粥樣硬化斑塊形成
劉瑾 張潔 馮瑩
武漢市第一醫院心血管內科(武漢 430000)
動脈粥樣硬化(atherosclerosis,AS)是多種心腦血管疾病的主要病理基礎,在血管壁中可以觀察到細胞死亡的數量增加[1]。細胞焦亡是一種新發現的程序性細胞死亡,與多種心血管疾病有關,包括AS[2-4]。已知生物草藥提取物通常具有多種成分,可誘導多種生物活性。苦杏仁苷(amygdalin,AMY)具有抗炎抗腫瘤和抗AS 等的生物學和藥理學活性[5]。有研究[6]發現,AMY 可減輕AS 并在載脂蛋白E(ApoE)敲除小鼠和骨髓來源的巨噬細胞中發揮抗炎作用。此外,既往研究[7]發現以AMY 為主要成分的補陽還五湯甙對大鼠腦缺血再灌注損傷后的細胞焦亡具有神經保護作用。然而,AMY 是否參與AS 誘導細胞焦亡及其發生機制尚不明確。因此,本研究構建了AS 小鼠模型以及ox-LDL 誘導的人冠狀動脈內皮細胞(HCAECs),探討AMY 是否有效緩解AS 進展以及可能機制,為臨床治療AS 提供新的思路。
1 資料與方法
1.1 一般資料 10 ~12 周齡載脂蛋白E 缺陷(ApoE-/-)雄性小鼠40 只,購自武漢市萬千佳興生物科技有限公司,許可證號SCXK(鄂)2021-0011。本實驗經武漢市第一醫院實驗動物倫理委員會批準進行。
AMY(長沙Staherb天然成分有限公司);HCAECs(美國ATCC 細胞庫);ox-LDL(美國Sigma 公司)。OTC 冰凍切片包埋劑(上海睿鉑賽生物科技有限公司);DMEM 培養液、胎牛血清(美國Hyclone 公司);青霉素-鏈霉素、0.25%胰蛋白酶/EDTA 消化液(美國Sigma 公司);引物合成由上海生工生物合成;轉染試劑Lipofectamine?3000(美國Sigma公司);蛋白裂解液(北京Solarbio 科技有限公司,貨號:R0010);Caspase-1(ab207802)、GSDMD(ab209845)、Gal-3(ab209344)、JMJD3(ab169197)和β-actin(ab8227)一抗及相應二抗(英國Abcam公司);RT-qPCR 試劑盒(Vazyme 生物科技有限公司,貨號:Q511-02);CCK-8 試劑盒(美國MCE 公司,貨號:HY-K0301);總膽固醇(TC),甘油三酯(TG),高密度脂蛋白膽固醇(HDL-C),低密度脂蛋白膽固醇(LDL-C)測定試劑盒(武漢Elabscience Biotechnology 試劑公司);高通量實時熒光定量聚合酶鏈鎖反應(PCR)儀(Roche 公司,瑞士);Western blot 系統(北京六一儀器廠DYY-7C);臺式低溫高速離心機(日本KUBOTA 公司);細胞培養箱(上海力申科學儀器公司);凝膠成像分析儀(廣州瑞豐實驗設備有限公司);倒置顯微鏡(日本Olympus)。
1.2 研究方法
1.2.1 小鼠AS 模型構建及分組 將所有ApoE-/-小鼠維持在受控環境中,光照/黑暗循環為12 h,溫度為(20 ± 2)℃,濕度為(50 ± 2)%。適應環境1 周后,將小鼠分為4 組:對照組(Control)、模型組(Model)、2.5 mg/kg AMY 組、5 mg/kg AMY 組。其中Model、2.5 mg/kg AMY 和5 mg/kg AMY 組小鼠喂食由21%脂肪、19.5%酪蛋白和1.25%膽固醇組成的高脂飲食(HFD)12 周以加速動脈粥樣硬化的發展,Control 組喂食正常飼料。將水溶性白色粉末形式的AMY溶于0.9%鹽水中,使用直徑為0.22 μm 的特定脫氣過濾器過濾AMY 溶液。HFD 喂養12 周后,2.5 mg/kg AMY 和5 mg/kg AMY 組小鼠腹膜內注射2.5、5 mg/kg AMY,Model 組注射相同體積的0.9%鹽水,每天1 次連續4 周。小鼠在二氧化碳窒息處死前12 h 禁食。
1.2.2 小鼠基本生化指標的測定 小鼠禁食過夜后收集血液樣品。在4 ℃以1 000 ×g離心10 min立即分離血漿,取上清分裝。酶比色法測定血清總膽固醇(TC)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)含量。
1.2.3 動脈粥樣硬化病變的油紅O染色分析 將小鼠動脈冷凍切片用油紅O 溶液(0.5%異丙醇溶液,用3∶2 比例的雙蒸水稀釋)在室溫下染色1 h,并用Image J 軟件定量測定主動脈根部脂質沉積和斑塊形成。
1.2.4 細胞培養及分組 將HCAECs置于含10%胎牛血清和1%青鏈霉素(100 U/mL 青霉素、100 U/mL鏈霉素)的DMEM 培養基于37 ℃、5% CO2恒溫箱中培養,每2~3 天更換1 次培養基。當細胞匯合至80%時,用胰蛋白酶消化重懸后按照3∶1 的比例進行傳代培養,每24 小時更換1 次培養基。空白對照組(Control):細胞不做任何處理;ox-LDL:細胞使用20 μg/mL ox-LDL 處理24 h(其中ox-LDL 制備如下:將人低密度脂蛋白在含有10 μmol/L Cu2SO4的磷酸鹽緩沖鹽水中氧化,并加入過量的乙二胺四乙酸以停止氧化。ox-LDL 的純度高于97%,濃度為1.0 ~3.9 mg/mL);50、100 μg/mL AMY:細胞用20 μg/mL ox-LDL 刺激24 h 后添加50、100 μg/mL AMY 處理繼續培養24 h;ox-LDL+AMY+pcDNA-3.1/pcDNA-Gal-3 組:細胞用20 μg/mL ox-LDL 刺激24 h 后轉染pcDNA-3.1/ pcDNA-Gal-3 載體,24 h 后添加100 μg/mL AMY。繼續培養48 h,裂解細胞收集蛋白。
1.2.5 細胞轉染 利用Lipofectamine?3000 分別將pcDNA-3.1 和pcDNA-Gal-3 轉染進HCAECs 中,以pcDNA-3.1 作為對照,具體步驟參照轉染試劑Lipofectamine?3000 制造商說明。
1.2.6 熒光定量-PCR(RT-qPCR)檢測IL-1β 和IL-18表達水平 使用TRIZOL 試劑盒提取總RNA,合成cDNA 模板,用SYBR ExScript qPCR 試劑盒在以下條件下進行:95 ℃預變性2 min,94 ℃變性15 s,55 ℃退火25 s,在72 ℃延伸15 s,進行35 個循環。PCR 產物經1%瓊脂糖凝膠電泳檢測。依據2-ΔΔCt法計算各mRNA 樣本相對表達量。
1.2.7 Western blot檢測蛋白表達 將各組HCAECs按照每孔1 × 105的密度接種于6 孔板。使用RIPA裂解液提取總蛋白,24 h 后采用BCA 法進行蛋白定量。隨后各取30 μL樣品進行SDS-PAGE,將蛋白轉移至膜上,5%脫脂奶粉室溫封閉1 h,加入Ⅰ抗,4 ℃孵育過夜。加入辣根過氧化物酶標記的山羊抗兔Ⅱ抗37 ℃孵育45 min,用ECL 液顯影,使用化學發光試劑盒在化學發光系統檢測,隨后結果采用Image-Pro Plus 6 軟件(Media Cybernetics)分析,以待測蛋白與內參照β-actin 的灰度值比值作為蛋白的相對表達量。
1.2.8 細胞存活率檢測 將HCAECs(1 × 105細胞/孔)接種到96 孔板中,并與不同濃度的AMY 孵育24 h。將細胞加入CCK-8 溶液(10 μL/孔)并培養1 h。然后在450 nm 下測量每個孔的吸光度以確定細胞存活率。
1.2.9 TUNEL 檢測細胞焦亡 根據制造商的方案使用TUNEL 測定試劑盒評估細胞死亡,將細胞用DAPI 染色用于核復染,并在倒置顯微鏡下觀察。從每個樣本的兩個部分隨機選擇圖像。
1.2.10 染色質免疫沉淀檢測 將HCAECs(4 ×106個細胞/孔)接種到10 cm 培養皿中培養24 h,然后使細胞進行標準交聯。將細胞在裂解物中裂解,用JMJD3 和H3K27me3 抗體進行免疫沉淀。用RNA 酶A 和蛋白酶K 處理免疫沉淀的DNA,苯酚-氯仿提取然后乙醇沉淀純化。通過實時PCR 分析純化的DNA 和輸入的基因組DNA。根據制造商的方案,用標準方法計算倍數富集。
1.3 統計學方法 采用SPSS 20.0 進行統計分析,呈正態分布的計量資料以(±s)表示。采用單因素方差分析、Dunnett-t法比較總體和總體中兩樣本均數之間的差異。以P<0.05 為差異有統計學意義。
2 結果
2.1 AMY 對HCAECs 存活率的影響 見圖1A,與Control 組比較,200、400 和800 μg/mL AMY 干預HCAECs后細胞存活率明顯降低(P<0.01)。見圖1B,與Control 組比較,ox-LDL 組HCAECs 存活率降低(P<0.01),而50 和100 μg/mL AMY 相較于ox-LDL組細胞存活率升高(P<0.01)。50 和100 μg/mL AMY 干預細胞36、48 h 時細胞存活率相較Control組明顯降低(P<0.01,圖1C)。因此,本研究選擇AMY 濃度為50 和100 μg/mL 做后續實驗。
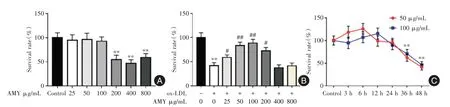
圖1 不同濃度AMY 對HCAECs 存活率的影響Fig.1 Effect of different concentrations of AMY on the survival rate of HCAECs
2.2 AMY 對ox-LDL 誘導的HCAECs 細胞焦亡的影響 與Control組相比,ox-LDL 組Caspase-1(圖2A和2B)和GSDMD(圖2A 和2C)蛋白水平增加,IL-1β 和IL-18 mRNA 水平上調(圖2E-2F),TUNEL 陽性細胞率升高(圖3A 和3B),Gal-3 蛋白表達增加(圖2A 和2D)(P<0.01)。與ox-LDL 比較,50 和100 μg/mL AMY 組Caspase-1、GSDMD 和Gal-3 蛋白水平以及TUNEL 陽性細胞率呈劑量依賴性降低(P<0.05)。
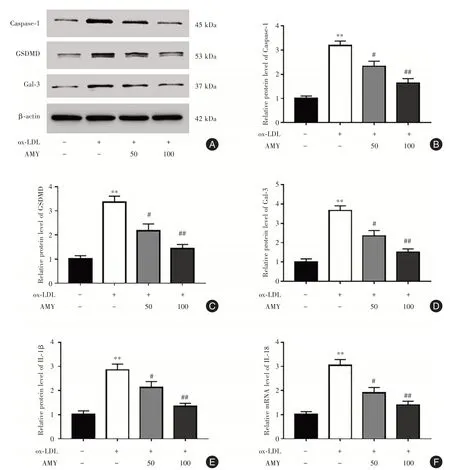
圖2 AMY 干預對ox-LDL 誘導HCAECs 細胞焦亡的影響Fig.2 Effect of AMY intervention on ox-LDL induced pyroptosis in HCAECs

圖3 AMY 干預HCAECs 后的TUNEL 染色Fig.3 TUNEL staining after AMY intervention in HCAECs
2.3 苦杏仁苷能夠抑制JMJD3 介導的Gal-3 去甲基化 與IgG 相比,JMJD3 和H3K27me3 在Gal-3上的富集顯著增加(P<0.01)。與Control 組相比,AMY 組Gal-3 上的JMJD3 富集降低(P<0.01),H3K27me3富集升高(P<0.01),見圖4A。與Control組相比,ox-LDL 組JMJD3 蛋白表達水平明顯增加(P<0.01);而50 和100 μg/mL AMY 組HCAECs 細胞內JMJD3 蛋白表達相較于ox-LDL 組呈劑量依賴性降低(P<0.05)。見圖4C-F,與pcDNA-3.1 比較,pcDNA-JMJD3 組HCAECs 細胞內JMJD3 和Gal-3 mRNA水平以及Gal-3蛋白水平明顯上調(P<0.01);與NC siRNA 相比,JMJD3 siRNA 組JMJD3、Gal-3 mRNA 和蛋白水平顯著降低(P<0.01)。見圖4B。

圖4 AMY 干預對JMJD3 介導Gal-3 表達的影響Fig.4 Effect of AMY intervention on JMJD3 mediated Gal-3 expression
2.4 Gal-3對AMY抑制ox-LDL誘導HCAECs細胞焦亡的影響 與ox-LDL+AMY+pcDNA-3.1 組比較,ox-LDL+AMY+pcDNA-Gal-3 組Gal-3(P<0.01,圖5A-B)、Caspase-1(P<0.05,圖5A 和5C)和GSDMD(P<0.01,圖5A 和5D)蛋白表達水平升高,IL-1β(P<0.05,圖5A 和5E)和IL-18(P<0.01,圖5A 和5F)mRNA 水平上調,TUNEL 陽性細胞率增加(P<0.01,圖6A-B)。見圖5、6。
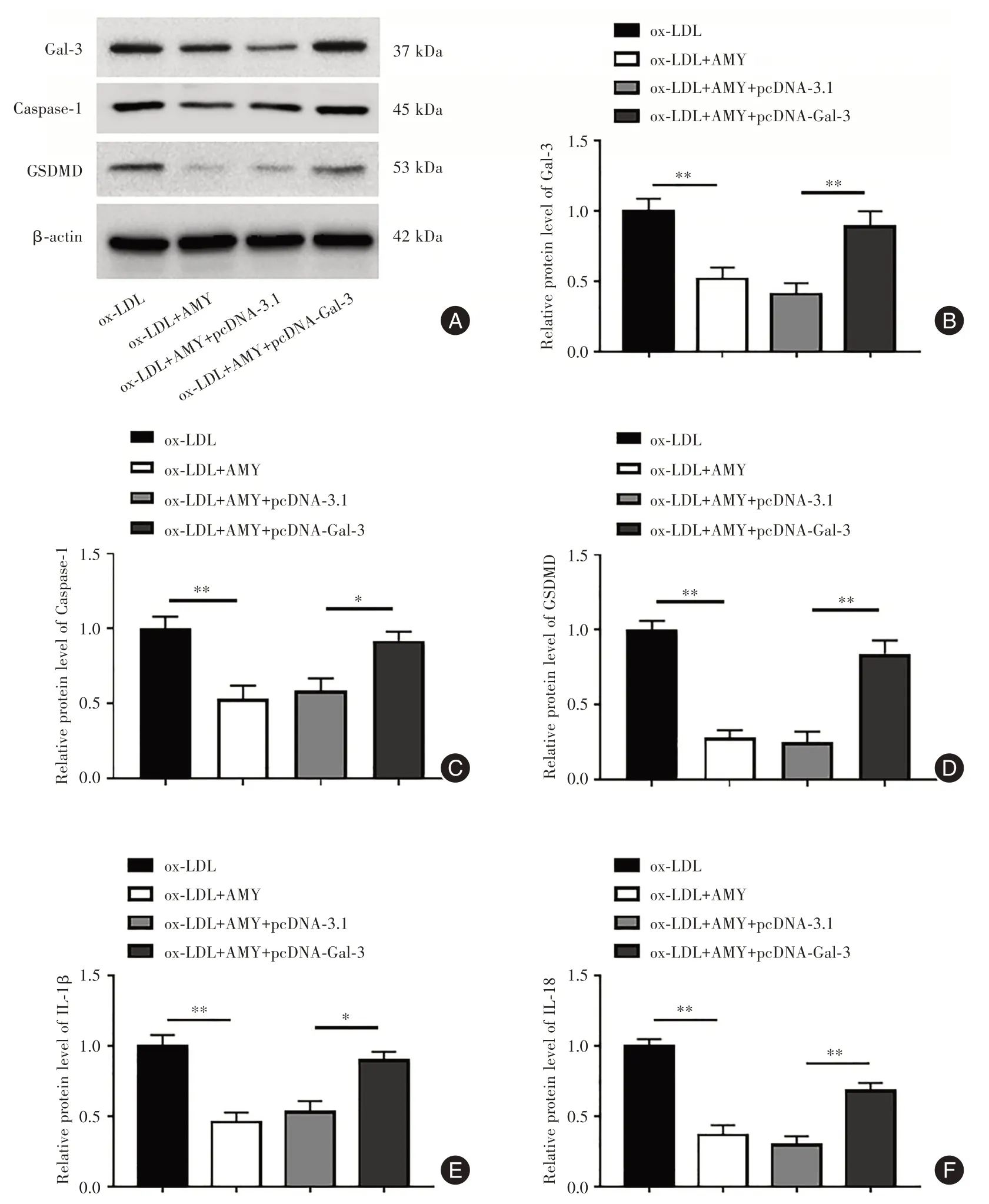
圖5 Gal-3 對AMY 抑制HCAECs 細胞焦亡的影響Fig.5 Effect of Gal-3 on AMY inhibition of pyroptosis in HCAECs

圖6 AMY 預處理HCAECs 后過表達Gal-3 的TUNEL 染色Fig.6 TUNEL staining of Gal-3 overexpression after AMY pretreatment of HCAECs
2.5 AMY 治療后動脈粥樣硬化小鼠中主動脈竇的病理分析及生化指標檢測 與Model 組相比,2.5 mg/kg AMY 和5 mg/kg AMY 組小鼠中主動脈中脂質沉積減少(圖7A),動脈粥樣硬化病變面積百分比[2.5 mg/kg AMY 組病灶面積(8.64 ± 1.01),5 mg/kg AMY 組病灶面積(3.12 ± 0.84)]較Model 組(18.65 ± 1.16)組降低(圖7B,P<0.01)。與Control組相比,Model 組小鼠血清中TG、TC 和LDL 含量顯著升高(P<0.01),HDL 濃度降低(P<0.01)。與Model 組比較2.5 mg/kg AMY 和5 mg/kg AMY 組小鼠血清中TG、TC 和LDL 濃度呈劑量依賴降低(P<0.05),HDL 含量呈劑量依賴降低升高(P<0.05)。見表1。
表1 小鼠血清生化指標檢測Tab.1 Serum biochemical parameters of mice ±s,mg/dL
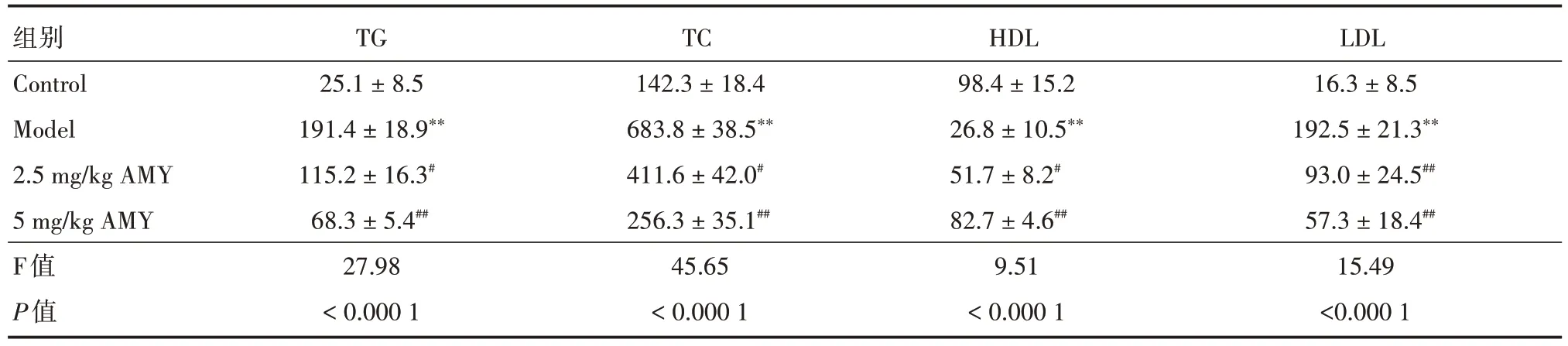
表1 小鼠血清生化指標檢測Tab.1 Serum biochemical parameters of mice ±s,mg/dL
注:與control比較,**P <0.01;與Model比較,#P <0.05,##P <0.01
組別Control Model 2.5 mg/kg AMY 5 mg/kg AMY F值P值TG 25.1±8.5 191.4±18.9**115.2±16.3#68.3±5.4##27.98<0.000 1 TC 142.3±18.4 683.8±38.5**411.6±42.0#256.3±35.1##45.65<0.000 1 HDL 98.4±15.2 26.8±10.5**51.7±8.2#82.7±4.6##9.51<0.000 1 LDL 16.3±8.5 192.5±21.3**93.0±24.5##57.3±18.4##15.49<0.000 1
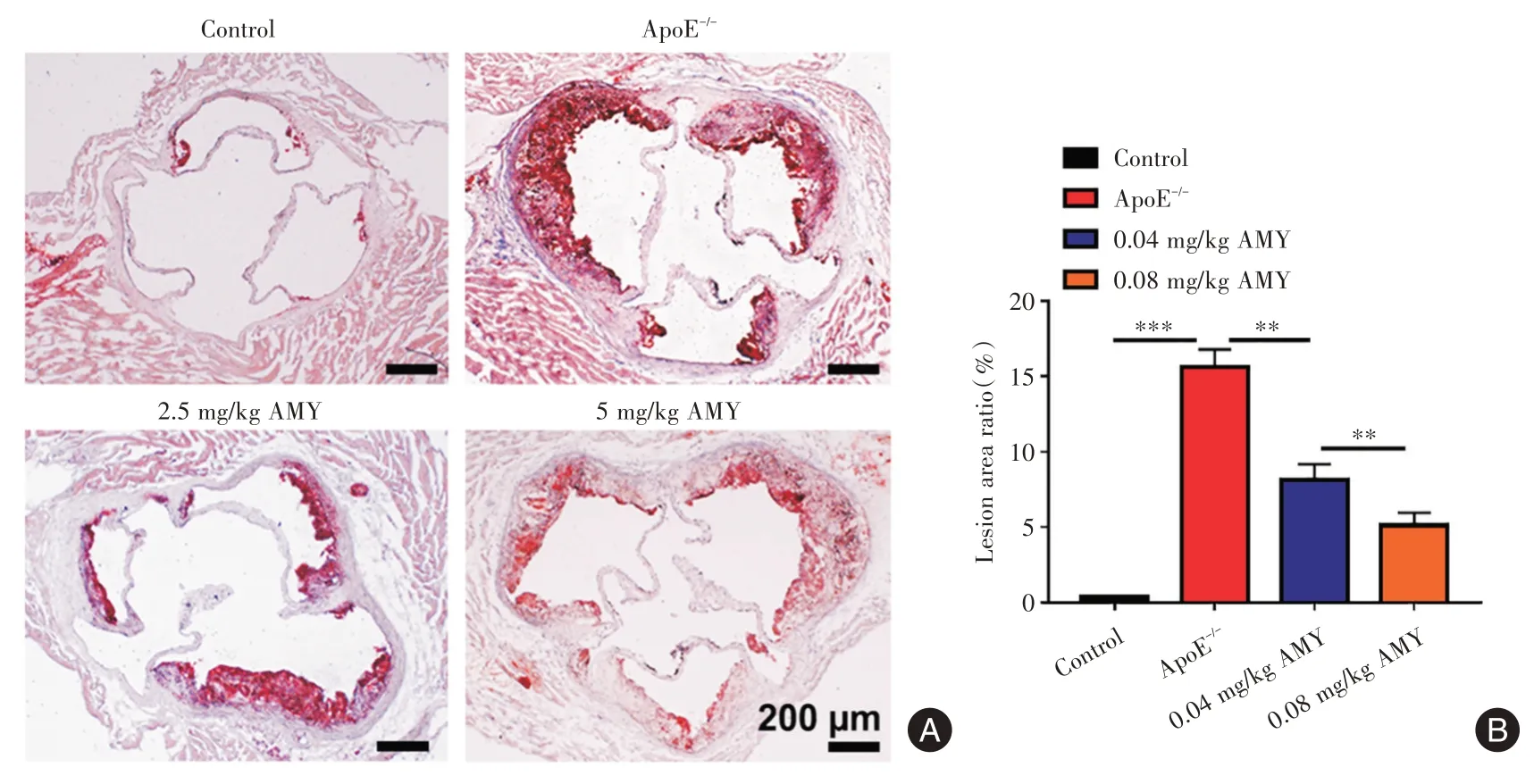
圖7 AMY 治療后小鼠主動脈油紅O 染色Fig.7 Oil red O staining of mouse aorta after AMY treatment
2.6 AMY 治療對小鼠主動脈焦亡標志物表達的影響 與Control 組相比,Model 組小鼠主動脈組織中Gal-3、JMJD3、Caspase-1和GSDMD 蛋白水平以及IL-1β 和IL-18 mRNA 表達均顯著升高(P<0.01)。與Model 組比較,2.5 mg/kg AMY 和5 mg/kg AMY 組小鼠主動脈組織中Gal-3、JMJD3、Caspase-1 和GSDMD 蛋白表達以及IL-1β 和IL-18 mRNA 表達水平呈劑量依賴降低(P<0.05)。見圖8。

圖8 AMY 治療后檢測小鼠主動脈組織中焦亡標志物表達Fig.8 Detection of pyroptosis marker expression in mice aortic tissues after AMY treatment
3 討論
在本研究中,首先發現模型組小鼠主動脈組織中細胞焦亡標志蛋白Caspase-1、IL-1β、IL-18 和GSDMD 表達水平與Control 組相比顯著升高,動脈粥樣硬化病變面積百分比增加,提示在AS 小鼠中細胞焦亡是一種主要的細胞死亡形式。在接下來的細胞模型中我們使用ox-LDL 誘導HCAECs 發生焦亡,結果顯示Caspase-1、IL-1β、IL-18 和GSDMD表達水平顯著上調,TUNEL 陽性率增加,而50、100 μg/mL AMY 干預后HCAECs 內Caspase-1、GSDMD 和Gal-3 蛋白水平以及TUNEL 陽性細胞率較ox-LDL 組呈劑量依賴性降低。隨后,在機制研究中發現AMY 干預能夠抑制JMJD3 介導的Gal-3 啟動子H3K27me3 去甲基化,而Gal-3 過表達后HCAECs內細胞焦亡標志蛋白的表達水平顯著上調,TUNEL陽性細胞率明顯增加。
AS 是一種多因素慢性炎癥性動脈疾病,是冠心病、心力衰竭、中風等多種心血管疾病的病理基礎[8]。在人AS 病變中可以觀察到細胞死亡的數量增加,特別是在晚期斑塊中。通常,細胞死亡主要歸因于細胞凋亡和壞死。然而,還發現了其他幾種細胞死亡形式,包括細胞焦亡[9]。細胞焦亡是由炎性體介導的炎性細胞死亡的獨特形式,并且依賴于Caspase-1 活化,可將細胞因子IL-1β 加工成活性形式,進而誘發細胞死亡[10]。GSDMD 是一種中樞效應和執行蛋白,通過誘導質膜孔的形成發生細胞焦亡[11]。有研究[12]發現,紅景天苷可以減輕ApoE-/-中動脈粥樣硬化誘發的細胞焦亡,其機制可能與抑制Caspase-1、IL-1β 和GSDMD 蛋白表達水平的下調有關。據報道[13],細胞焦亡參與ox-LDL 誘導的HCAECs 死亡,這進一步證實了本研究結果。
天然藥物成分具有強大的治療潛力,原因主要歸于其安全性、有效性、較少的副作用以及經濟效率[14]。AMY 是一種天然的氰苷,存在于一些可食用植物的種子中,如苦杏仁和桃子。迄今為止,AMY 已被廣泛用于治療哮喘、支氣管炎、肺氣腫、麻風病、糖尿病和癌癥等[15-16]。已有研究[17]報道AMY 可能通過調節ApoE-/-小鼠中的調節性T 細胞(Tregs)來刺激免疫系統并表現出免疫調節功能。一項研究[6]發現,AMY 可以通過MAPKs、AP-1 和NF-κB/p65 信號通路在ApoE-/-小鼠和ox-LDL 處理的骨髓源性巨噬細胞中減輕動脈粥樣硬化并發揮抗炎作用。本研究結果顯示50、100 μg/mL 的AMY 干預對HCAECs 細胞活性無明顯影響,而200、400、800 μg/mL AMY 干預HCAECs 后細胞存活率明顯降低,說明果高濃度的AMY 對細胞具有毒性副作用。WANG 等[6]研究證實濃度為50、100 μg/ mL 的AMY 在50 h 內對骨髓來源的巨噬細胞沒有帶來任何顯著的細胞毒性。此外,SHE等[7]研究發現補陽還五湯(主要包括黃芪甲苷、芍藥苷和AMY)通過抑制腦缺血再灌注損傷后神經元的焦亡發揮神經保護作用,其潛在作用機制與NLRP3 對經典細胞焦亡途徑的調節密切相關。然而,AMY 是否參與治療AS 誘發的細胞焦亡發病機制仍需本研究的進一步探討。
Gal-3 目前被認為是潛在的心血管炎癥生物標志物[18]。它是一種29 ~35 kDa 高度保守的β-半乳糖苷結合凝集素,近幾十年來在心血管疾病中受到廣泛關注。Gal-3 已被確定為促炎分子,其功能是驅動炎癥反應和氧化應激[19]。此外,Gal-3對AS 的進展有影響,包括內皮功能障礙,脂質內吞作用和血管平滑肌細胞遷移[20]。MACKINNON等[21]研究發現抑制Gal-3 可減少ApoE-/-小鼠的動脈粥樣硬化斑塊形成。本研究發現,與Control 組相比,ox-LDL 組HCAECs 內Gal-3 蛋白表達顯著增加;與ox-LDL 比較,50、100 μg/mL AMY 組HCAECs 內Gal-3 蛋白水平呈劑量依賴性降低。Jumonji 結構域3(JMJD3,KDM6B)是一種組蛋白去甲基化酶,能夠特異性地去甲基化三甲基化H3 賴氨酸27(H3K27me3),是一種常規的抑制性組蛋白修飾[22]。Jmjd3 上調可以使啟動子上抑制性H3K27me3 表觀遺傳標記去甲基化,最終導致靶基因表達增加[23]。一項研究[24]發現LPS 處理促進了JMJD3 表達,增強了Jmjd3 在人血管內皮細胞中的核積累,參與AS 發展。此外,JMJD3 能夠使β-MHC 啟動子處的H3K27me3 去甲基化,以促進其表達和心臟損傷,表明JMJD3 可能是心肌細胞中β-MHC 表達的關鍵表觀遺傳調節因子,也是心臟損傷的潛在治療靶點27[25],這與本研究結果類似。
綜上所述,AMY 可有效改善ox-LDL 誘導的HCAECs 細胞焦亡以及HFD 飼養的ApoE-/-小鼠主動脈脂質沉積和斑塊形成,其機制可能與調控JMJD3 介導的Gal-3 啟動子H3K27me3 去甲基化有關。然而本研究仍存在一些局限性,首先,本研究動物實驗僅設有2.5 和5 mg/kg 兩個濃度梯度,尚未探索體內實驗中AMY 對AS 小鼠治療的最佳藥物濃度。其次,研究機制不夠全面,仍需進一步分析其他可能機制對實驗結果的影響。此外,關于AMY 治療ApoE-/-小鼠的AS 指標研究過少,對AS治療的指導價值有限,下一步將著重開展體內動物實驗及臨床試驗進一步驗證AMY 對AS 的防治作用,旨在為AMY 參與AS 進展提供新的證據,并為AS 的治療提供理論基礎。
【Author contributions】LIU Jin designed this study and wrote the manuscript.ZHANG Jie performed the experimental work and provided the majority of statistical analysis as well as provided the figures and tables for the manuscript.FENG Ying collected a large amount of data for the dataset.All authors read and approved the final manuscript.

