昆布多糖通過調節巨噬細胞極化延緩肺纖維化研究
張 波,苑艷麗,李玉彤,薛 濤,劉言娟,邵鳳麗*,辛 杰,李新朋*
昆布多糖通過調節巨噬細胞極化延緩肺纖維化研究
張 波1,苑艷麗2,李玉彤1,薛 濤1,劉言娟1,邵鳳麗1*,辛 杰1,李新朋1*
1. 臨沂大學,山東 臨沂 276000 2. 上海中醫藥大學,上海 201203
探索昆布多糖基于調節巨噬細胞極化抑制肺纖維化的作用機制。將昆布中提取的硫酸多糖經自由基降解,得到低相對分子質量昆布多糖(low molecular weight fucoidan,LMWF),并通過高效液相色譜測定了其單糖結構組成。通過免疫組化檢測肺纖維化小鼠與LMWF治療組小鼠M2巨噬細胞極化生物標志物的表達,并通過Western blotting和qRT-PCR檢測M1/M2標志物的表達。分別用脂多糖(lipopolysaccharide,LPS)聯合γ干擾素(interferon-γ,IFN-γ)和白細胞介素-4(interleukin-4,IL-4)誘導MH-S細胞,構建體外M1和M2巨噬細胞極化模型,探索LMWF調節巨噬細胞極化延緩肺纖維化的作用機制。LMWF可顯著降低肺纖維化小鼠肺組織中M1/M2巨噬細胞標志物的表達(<0.05、0.01、0.001)。同樣,LMWF可有效抑制細胞模型中M1和M2型標志物的表達(<0.05、0.01、0.001)。LMWF可以通過早期抗炎作用調節M1巨噬細胞極化,并在后期通過抑制M2巨噬細胞極化有助于減少纖維化。
昆布;低相對分子質量多糖;肺纖維化;MH-S細胞;巨噬細胞極化
肺纖維化是一種以病因不明的慢性進行性纖維化間質性肺炎為特征的疾病[1-2]。當發生肺損傷時,肺間質細胞會分泌膠原蛋白進行修復,但如果修復過度,即成纖維細胞過度增殖,細胞外基質大量積聚,就會形成肺纖維化。肺纖維化的發病機制包括成纖維細胞活化、細胞自噬能力下降、轉化生長因子-β1(transforming growth factor-β1,TGF-β1)信號通路的激活與免疫失衡。近年來,對肺纖維化發病機制的研究已不再局限于肺泡損傷相關的發病機制。肺纖維化很可能由內源性和外源性細胞應激引起,導致成纖維細胞活化、肺泡結構破壞、細胞外基質沉積、氣體交換障礙和呼吸衰竭[3]。而巨噬細胞參與了肺纖維化的整個發病過程,不同表型的巨噬細胞對肺纖維化有不同的影響[4]。另一方面,巨噬細胞的極化受到微生物信號、組織特異性誘導、細胞因子和其他因素的調節[5]。當巨噬細胞極化為不同的亞型時,它們受到不同信號通路的調節[6]。在肺纖維化的不同階段,巨噬細胞分化為不同的亞型。巨噬細胞的表型極化很可能是肺纖維化發生和發展的機制之一[7]。
研究表明,巨噬細胞的極化影響肺纖維化的發展進程[8]。在肺纖維化的早期,即肺泡炎癥階段,肺巨噬細胞極化為M1型[9],在肺纖維化晚期,即纖維化修復階段,巨噬細胞極化為M2亞型[10-11]。炎癥性巨噬細胞通常表現為M1激活型,分泌一氧化氮(nitric oxide,NO)、活性氧(reactive oxygen species,ROS)、白細胞介素(interleukin,IL)和腫瘤壞死因子(tumor necrosis factor,TNF)等[12]。此時,M1巨噬細胞也會分泌基質金屬蛋白酶2(matrix metallopeptidase 2,MMP2)和MMP9,促進細胞外基質的降解,有利于炎癥細胞浸潤受損組織。當炎癥持續時,M1巨噬細胞改變了它們對炎癥的反應方式,募集Th17細胞和中性粒細胞,導致持續的組織損傷[13-14]。而M2巨噬細胞的激活也與肺纖維化的發展密切相關。研究指出M2巨噬細胞在小鼠纖維化模型和人類肺纖維化中發揮著重要作用[15],它們可以產生纖維化介質。除了纖維化作用外,肺纖維化患者巨噬細胞表型的變化也可以解釋為什么患者經常肺部感染,導致肺衰竭并最終死亡。因此,抑制M2巨噬細胞表型是肺纖維化的潛在治療策略[16]。
昆布為海帶科植物海帶Aresch.或翅藻科植物昆布Okam.的干燥葉狀體,具有消痰軟堅散結、利水消腫等功效。昆布多糖是昆布主要活性成分之一,藥理活性豐富,而低相對分子質量昆布多糖(low molecular weight fucoidan,LMWF)是一種主要由巖藻糖組成的硫酸多糖,在肺纖維化小鼠模型中已經顯示出抑制作用[17-18]。LMWF可以阻斷ROS以抑制肺纖維化[19],但先前的研究尚未探討LMWF作用于肺泡巨噬細胞的機制。因此,本研究旨在闡明LMWF是否能作用于肺泡巨噬細胞的極化以延緩肺纖維化。
1 材料
1.1 動物與細胞
SPF級雄性C57BL/6小鼠,體質量(22±2)g,購自中楚恒通生物科技有限公司(濟南),許可證號SCXX(鄂)2017-0012,動物實驗已獲得臨沂大學醫學院動物倫理委員會的批準(批準號LYU20200106)。
小鼠肺泡巨噬細胞系(MH-S細胞)購自濟南中楚生物科技有限公司。
1.2 藥材
昆布采摘于青島地區,經臨沂大學辛杰副教授鑒定為翅藻科植物昆布Okam.的干燥葉。
1.3 藥品與試劑
乙醇(分析純,批號YD20210421)購自天津市永大化學試劑有限公司;Tris-HCl緩沖液(批號20180807)、CCK-8試劑盒(批號20210413)、胰蛋白酶(批號20210623)、RIPA裂解液(批號20210521)、γ干擾素(interferon-γ,IFN-γ,批號20220410)、2 mmol/L-谷氨酰胺(批號20210514)、雙抗(批號20220319)、RPMI 1640培養基(批號20220401)購自北京索萊寶生物科技有限公司;精氨酸酶-1(Arginase-1)抗體(批號64q4824,稀釋比例1∶1000)、TNF-α抗體(批號73g3336,稀釋比例1∶1000)、β-actin抗體(批號12w2944,稀釋比例1∶3000)、TGF-β1抗體(批號20r6523,稀釋比例1∶1000)、抵抗素樣分子α(found in inflammatory zone 1,Fizz-1)抗體(批號85d1712,稀釋比例1∶1000)購自Affinity Biosciences公司;CD163抗體(批號20211110)、誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗體(批號20211110)、CD86抗體(批號20220210)購自武漢基因美生物科技有限公司,稀釋比例1∶500;YM-1抗體(批號ab93034)購自英國Abcam公司,稀釋比例1∶1000;山羊抗兔IgG二抗(批號56j9958)、山羊抗鼠IgG二抗(批號19z2345)購自Affinity Biosciences公司,稀釋比例1∶5000;引物購自生工生物工程有限公司;SYBR Green One Step qPCR試劑盒(批號U28220)購自翊圣生物科技有限公司;Prime-Script RT試劑盒(批號016100)購自東洋紡(上海)生物科技有限公司;脂多糖(lipopolysaccharide,LPS,批號S11060)購自上海源葉生物科技有限公司);IL-4(批號200-04)購自派普泰克生物科技(蘇州)有限公司;-巖藻糖標準品(批號E1822041)購自上海阿拉丁生物科技股份有限公司;博萊霉素(批號193507)、10%胎牛血清(批號2164724)購自美國Thermo Fisher Scientific公司;潑尼松(批號LA21243)購自浙江仙琚制藥有限公司。
1.4 儀器
041BR325717型凝膠電泳儀(美國Bio-Rad公司);1260型高效液相色譜儀(瑞士Agilent公司);Light Cycler 96型實時熒光定量PCR儀(瑞士Roche公司);5200型全自動化學發光成像儀(上海天能儀器有限公司)。
2 方法
2.1 昆布多糖化學組成
采取水提醇沉法提取昆布多糖。昆布加入10倍量純水,100 ℃提取2 h,提取液經硅藻土濾過,濾液減壓濃縮,濃縮液與乙醇按體積比1∶4沉淀[20],沉淀烘干得粗多糖。通過自由基降解(H2O2-Vc 1∶1,30 mmol/L),70 ℃降解2 h,氫氧化鈉終止反應,反應液濃縮后乙醇沉淀得到LMWF。借助CL-6B柱洗脫,用氯化鈉作為洗脫劑,得到1.0 mol/L NaCl洗脫組分(已有研究發現該組分對肺纖維化具有更好的抑制活性[18])。基于3-甲基-1-苯基-2-吡唑啉-5-酮柱前衍生化后的高效液相色譜(high performance liquid chromatography,HPLC)分析LMWF的主要單糖成分[21]。用苯酚-硫酸法測定總糖含量。用氯化鋇-明膠法分析硫酸鹽含量[22]。半胱氨酸鹽酸鹽-硫酸法用于測定LMWF的巖藻糖含量,以-巖藻糖作為標準品[23]。
2.2 動物分組、造模與給藥
動物實驗樣品來自前期實驗研究[19]:小鼠隨機分為假手術、模型組及LMWF低、中、高低劑量(25、50、100 mg/kg)組和潑尼松(3 mg/kg)組,每組12只。前期采用預實驗確定造模方法:小鼠ip 1%戊巴比妥鈉麻醉后,行氣管切開術,造模組小鼠氣管內慢滴注博萊霉素(博來霉素配制成溶液,無菌濾過,3.5 mg/kg,滴加1 mL),假手術組小鼠氣管內滴注等體積的生理鹽水作為對照。術后縫合傷口,消毒后將麻醉蘇醒后的小鼠送回動物房,自由飲水進食,注意保溫;于博萊霉素誘導后3、7、14、21、28 d處死各組存活小鼠,取肺組織進行蘇木素-伊紅(HE)染色觀察其病理改變,初步判斷炎癥及纖維化改變,并采用Masson染色及天狼星紅染色觀察膠原沉積,確定小鼠肺纖維化進展階段和造模時間(Masson和天狼星紅染色出現膠原沉積,纖維化樣改變,認為造模成功)。LMWF用無菌蒸餾水溶解,采用ip給藥,實驗周期28 d(由預實驗確定)。
2.3 M2型巨噬細胞標志物表達
取小鼠肺組織石蠟切片進行免疫組化檢測,觀察Arginase-1、Fizz-1、YM-1的表達和定位。將小鼠肺組織在液氮中研磨以提取蛋白,并用BCA試劑盒定量[24-25]。采用Western blotting檢測M2生物標志物(Fizz-1、Arginase-1、YM-1、TGF-β1)的表達,使用Image J軟件分析差異。
2.4 qRT-PCR檢測M1與M2型巨噬細胞標志物表達
按照試劑盒說明書提取小鼠肺組織中總RNA并合成cDNA,進行qRT-PCR分析。檢測小鼠肺組織中、、、、、、、、Toll樣受體4(Toll-like receptor 4,)和一氧化氮合酶2(nitric oxide synthase 2,)的基因表達[26]。引物序列見表1。
2.5 CCK-8檢測細胞活力
MH-S細胞用含10%胎牛血清、2 mmol/L-谷氨酰胺、100 U/mL青霉素和100 μg/mL鏈霉素的RPMI 1640培養基,于37 ℃、5% CO2的培養箱中培養。細胞以2×103/孔接種到96孔板中,與不同質量濃度(0、50、100、200、400、800、1000 μg/mL)的LMWF共培養24 h。加入CCK-8并培養1 h,采用分光光度計測定450 nm處的吸光度()值。
2.6 昆布多糖作用濃度篩選
以2×103/孔接種MH-S細胞,IL-4(20 ng/mL)誘導48 h構建M2極化模型[27-28],同時用不同質量濃度(100、200、400、800、1000 μg/mL)的LMWF處理,另設置不含藥物的對照組。
用IFN-γ(20 ng/mL)聯合LPS(10 ng/mL)誘導MH-S細胞24 h,構建M1型極化模型[29],同時用不同質量濃度(25、50、100、200、400、800 μg/mL)的LMWF處理細胞,另設置不含藥物的對照組。用CCK-8試劑盒檢測細胞活力以篩選有效濃度。
表1 巨噬細胞標志物引物序列
Table 1 Macrophage marker primer sequences
基因引物序列 (5’-3’) Arginase-1F: CTCCAAGCCAAAGTCCTTAGAG R: GGAGCTGTCATTAGGGACATCA Fizz-1F: CCAATCCAGCTAACTATCCCTCC R: CCAGTCAACGAGTAAGCACAG IL-10F: GCTCTTACTGACTGGCATGAG R: CGCAGCTCTAGGAGCATGTG YM-1F: GCAAGACTTGCGTGACTATGAA R: AACGGGGCAGGTCCAAA TGF-β1F: ACGTCACTGGAGTTGTACGG R: GGGGCTGATCCCGTTGATT CD86F: GAGCTGGTAGTATTTTGGCAGG R: GGCCCAGGTACTTGGCATT TNF-αF: CCTGTAGCCCACGTCGTAG R: GGGAGTAGACAAGGTACAACCC IL-6F: TAGTCCTTCCTACCCCAATTTCC R: TTGGTCCTTAGCCACTCCTTC NOS2F: GGAGTGACGGCAAACATGACT R: TCGATGCACAACTGGGTGAAC TLR4F: TTTGACACCCTCCATAGACTTCA R: GAAACTGCAATCAAGAGTGCTG β-actinF: CCTCTATGCCAACACAGT R: AGCCACCAATCCACACAG
2.7 昆布多糖調節巨噬細胞極化
MH-S細胞以1×105/mL接種于6孔板,IL-4(20 ng/mL)誘導48 h,并用不同質量濃度(200、400、800 μg/mL)的LMWF處理細胞。用IFN-γ(20 ng/mL)聯合LPS(100 ng/mL)誘導,并用不同質量濃度(200、400、800 μg/mL)的LMWF處理細胞。于顯微鏡下觀察細胞形態并拍照。按照試劑盒說明書提取細胞總RNA并合成cDNA,進行qRT-PCR分析,檢測、、、、、、、、、膠原()、纖維連接蛋白(fibronectin,)和α-平滑肌肌動蛋白(α-smooth muscle actin,)的基因表達,引物序列見表1、2。提取細胞總蛋白并進行定量,采用Western blotting檢測Fizz-1、Arginase-1、YM-1、TGF-β1、CD163、iNOS、TNF-α和CD86蛋白表達。
2.8 統計學分析
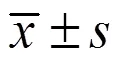
表2 纖維化標志物引物序列
Table 2 Fibrosis marker primer sequences
基因引物序列 (5’-3’) collagenF: ATGGATTCCCGTTCGAGTACG R: TCAGCTGGATAGCGACATCC FNF: AAGACCATACCTGCCGAATG R: GAACATGACCGATTTGGACC α-SMAF: GTGACTCACAACGTGCCTATC R: CTCGGCAGTAGTCACGAAGC β-actinF: CCTCTATGCCAACACAGT R: AGCCACCAATCCACACAG
3 結果
3.1 昆布多糖化學組成
CL-6B色譜柱對降解后的昆布多糖進行分離。梯度洗脫(0~2 mol/L NaCl)得到2個洗脫組分(F0.5和F1.0),收集F1.0組分(圖1-A)。盡管F1.0的化學結構已經明確[30],但由于其基本化學組成與昆布的來源略有不同,本研究仍然重新測試了F1.0的基本化學組成。單糖成分分析發現,巖藻糖是主要成分,其次是半乳糖和葡萄糖醛酸(圖1-B)。相對分子質量測試顯示為9801(圖1-C)。化學成分測試結果顯示,總糖、巖藻糖、糖醛酸、硫酸根質量分數分別為52.53%、38.75%、2.98%、34.33%,半乳糖、甘露糖、葡萄糖、鼠李糖、木糖、巖藻糖、葡萄糖醛酸物質的量比為0.03∶0.01∶0∶0.01∶0.01∶1∶0.02。
3.2 小鼠肺組織M2型巨噬細胞標志物蛋白表達
免疫組化染色結果(圖2-A)顯示,Arginase-1、Fizz-1和YM-1在肺纖維化小鼠肺組織中的表達顯著增加(<0.001),而M2巨噬細胞極化標記物在LMWF處理的小鼠肺組織中表達水平顯著降低(<0.01、0.001)。通過Western blotting檢測M2巨噬細胞極化生物標志物(圖2-B),結果顯示LMWF在抑制生物標志物表達方面具有良好的穩定性,顯著降低了Fizz-1、Arginase-1、YM-1和TGF-β1表達(<0.05、0.01、0.001)。此外,陽性對照藥物潑尼松對M2巨噬細胞極化生物標志物的表達有良好的抑制作用,但對YM-1表達沒有明顯的抑制作用。
3.3 小鼠肺組織M1和M2型巨噬細胞生物標志物基因表達
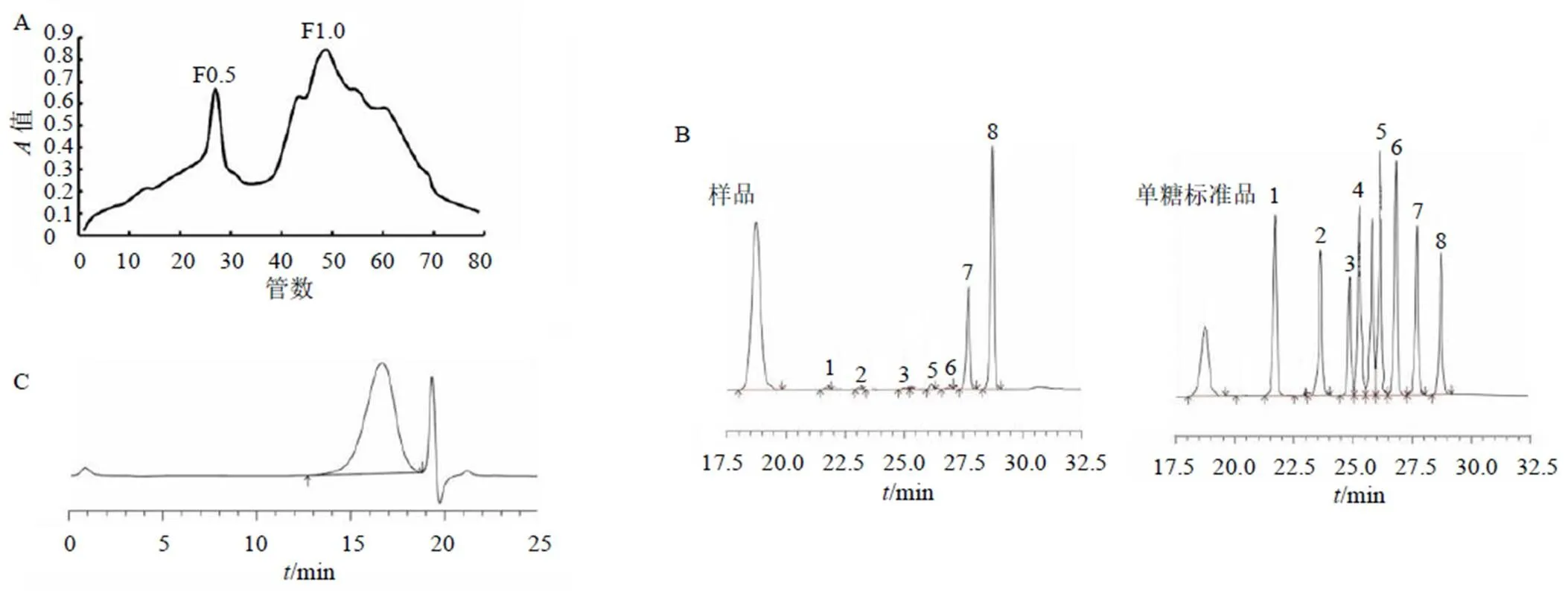
為了研究LMWF是否可以調節巨噬細胞極化,檢測了小鼠肺組織中M1和M2極化生物標志物的mRNA水平。如圖3所示,與假手術組比較,模型組小鼠肺組織中M2型標志物、、和基因表達水平均顯著升高(<0.001),而LMWF能夠減少M2型巨噬細胞標志物表達(<0.01、0.001)。同時,LMWF也降低了表達(<0.001)。此外,LMWF可降低M1型生物標志物、、、、表達(<0.01、0.001)。
A-梯度洗脫曲線 B-單糖組成圖譜(1-甘露糖,2-鼠李糖,3-葡糖糖醛酸,4-葡萄糖,5-半乳糖,6-木糖,7-巖藻糖,8-核糖) C-采用高效液相色譜檢測多糖相對分子質量組成的圖譜

A-免疫組化檢測Arginase-1、Fizz-1和YM-1的表達(×400) B-Western blotting檢測M2巨噬細胞極化生物標志物的表達 與假手術組比較:##P<0.01 ###P<0.001;與模型組比較:*P<0.05 **P<0.01 ***P<0.001,圖3同
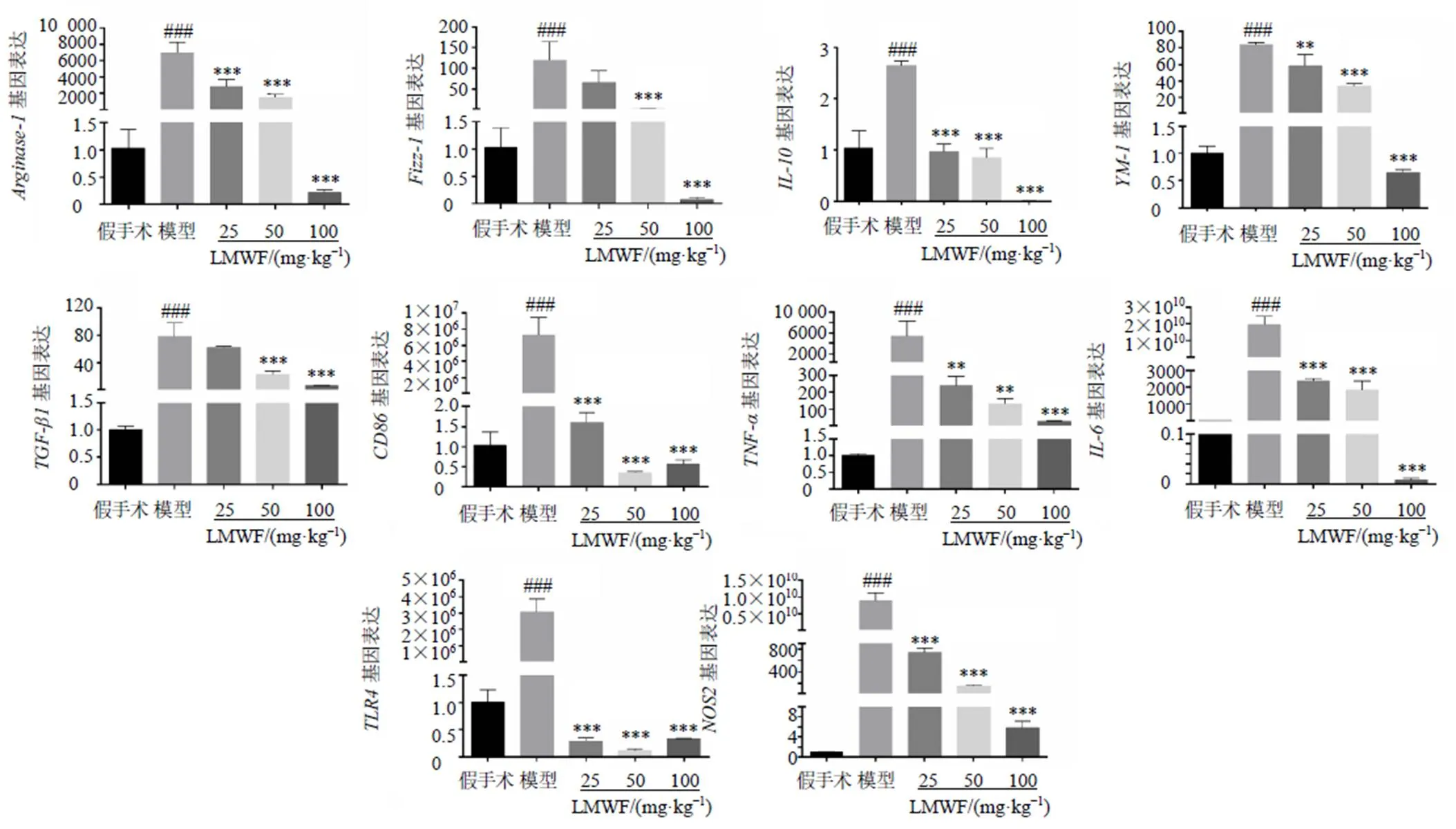
圖3 LMWF對肺纖維化小鼠肺組織中M1和M2巨噬細胞生物標志物基因表達的影響(, n = 3)
3.4 昆布多糖調節M2型巨噬細胞極化
為了探索LMWF對巨噬細胞極化的調節作用,評估了LMWF在IL-4誘導MH-S細胞中的作用。采用CCK-8法檢測細胞毒性。結果表明,LMWF(0~1 mg/mL)對MH-S細胞無毒性(圖4-A)。IL-4誘導后,細胞形態發生變化,LMWF可以有效調節細胞形態,減少IL-4對細胞的損傷(圖4-C)。濃度篩選后,選擇200、400、800 μg/mL作為實驗濃度(圖4-B)。檢測M2巨噬細胞極化生物標志物的蛋白和mRNA表達(圖4-D、圖5),結果表明LMWF可以有效降低M2型生物標志物表達(<0.05、0.01、0.001)。同時,還檢測了纖維化標志物的mRNA表達(圖5)。結果表明,IL-4誘導后,纖維化標志物表達增加(<0.05、0.01),LMWF可以降低纖維化標志物的表達(<0.05、0.01)。
3.5 昆布多糖調節M1巨噬細胞極化
借助LPS+IFN-γ誘導MH-S細胞構建M1巨噬細胞極化模型(圖6-A)。誘導后細胞的形態學變化并不明顯,通過CCK-8試劑盒篩選有效濃度。結果表明,LMWF對抑制炎癥顯示出效果,并選擇了200、400、800 μg/mL作為作用濃度(圖6-B)。通過Western blotting和qRT-PCR檢測M1巨噬細胞生物標志物的表達(圖6-C、D)。結果顯示LPS降低了CD163的表達(<0.001),增強了iNOS、TNF-α、CD86表達(<0.001)。然而,LMWF可以有效調節其表達(<0.01、0.001)。qRT-PCR檢測也顯示出類似的結果。
4 討論
通過前期研究發現LMWF可以有效地抑制肺纖維化進展,盡管已經證實LMWF可以阻斷TGF-β/Smad信號通路和核因子E2相關因子2(nuclear factor E2 related factor 2,Nrf2)抑制肺纖維化[18-19],然而對于LMWF抑制肺纖維化的具體作用機制仍需進一步探索。
在肺纖維化早期,多種損傷、刺激可招募循環來源的單核細胞,進入病變組織后分化為巨噬細胞[31]。巨噬細胞分化可形成炎癥狀態截然不同的2個極端,這一過程稱為巨噬細胞極化。經典激活的M1型巨噬細胞和替代激活的M2型巨噬細胞是極化的2個亞群,二者具有截然不同的基因表達譜和蛋白標志物。組織損傷發生的早期,即急性炎癥期,壞死凋亡細胞招募促炎性單核細胞聚集,分化為經典激活的M1型巨噬細胞,清除壞死組織并表達大量促炎細胞因子如TNF-α、IL-1、IL-6、IFN-γ等。隨后促炎信號受到抑制,更傾向于分化為替代激活的M2型巨噬細胞,表達高水平抗炎細胞因子和生長因子如IL-4、IL-10、TGF-β1等,促進上皮和內皮細胞分化增殖,恢復組織形態結構,并促使成纖維細胞發生表型轉化,變為肌成纖維細胞,合成分泌細胞外基質,促進組織修復[11];但如果M2巨噬細胞持續激活,則促進肌成纖維細胞進一步分泌細胞外基質,形成纖維化[32]。
A-LMWF對MH-S細胞活力的影響 (n = 6) B-LMWF對IL-4誘導的MH-S細胞活力的影響 (n = 6) C-LMWF對IL-4誘導的MH-S細胞形態的影響(×200) D-LMWF對IL-4誘導的MH-S細胞M2巨噬細胞極化生物標志物表達的影響 (n = 3) 與對照組比較:#P<0.05 ##P<0.01 ###P<0.001;與模型組比較:*P<0.05 **P<0.01 ***P<0.001,下圖同
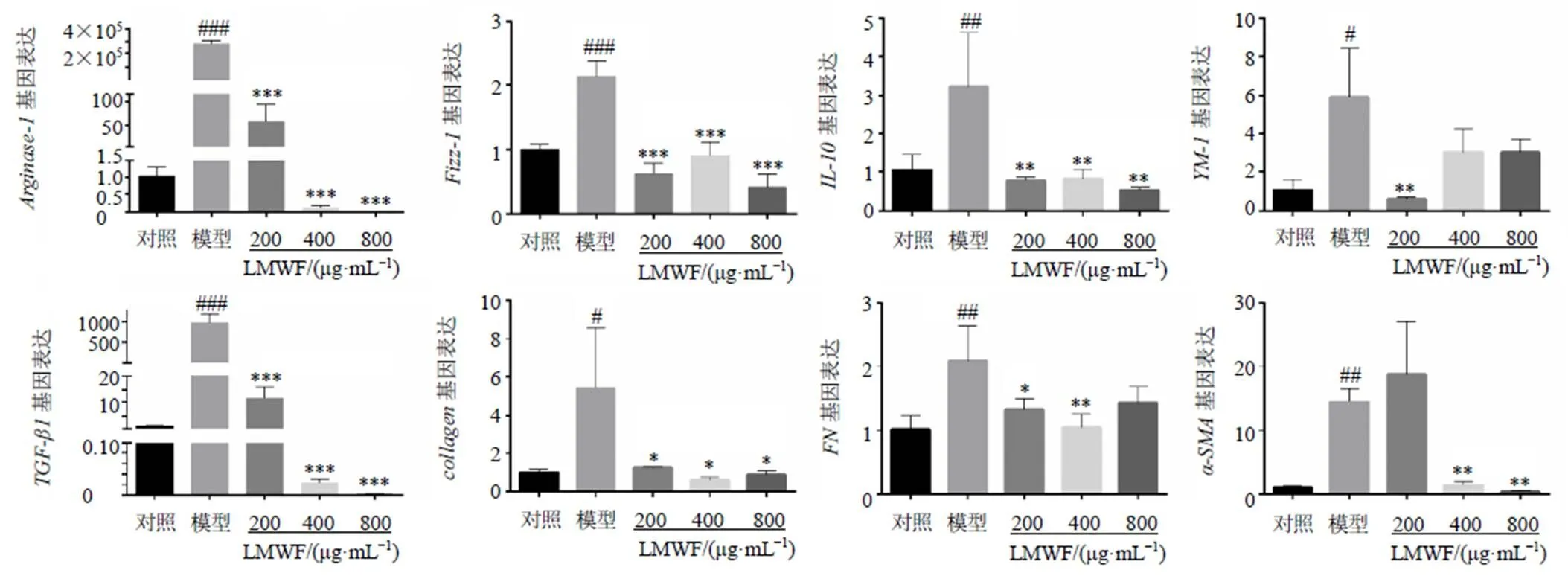
圖5 LMWF對IL-4誘導的MH-S細胞M2型巨噬細胞標志物和纖維化標志物基因表達的影響 (, n = 3)

A-LMWF對LPS/IFN-γ誘導的MH-S細胞活力的影響 (= 6) B-LMWF對LPS/IFN-γ誘導的MH-S細胞形態的影響(×200) C--LMWF對LPS/IFN-γ誘導的MH-S細胞M1巨噬細胞極化生物標志物蛋白表達的影響 (= 3) D-LMWF對LPS/IFN-γ誘導的MH-S細胞M1巨噬細胞生物標志物基因表達的影響 (= 3)
A-effect of LMWF on viability of LPS/IFN-γ-induced MH-S cells (= 6) B-effect of LMWF on morphology of LPS/IFN-γ-induced MH-S cells (× 200) C-effect of LMWF on M1 macrophage polarization biomarkers protein expressions in LPS/IFN-γ-induced MH-S cells (= 3) D-effect of LMWF on polarization biomarkers of M1 macrophage biomarkers gene expressions in LPS/IFN-γ-induced MH-S cells (= 3)
圖6 LMWF對LPS/IFN-γ誘導的MH-S細胞M1型巨噬細胞標志物表達的影響
Fig. 6 Effect of LMWF on M1 macrophage polarization biomarkers expressions inLPS/IFN-γ-induced MH-S cells
為闡明LMWF通過巨噬細胞極化抑制肺纖維化的機制,本研究通過Western blotting、qRT-PCR和免疫組化法檢測M2巨噬細胞生物標志物(Arginase-1、Fizz-1、YM-1和TGF-β1)在肺組織中的表達水平。結果發現LMWF可以有效調節其表達水平,表明LMWF可以通過調節M2巨噬細胞的極化來抑制肺纖維化的發展。在肺纖維化晚期,M2巨噬細胞占主導地位,而最關鍵的調節因子是TGF-β1。LMWF可以有效地阻斷其分泌,對抑制肺纖維化過程至關重要。此外,炎癥是肺纖維化的早期臨床表現,這也是本研究檢測炎癥因子表達的原因。研究發現,炎癥因子和M1巨噬細胞生物標志物在qRT-PCR結果中也出現高表達,而LMWF可以有效降低其表達,表明LMWF是可以通過早期抗炎作用和晚期調節M2巨噬細胞極化來抑制肺纖維化。
隨后通過體外實驗驗證其作用機制。首先,用IL-4誘導MH-S細胞,構建M2巨噬細胞極化模型。發現IL-4處理后細胞的形態學發生明顯變化。Western blotting和qRT-PCR結果顯示,M2巨噬細胞生物標志物的表達增加,而LMWF可以有效降低其表達,尤其是降低TGF-β1表達。這也表明LMWF可以調節M2巨噬細胞的極化,體內實驗的結果得到了驗證。此外,研究發現IL-4誘導后、和mRNA的表達增加,LMWF干預后纖維化標志物表達明顯降低。
本研究通過LPS和IFN-γ聯合誘導MH-S細胞,構建M1巨噬細胞極化模型。發現LMWF可以減少炎癥因子(iNOS和TNF-α)的分泌,并減少炎癥的表達。表明LMWF可以通過其抗炎作用有效阻斷M1巨噬細胞的極化并抑制炎癥的發展,與本課題組前期研究結果一致[19]。結合體外實驗研究證實LMWF可以調節M1/M2巨噬細胞的極化,抑制炎癥的發展,阻斷纖維化過程,并在晚期阻斷M2巨噬細胞的極化和抑制TGF-β1表達。本研究結果表明LMWF可以通過調節M1/M2巨噬細胞的極化來抑制肺纖維化。
利益沖突 所有作者均聲明不存在利益沖突
[1] Hutchinson J, Fogarty A, Hubbard R,. Global incidence and mortality of idiopathic pulmonary fibrosis: A systematic review [J]., 2015, 46(3): 795-806.
[2] Richeldi L, Collard H R, Jones M G. Idiopathic pulmonary fibrosis [J]., 2017, 389(10082): 1941-1952.
[3] Meyer K C. Pulmonary fibrosis, part I: Epidemiology, pathogenesis, and diagnosis [J]., 2017, 11(5): 343-359.
[4] Laskin D L, Malaviya R, Laskin J D. Role of macrophages in acute lung injury and chronic fibrosis induced by pulmonary toxicants [J]., 2019, 168(2): 287-301.
[5] Yunna C, Mengru H, Lei W,. Macrophage M1/M2 polarization [J]., 2020, 877: 173090.
[6] Zhou D X, Huang C, Lin Z,. Macrophage polarization and function with emphasis on the evolving roles of coordinated regulation of cellular signaling pathways [J]., 2014, 26(2): 192-197.
[7] Kolahian S, Fernandez I E, Eickelberg O,. Immune mechanisms in pulmonary fibrosis [J]., 2016, 55(3): 309-322.
[8] Byrne A J, Maher T M, Lloyd C M. Pulmonary macrophages: A new therapeutic pathway in fibrosing lung disease? [J]., 2016, 22(4): 303-316.
[9] 蔡澤慧, 趙鵬, 張藍熙, 等. 巨噬細胞活化參與肺纖維化機制研究進展 [J]. 中國老年學雜志, 2022, 42(15): 3853-3857.
[10] Guo Z J, Li S R, Zhang N,.inhibit bleomycin-induced idiopathic pulmonary fibrosis in rats via suppressing M2 macrophage polarization [J]., 2020, 2020: 5137349.
[11] Wang Y, Zhang L, Wu G R,. MBD2 serves as a viable target against pulmonary fibrosis by inhibiting macrophage M2 program [J]., 2021, 7(1): eabb6075.
[12] Shapouri-Moghaddam A, Mohammadian S, Vazini H,. Macrophage plasticity, polarization, and function in health and disease [J]., 2018, 233(9): 6425-6440.
[13] Dong M, Zhou C P, Ji L,. AG1296 enhances plaque stability via inhibiting inflammatory responses and decreasing MMP-2 and MMP-9 expression in ApoE?/?mice [J]., 2017, 489(4): 426-431.
[14] Yao Y Y, Wang Y, Zhang Z J,. Chop deficiency protects mice against bleomycin-induced pulmonary fibrosis by attenuating M2 macrophage production [J]., 2016, 24(5): 915-925.
[15] Su S C, Zhao Q Y, He C H,. MiR-142-5p and miR-130a-3p are regulated by IL-4 and IL-13 and control profibrogenic macrophage program [J]., 2015, 6: 8523.
[16] Pan T, Zhou Q, Miao K,. Suppressing Sart1 to modulate macrophage polarization by siRNA-loaded liposomes: A promising therapeutic strategy for pulmonary fibrosis [J]., 2021, 11(3): 1192-1206.
[17] Wang L, Zhang P, Li X P,. Low-molecular-weight fucoidan attenuates bleomycin-induced pulmonary fibrosis: Possible role in inhibiting TGF-β1-induced epithelial-mesenchymal transition through ERK pathway [J]., 2019, 11(4): 2590-2602.
[18] Wu N, Li Z, Wang J,. Low molecular weight fucoidan attenuating pulmonary fibrosis by relieving inflammatory reaction and progression of epithelial-mesenchymal transition [J]., 2021, 273: 118567.
[19] Dong H D, Xue T, Liu Y J,. Low molecular weight fucoidan inhibits pulmonary fibrosisandvia antioxidant activity [J]., 2022, 2022: 7038834.
[20] Xu J G, Wang Y, Wang Z,. Fucoidan mitigated diabetic nephropathy through the downregulation of PKC and modulation of NF-κB signaling pathway:andinvestigations [J]., 2021, 35(4): 2133-2144.
[21] Honda S, Akao E, Suzuki S,. High-performance liquid chromatography of reducing carbohydrates as strongly ultraviolet-absorbing and electrochemically sensitive 1-phenyl-3-methyl5-pyrazolone derivatives [J]., 1989, 180(2): 351-357.
[22] Kawai Y, Seno N, Anno K. A modified method for chondrosulfatase assay [J]., 1969, 32(2): 314-321.
[23] Dische Z, Shettles L B. A specific color reaction of methylpentoses and a spectrophotometric micromethod for their determination [J]., 1948, 175(2): 595-603.
[24] Anders C B, Lawton T M W, Smith H L,. Use of integrated metabolomics, transcriptomics, and signal protein profile to characterize the effector function and associated metabotype of polarized macrophage phenotypes [J]., 2022, 111(3): 667-693.
[25] Wculek S K, Dunphy G, Heras-Murillo I,. Metabolism of tissue macrophages in homeostasis and pathology [J]., 2022, 19(3): 384-408.
[26] Li X P, Li X H, Zhang Q B,. Low molecular weight fucoidan and its fractions inhibit renal epithelial mesenchymal transition induced by TGF-β1 or FGF-2 [J]., 2017, 105: 1482-1490.
[27] Zhao P, Cai Z H, Tian Y G,. Effective-compound combination inhibits the M2-like polarization of macrophages and attenuates the development of pulmonary fibrosis by increasing autophagy through mTOR signaling [J]., 2021, 101(Pt B): 108360.
[28] Huang C R, Du W, Ni Y M,. The effect of short-chain fatty acids on M2 macrophages polarizationand[J]., 2022, 207(1): 53-64.
[29] Lin Y H, Wang Y H, Peng Y J,. Interleukin 26 skews macrophage polarization towards M1 phenotype by activating cJUN and the NF-κB pathway [J]., 2020, 9(4): 938.
[30] Wang J, Zhang Q B, Zhang Z S,. Structural studies on a novel fucogalactan sulfate extracted from the brown seaweed[J]., 2010, 47(2): 126-131.
[31] Rao L Z, Wang Y, Zhang L,. IL-24 deficiency protects mice against bleomycin-induced pulmonary fibrosis by repressing IL-4-induced M2 program in macrophages [J]., 2021, 28(4): 1270-1283.
[32] Zhu L, Fu X, Chen X,. M2 macrophages induce EMT through the TGF-β/Smad2 signaling pathway [J]., 2017, 41(9): 960-968.
polysaccharides delays pulmonary fibrosis by regulating macrophages polarization
ZHANG Bo1, YUAN Yan-li2, LI Yu-tong1, XUE Tao1, LIU Yan-juan1, SHAO Feng-li1, XIN Jie1, LI Xin-peng1
1. Linyi University, Linyi 276000, China 2. Shanghai University of Traditional Chinese Medicine, Shanghai 201203, China
To exploring the mechanism ofpolysaccharides in inhibiting pulmonary fibrosis by regulating macrophage polarization.Low molecular weight fucoidan (LMWF) was obtained by free radical degradation of sulfated polysaccharide extracted from, and its monosaccharide structure was determined by high performance liquid chromatography. The expressions of polarized biomarkers in M2 macrophages of pulmonary fibrosis mice and LMWF treated mice were detected by immunohistochemistry, and the expressions of M1/M2 markers were detected by Western blotting and qRT-PCR. Lipopolysaccharide (LPS) combined with interferon-γ (IFN-γ) and interleukin-4 (IL-4) were used to induce MH-S cells respectively, and the polarization models of M1 and M2 macrophageswere constructed to explore the mechanism of LMWF in regulating macrophage polarization and delaying pulmonary fibrosis.LMWF significantly decreased the expressions of M1/M2 macrophage markers in lung tissue of mice with pulmonary fibrosis (< 0.05, 0.01, 0.001). Similarly, LMWF effectively inhibited the expressions of M1 and M2 markers in cell model (< 0.05, 0.01, 0.001).LMWF can regulate the polarization of M1 macrophages through anti-inflammatory effect in the early stage, and help to reduce fibrosis by inhibiting the polarization of M2 macrophages in the later stage.
Okam.; low molecular weight fucoidan; pulmonary fibrosis; MH-S cell; M1/M2 macrophages polarization
R285.5
A
0253 - 2670(2023)17 - 5619 - 10
10.7501/j.issn.0253-2670.2023.17.015
2023-04-13
山東省自然科學基金聯合基金資助項目(ZR2021LZY030);臨沂大學大學生創新創業訓練計劃項目(X202210452199)
張 波,副教授,研究方向為中藥鑒定與質量評價。E-mail: zhangboyxy@lyu.edu.cn
李新朋,副教授,研究方向為中藥多糖活性評價。Tel: (0539)7258639 E-mail: lixinpeng513@126.com
邵鳳麗,副教授,研究方向為海洋化學。E-mail: shaofengli@lyu.edu.cn
[責任編輯 李亞楠]

