金花茶CnbHLH79轉錄因子的克隆、亞細胞定位及表達分析
李博 劉合霞 陳宇玲 周興文 朱宇林
(1. 玉林師范學院生物與制藥學院,玉林 537000;2. 福建工程學院建筑與城鄉規劃學院,福州 350118;3. 玉林師范學院廣西高校亞熱帶生物資源保護與利用重點實驗室,玉林 537000)
金花茶(Camellia nitidissima)為山茶科(Theaceae)山茶屬(Camellia)植物,主要分布在中國廣西地區[1]。金花茶花色金黃,是培育黃色山茶的珍貴種質資源[2]。已有研究表明,金花茶花瓣中富含的類黃酮物質,不僅是金花茶抵御外界脅迫的有用物質,而且可能是促使金花茶開黃花的關鍵色素[3-4]。植物中類黃酮的合成由一系列結構基因編碼的酶催化完成[5-6]。目前,利用轉錄組測序及基因克隆技術,金花茶中類黃酮合成途徑的大部分結構基因已被克隆[7-11],金花茶花色形成機理正在逐漸闡明,但是關于金花茶花色的轉錄水平調控機制及轉錄因子的作用機理尚不明確。
MYB轉錄因子、堿性螺旋-環-螺旋(bHLH)轉錄因子、WD40 轉錄因子及其互作形成的MBW(MYB-bHLH-WD40)復合體是植物中廣泛存在、可調控植物類黃酮物質合成的關鍵轉錄因子[12-14]。目前,許多構成MBW復合體的轉錄因子已陸續從各種植物中被分離和克隆出來,利用亞細胞定位、酵母雜交實驗、雙熒光素酶互補反應實驗等技術手段,這些轉錄因子的調控機制已被闡明,MBW復合體或單獨的MYB、bHLH均可參與調節植物組織的著色,在類黃酮合成途徑中發揮重要的調控作用。例如,MBW復合體可調節茶樹(Camellia sinensis)葉片中類黃酮物質的合成以及葉片顏色的形成[15];而矮牽牛(Petunia hybrida)[16]、蝴蝶蘭(Phalaenopsis aphrodite)[17]、百合(Lilium brownii)[18]等植物的MBW復合體或單獨的MYB、bHLH則可調節花瓣顏色形成,使花瓣呈現多彩的顏色,或使花瓣上形成類型各異的花斑;此外,將克隆獲得的MYB或bHLH導入到非同種植物中進行異源表達,也能發揮其調控花色改變的作用[19-20]。
本課題組前期研究發現,CnbHLH79轉錄因子在金花茶開花過程中差異表達,且它與部分催化類黃酮合成的結構基因及MYB轉錄因子具有較高的相關性,推斷該轉錄因子可能是MBW復合體的關鍵成員之一(數據未發表)。但是金花茶CnbHLH79轉錄因子的克隆鑒定,以及它在金花茶中的表達情況尚未見報道。因此,本研究以金花茶花瓣作為研究材料,克隆金花茶CnbHLH79轉錄因子的全長序列,對該轉錄因子進行生物信息學分析和亞細胞定位研究,在轉錄水平上分析CnbHLH79轉錄因子在金花茶的側根、莖、葉、盛開的花等不同組織,以及不同開花時期花瓣中的表達模式,并分析CnbHLH79轉錄因子的表達量與色相b*、類黃酮物質含量的相關關系。本研究為闡明CnbHLH79轉錄因子在金花茶類黃酮的合成調控機制,以及調控花瓣顯黃色的作用機理奠定基礎,為黃色山茶品種的培育提供理論依據。
1 材料與方法
1.1 材料
采集金花茶的根、莖、葉、花等不同組織,以及不同開花時期的花瓣(圖1),該金花茶植株種植在廣西玉林師范學院的苗圃內(N 22°40'58'',E 110°11'27'')。利用液氮速凍采集到的金花茶組織,然后保存在-70℃超低溫冰箱中備用。
1.2 方法
1.2.1 金花茶不同組織總RNA的提取及CnbHLH79轉錄因子的克隆 首先利用RNA提取試劑盒(RNAprep Pure DP441,天根生化科技,中國北京)提取金花茶的根、莖、葉、花、花瓣等不同組織的總RNA,隨后對金花茶總RNA進行瓊脂糖凝膠電泳檢測,再利用反轉錄試劑盒(PrimerScripTMRT reagent Kit, TaKaRa,中國大連)對總RNA進行反轉錄,從而獲得cDNA模板。利用金花茶花瓣組織的轉錄組測序所獲得的unigene序列,并從中篩選出金花茶CnbHLH79轉錄因子序列,利用prime primer 3在線軟件設計出金花茶CnbHLH79轉錄因子的擴增特異性引物(表1),并利用該對引物對金花茶CnbHLH79轉錄因子進行PCR擴增,PCR反應程序如下:94℃預變性2 min;98℃變性10 s,55℃退火30 s,68℃延伸60 s,共32個循環;68℃延伸5 min。

表1 CnbHLH79轉錄因子克隆、亞細胞定位以及表達定量所用引物Table 1 Primers used for cloning, subcellular localization and quantitative analysis of CnbHLH79
利用1%瓊脂糖凝膠電泳檢測PCR擴增獲得的產物,并將852 bp的電泳片段切下,使用瓊脂糖凝膠DNA回收試劑盒(DP209-03,天根生化科技,中國北京)回收目的片段,按照試劑盒說明書進行操作。將目的片段連接在pEGOEP35S-H載體上(艾迪晶,中國武漢),再轉化到大腸桿菌(Escherichia coli)DH5α(TaKaRa,中國大連)中,隨后進行菌落PCR檢測,提取陽性菌斑的質粒進行測序,測序工作由武漢艾迪晶生物公司完成。
1.2.2 CnbHLH79轉錄因子的生物信息學分析 使用ORF Finder(http://www.bioinformatics.org/sms2/orf_find.html)預測金花茶CnbHLH79轉錄因子的開放閱讀框。通過NCBI網站的blastp程序(https://blast.ncbi.nlm.nih.gov/Blastp)進行同源性比對,獲取金花茶CnbHLH79的同源基因。隨后利用ExPASy在線網站(https://web.expasy.org/protparam/)預測金花茶CnbHLH79的蛋白質性質。而CnbHLH79蛋白的亞細胞定位及二級結構預測則通過利用Plant-mPLoc在線網站完成(http://www.csbio.sjtu.edu.cn/cgibin/PlantmPLoc.cgi),并利用DNAMAN 8.0軟件對bHLH79蛋白進行多序列比對。利用SWISS-MODEL在線網站(https://swissmodel.expasy.org/interactive)對金花茶CnbHLH79蛋白的三級結構模型進行預測。再利用MEGA10軟件,采用最大似然法(maximum likelihood, ML)構建系統進化樹,分析CnbHLH79同源基因的系統進化關系(bootstrap=1000)。
1.2.3 金花茶CnbHLH79蛋白的亞細胞定位分析 構建融合表達載體pEGOEP35S-H-bHLH79-GFP,將其轉化大腸桿菌DH5α感受態細胞,挑取陽性克隆進行測序。利用電轉化法,將測序結果正確的陽性克隆的質粒轉化到根瘤農桿菌(GV3101)。將農桿菌菌液注射到煙草下表皮葉片,弱光培養48 h后,將煙草葉片制作成玻片,在激光共聚焦顯微鏡(FV3000,Olympus公司,日本)下觀察,并拍照。
1.2.4 CnbHLH79轉錄因子的定量分析及相關性分析 利用Primer 5軟件設計CnbHLH79轉錄因子的熒光定量PCR引物(表1);利用18S rRNA作為內參基因進行熒光定量PCR反應[9,21],檢測CnbHLH79轉錄因子在側根、莖、葉、盛開的花等不同組織中的表達情況,此外還檢測了CnbHLH79轉錄因子在花瓣發育過程中的表達情況,每個樣品重復3次,采用 2-ΔΔCT法[22]計算差異基因的相對表達量,并利用單因素方差分析模型分析不同表達量之間是否存在顯著性差異。將開花過程中CnbHLH79在花瓣中的表達量與金花茶的色相b*值、槲皮素-7-O-葡糖苷(quercetin 3-O-rhamnoside-7-Oglucoside, Qu7G)、槲皮素-3-O-葡糖苷(quercetin 3-O-glucoside, Qu3G)、槲皮素(quercetin)、山奈酚(kaempferol)等類黃酮物質含量(上述數值來自課題組之前的實驗研究)[4]進行Pearson相關性分析,研究CnbHLH79的表達量與花色表型指標之間的相關性。
2 結果
2.1 金花茶CnbHLH79基因的克隆
以金花茶花瓣的cDNA為模板,利用特異性引物進行擴增,得到850 bp左右的擴增條帶(圖2);隨后對擴增產物行測序,測序結果顯示,克隆獲得的金花茶CnbHLH79轉錄因子序列的開放閱讀框長度為855 bp,該轉錄因子共編碼284個氨基酸。在NCBI數據庫中對CnbHLH79的編碼序列進行Blast比對發現,CnbHLH79與茶樹(C. sinensis)bHLH79-like轉錄因子(XP_028119408.1)、褐枝獼猴桃(Actinidia rufa)bHLH79-like轉錄因子(GFS32687.1)、中華獼猴桃(Actinidia chinensis var. chinensis)bHLH79-like轉錄因子(PSS07838.1)的相似性較高,CnbHLH79與這3個轉錄因子的相似性(identity)分別為98.94%、72.79%、72.44%。
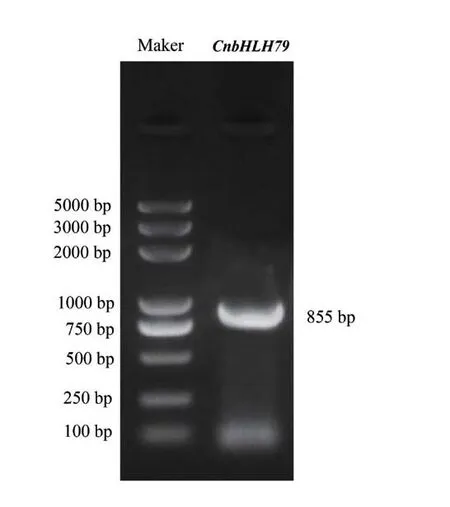
圖2 金花茶CnbHLH79基因cDNA 的PCR擴增Fig. 2 PCR amplification of CnbHLH79 gene cDNA in C. nitidissima
2.2 金花茶CnbHLH79轉錄因子的特征分析
對金花茶CnbHLH79轉錄因子的蛋白質特征及保守結構域分析,結果顯示金花茶CnbHLH79轉錄因子所編碼蛋白的分子式為C1294H2088N400O439S14,原子總數為4235,蛋白分子質量約為30.72 kD,等電點(pI)為7.02。CnbHLH79蛋白具有bHLH_AtBPE_like保守結構域,它的起止氨基酸位點為150-235位,該結構域屬于bHLH_SF超基因家族(superfamily)(圖3-A),分析結果顯示金花茶CnbHLH79蛋白具有植物bHLH轉錄因子的典型保守區域。此外,對金花茶CnbHLH79轉錄因子、擬南芥(Arabidopsis thaliana)AtbHLH79轉錄因子(AT5G62610.1)、茶樹CsbHLH79_like轉錄因子(XP_028119408.1)、褐枝獼猴桃ArBPEp轉錄因子(GFS32687.1)的蛋白序列進行多序列比對發現,它們都具有相同的保守區域(圖3-B),其中近緣物種金花茶和茶樹的CnbHLH79蛋白序列的相似性最高。
CnbHLH79蛋白含有影響蛋白質酸堿性的氨基酸共66個,其中呈堿性的氨基酸有33個,由19個精氨酸(Arg)、14個賴氨酸(Lys)所組成,而呈酸性的氨基酸有33個,由17個天冬氨酸(Asp)、16個谷氨酸(Glu)組成;CnbHLH79蛋白的不穩定系數值(instability index)為54.75,顯示該蛋白為不穩定蛋白;CnbHLH79蛋白的親水指數(grand average of hydropathicity, GRAVY)為-0.662,顯示該蛋白具有親水性,而脂溶指數(aliphatic index)則為64.26。
利用Psipred在線網站(http://bioinf.cs.ucl.ac.uk/psipred/)預測CnbHLH79蛋白的二級結構域發現,該蛋白主要包含無規則卷曲(random coil)和α-螺旋元件(α-helix),這兩種元件所占的比例分別為68.66%、31.33%,而β-折疊元件、β-轉角等其他類型的元件則沒有預測到。此外,利用SWISS-MODEL對金花茶CnbHLH79蛋白進行三級結構預測發現,CnbHLH79蛋白主要由2個α-螺旋元件和2個無規則卷曲元件組成,研究結果表明CnbHLH79蛋白的二級結構和三級結構的預測結果基本相符(圖4)。隨后,利用Plant-mPLoc在線網站對CnbHLH79蛋白的亞細胞定位進行預測發現,CnbHLH79蛋白定位在細胞核中的可能性較大。
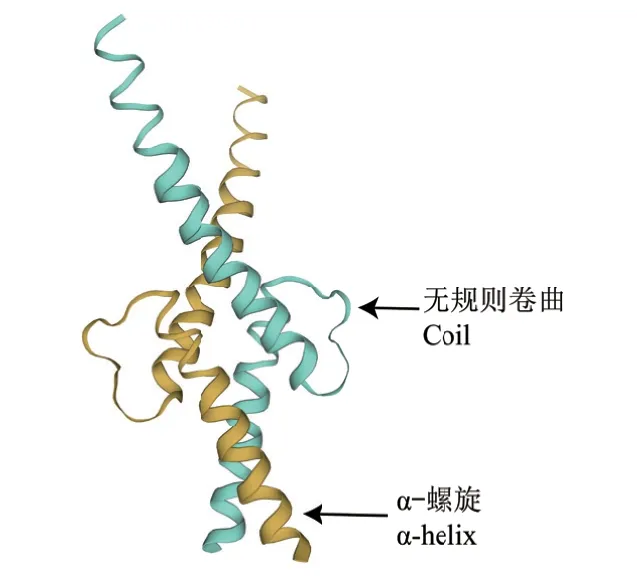
圖4 金花茶CnbHLH79蛋白的三維結構預測Fig. 4 Tertiary structure prediction of CnbHLH79 protein in C. nitidissima
2.3 金花茶CnbHLH79蛋白的同源性比對及系統進化分析
為解析金花茶CnbHLH79蛋白在植物系統進化中的關系,本研究通過Blast比對,獲取了17條與金花茶CnbHLH79蛋白同源性較高的蛋白序列(identity>65%),隨后利用這17條序列與CnbHLH79蛋白序列一起構建系統進化樹(圖5)。分析結果表明,金花茶CnbHLH79蛋白與同為山茶科山茶屬的茶樹bHLH79蛋白的親緣關系最近,它們在系統進化樹中被聚類在一個小分支內。另外還發現金花茶CnbHLH79蛋白與高叢越橘(Vaccinium corymbosum)的VcbHLH044蛋白、中華獼猴桃(A.chinensis var. chinensis)的AcbHLH79_like蛋白、褐枝獼猴桃(A. rufa)的ArBPEp蛋白也具有較高的相似性,CnbHLH79蛋白與這些蛋白親緣關系較近,它們被聚類在同一個小簇中。而金花茶CnbHLH79蛋白與燈籠辣椒(Capsicum baccatum)的CbbHLH79蛋白、辣椒(Capsicum annuum)的CabHLH_like89蛋白的親緣關系最遠。

圖5 金花茶CnbHLH79蛋白系統發生樹Fig. 5 Phylogenetic tree of protein CnbHLH79 in C. nitidissima
2.4 金花茶CnbHLH79轉錄因子的亞細胞定位驗證
Plant-mPLoc在線預測結果顯示,金花茶CnbHLH79蛋白定位于細胞核中,為了驗證上述預測結果,構建獲得了pEGOEP35S-H-CnbHLH79-GFP載體表達載體,通過農桿菌介導的煙草葉片下表皮細胞瞬時轉化實驗,分析金花茶CnbHLH79蛋白在細胞中的定位情況。目標蛋白主要使表皮細胞的細胞核發出綠色熒光,且在細胞核中與紅色熒光染料(SV40 NLS)共定位,實驗結果(圖6)顯示,CnbHLH79-GFP蛋白定位于細胞核中,表明該轉錄因子主要在細胞核中發揮功能。
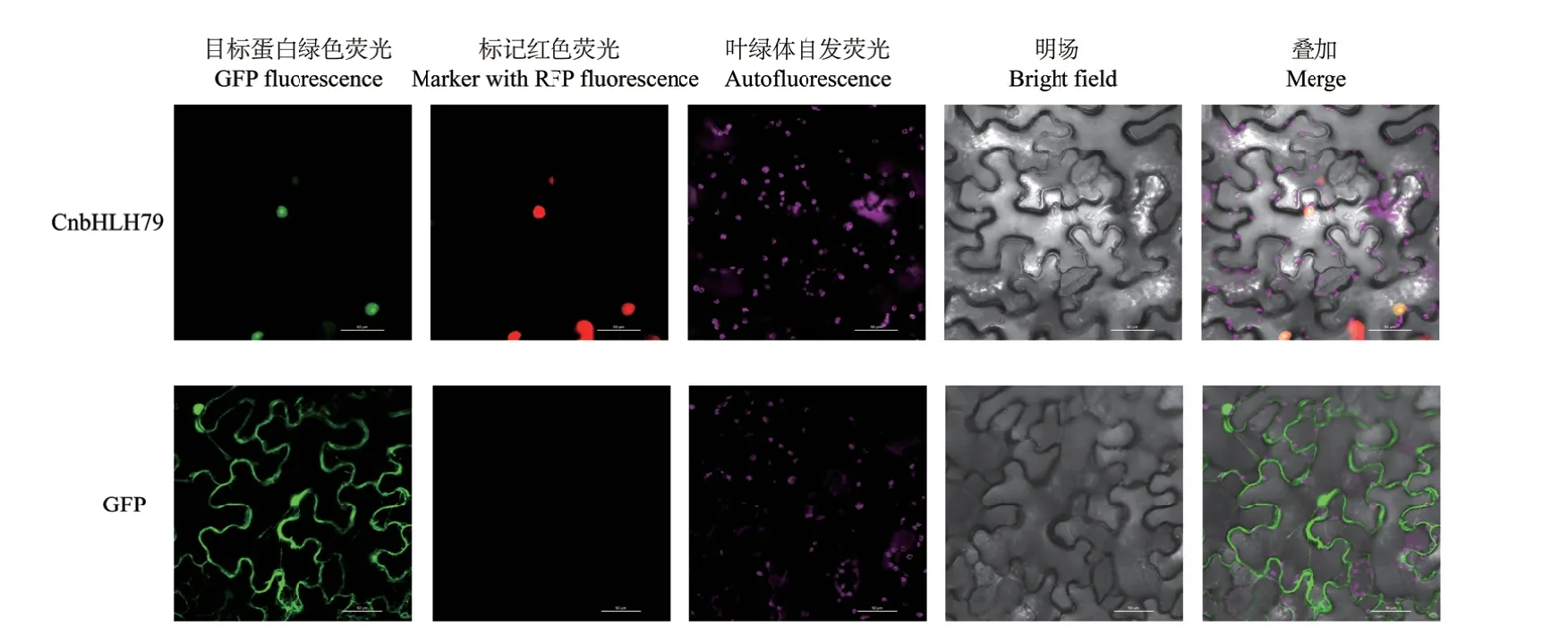
圖6 CnbHLH79蛋白的亞細胞定位Fig. 6 Subcellular localization of the protein CnbHLH79(Bar = 50 μm)
2.5 金花茶CnbHLH79的表達分析及相關性分析
通過對金花茶CnbHLH79轉錄因子的熒光定量PCR分析發現,該轉錄因子主要在金花茶的根和花中高表達,而在莖和葉中的表達量則相對較低(圖7)。此外,還發現在不同開花階段的花瓣中,CnbHLH79轉錄因子的表達總體呈現先高后低,逐步下降的趨勢,在幼蕾期、初蕾期的表達量較高,在半開期、盛開期的表達量較低(圖8)。將開花過程中CnbHLH79在花瓣中的表達量與金花茶的色相b*值、槲皮素-7-O-葡糖苷、槲皮素-3-O-葡糖苷、槲皮素、山奈酚等類黃酮物質含量的Pearson相關性分析,結果表明,CnbHLH79的表達量與色相b*值、槲皮素-7-O-葡糖苷的負相關性較高,其相關性系數分別為-0.92、-0.7(圖9)。
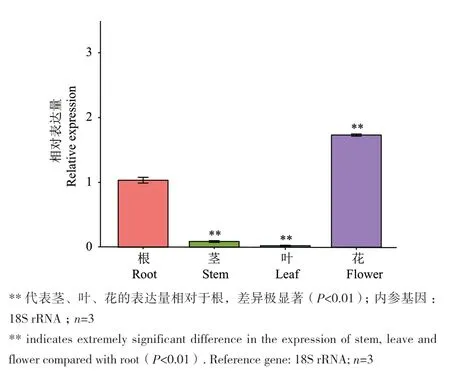
圖7 CnbHLH79在不同組織中的基因表達量Fig. 7 Relative expressions of CnbHLH79 in different culture
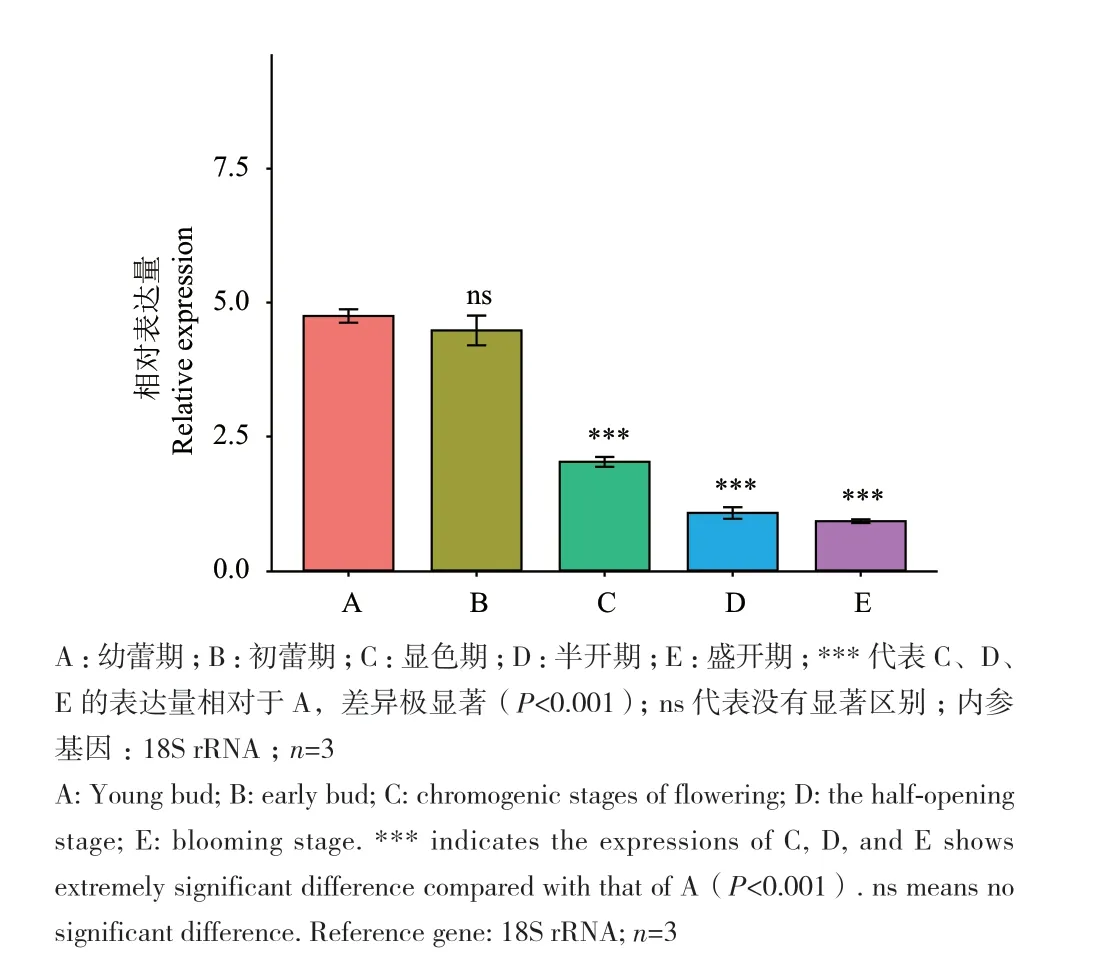
圖8 CnbHLH79轉錄因子在不同開花時期的表達量Fig. 8 Expressions of CnbHLH79 at different flowering stages
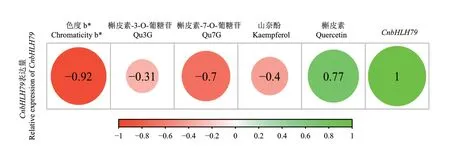
圖9 CnbHLH79的表達量與花色指標、類黃酮化合物的相關性分析Fig. 9 Correlation analysis between expression of CnbHLH79 and color index, content of flavonoid compounds
3 討論
3.1 CnbHLH79轉錄因子對金花茶花色形成的調控作用分析
bHLH基因家族作為植物第二大轉錄因子家族,在類黃酮代謝、逆境脅迫響應、植物生長發育等方面發揮了重要的調控作用[23-25]。例如,玉米(Zea mays)中bHLH轉錄因子B-peru和擬南芥mPAP1基因能協同作用,可增加番茄(Solanum lycopersicum)花瓣中類黃酮化合物的含量,使花瓣顏色變深[26];荷花(Nelumbo nucifera)中的bHLH轉錄因子NnTT8具有調節花青素和原花青素合成的功能,該基因可改變轉基因擬南芥的種皮顏色[27];石斛雜交種(Dendrobium hybrids)的DhbHLH1轉錄因子可與DhMYB2共同作用,使石斛雜交種的白色花瓣生成紫色斑點[28];并且這些基因在它們發揮功能的部位都具有較高的表達量。金花茶CnbHLH79轉錄因子在不同組織中的熒光定量分析結果表明,CnbHLH79轉錄因子在金花茶根和花中的表達量較高,由此推斷該轉錄因子主要在這兩個組織中發揮作用。另外,還發現在金花茶開花過程中CnbHLH79轉錄因子在花瓣中的表達總體呈先高后低的下降趨勢,所以CnbHLH79轉錄因子可能在開花過程的早期具有調控的作用。Liu等[29]在對金花茶全長轉錄組的研究中通過WGCNA分析發現,CnbHLH79轉錄因子與類黃酮合成通路中的結構基因PAL(phenylalanine ammonia-lyase)存在于一個共同的調控網絡中,且CnbHLH79轉錄因子與該網絡的核心基因PAL具有較高的關聯度,CnbHLH79轉錄因子可能通過調控PAL的表達來調節金花茶花瓣中類黃酮物質的合成。此外,已有研究表明金花茶花瓣中的槲皮素-7-O-葡糖苷(Qu7G)、槲皮素-3-O-葡糖苷(Qu3G)是影響金花茶花色形成的關鍵化合物[30],色相b*是金花茶花色描述的主要指標[31]。本課題組在之前的研究中發現,CnbHLH79轉錄因子在花瓣發育過程中的表達量,與苯丙氨酸解氨酶(phenylalanine ammonialyase, PAL)、查爾酮合成酶(chalconesynthase, CHS)、二氫黃酮醇-4-還原酶(difunctional dihydroflavonol 4-reductase/flavanone 4-reductase, DFR)、黃酮醇合成酶(flavonol synthase, FLS)等類黃酮合成途徑的結構基因的表達量,具有較強的相關性;且在本研究中通過相關性分析發現,CnbHLH79轉錄因子的表達量與金花茶花瓣的花色指標(色度b*值)、類黃酮物質含量,例如槲皮素-7-O-葡糖苷(Qu7G),具有較強的負相關性,因此推斷CnbHLH79基因對于金花茶花色的形成以及類黃酮物質的合成,可能具有負調控的功能。
3.2 CnbHLH79轉錄因子對冷脅迫的作用分析
類黃酮化合物是植物中廣泛存在的一類次生代謝物質,它可以提高植物對逆境的適應能力[32]。類黃酮化合物主要通過防止活性氧的產生以及清除已生成的活性氧,來完成其抗氧化功能,進而提高植物的適應性[33-34]。例如,在低溫條件下,類黃酮化合物在蘋果中會大量積累,從而提高蘋果對低溫逆境的適應能力[35]。此外,已有研究發現bHLH79轉錄因子具有提高植物適應冷脅迫的功能,例如在冷脅迫環境中,茶樹CsbHLH79轉錄因子的表達量會顯著提高[36]。CabHLH79通過調控CaNAC035的表達,進而增強活性氧簇(reactive oxygen species,ROS)相關基因及冷耐受基因的表達,從而提高辣椒對冷脅迫的適應性[37]。金花茶主要在冬季開花,不同開花過程的花瓣中CnbHLH79轉錄因子在低溫環境中存在差異表達現象,并且該轉錄因子的表達量與槲皮素、槲皮素-7-O-葡糖苷等物質的相關性較強,因此在金花茶中可能存在著通過CnbHLH79轉錄因子調節類黃酮物質合成,從而適應低溫逆境的機制。但目前有關金花茶CnbHLH79轉錄因子的功能研究尚未見報道,該轉錄因子的具體功能仍有待深入研究。
4 結論
CnbHLH79轉錄因子具有bHLH基因家族的bHLH_AtBPE_like保守結構域,與茶樹bHLH79蛋白的親緣關系最近,亞細胞定位在細胞核中,且主要在金花茶的根、花等組織中高表達。在金花茶開放過程中,CnbHLH79的表達量總體呈先高后低的趨勢。此外,CnbHLH79的表達量與色相b*值、槲皮素-7-O-葡糖苷的負相關性較高。因此,推斷CnbHLH79發揮功能的場所是在細胞核中,它主要在金花茶的根、花中發揮作用,且可能在金花茶花朵開放的早期對類黃酮物質合成進行負向調控。

