鮑曼不動桿菌基因點突變與耐藥性及生物膜特征的相關性研究
李振?楊萍?殷瑜?陳代杰


摘要:目的 研究鮑曼不動桿菌基因組上3個基因ptkD569N,shlBR403H及iclRY49H分別與基因pmrAI13M雙位點突變,對鮑曼不動桿菌的耐藥性和生物膜形成的影響。方法 在突變菌株AT196011的基礎上,通過同源重組,構建3株雙突變菌株AT196012、AT196013和AT196014;通過生長曲線考察不同點突變對細菌生長的影響;采用微量肉湯稀釋法測定突變菌株對多黏菌素的最低抑菌濃度;通過時間-殺菌曲線動態(tài)分析,比較各突變菌株對多黏菌素的耐藥性差異;采用結晶紫染色法對生物膜進行半定量測定,并用CCK-8試劑對生物膜內活菌數(shù)進行相對定量測定。結果 對PCR產物進行電泳檢測與測序表明三株雙突變菌株構建成功。各突變菌株對多黏菌素的最低抑菌濃度和時間-殺菌曲線表明,相較于AT196011單突變菌株,雙突變株AT196012和AT196014對多黏菌素的耐藥性增強,而AT196013的耐藥性無明顯變化;在生物膜形成方面,3株雙突變菌株的生物膜生成量顯著高于AT196011單突變菌株;1/2 MIC濃度的多黏菌素對AT196013與AT196014雙突變菌株生物膜形成的抑制作用顯著低于AT196011單突變菌株,其生物膜內活菌量也顯著多于AT196011單突變菌株。結論 基因ptkD569N、iclRY49H和基因pmrAI13M的雙點突變,會增加鮑曼不動桿菌對多黏菌素的耐藥性;基因ptkD569N,shlBR403H和iclRY49H和pmrAI13M的雙點突變,會協(xié)同促進生物膜的形成,且shlBR403H和 iclRY49H的促進作用更強,相應雙突變菌株對多黏菌素的耐受性更強。
關鍵詞:鮑曼不動桿菌;基因點突變;耐藥性;生物膜;多黏菌素
中圖分類號:R978.1文獻標志碼:A
Correlation study between gene point mutation of Acinetobacter baumannii
and drug resistance and biofilm characteristics
Li Zhen, Yang Ping, Yin Yu, and Chen Dai-jie
(School of Pharmacy, Shanghai Jiao Tong University, Shanghai 200240)
Abstract? ? Objective To investigate the effects of three point mutations in three different genes (ptkD569N, shlBR403H and iclRY49H) on drug resistance and biofilm formation in Acinetobacter baumannii. Methods Homologous recombination was used to create three double mutant strains, AT196012, AT196013, and AT196014, based on the previously created mutant strain AT196011; growth curves were used to examine the effects of various point mutations on bacterial growth, and the micro-broth dilution method was used to estimate the mutant strains lowest inhibitory concentration for colistin; the differences in the resistance of each mutant strain to colistin were compared using dynamic analysis of the time-kill curve; the biofilms were semi-quantitatively quantified by crystal violet staining, and CCK-8 reagent was used to measure relative viable bacterial counts in the biofilms. Results Three double mutant strains were successfully created, according to the electrophoresis and sequencing results of the PCR products. The double mutant strains AT196012 and AT196014 had stronger drug resistance than the single mutant strain AT196011, with no discernible difference in resistance between AT196013 double mutant strain and AT196011 single mutant strain; In terms of biofilm formation, the three double mutant strains produced significantly more biofilm than the single mutant strain AT196011; the inhibitory effect of 1/2 MIC colistin on the formation of biofilm in the double mutant strains AT196013 and AT196014 was significantly lower than in the single mutant strain AT196011 and the amount of viable bacteria in the biofilm was significantly higher than that of AT196011 single mutant strain. Conclusions Genes ptkD569N and iclRY49H, and the gene pmrAI13M, have a synergistic effect in drug resistance; the gene ptkD569N, shlBR403H and iclRY49H, and the gene pmrAI13M, also have synergistic effects in promoting the formation of biofilms. shlBR403H and iclRY49H had stronger promoting effects, and the corresponding double mutant strains had stronger tolerance to colistin.
Key words? ? ?Acinetobacter baumannii; Gene point mutation; Resistance; Biofilm; Colistin
鮑曼不動桿菌(Acinetobacter baumannii)是一種需氧的革蘭陰性桿菌,是全球醫(yī)院獲得性感染的重要原因[1]。2017年,在WHO發(fā)布的首份急需新型抗生素的重點病原體清單中,耐碳青霉烯類鮑曼不動桿菌(carbapenem resistant Acinetobacter baumannii, CRAB)被列為迫切需求新型抗生素的病原體。引起鮑曼不動桿菌產生耐藥性的機制有很多,包括產生抗生素滅活酶、激活外排泵、改變外膜通透性及形成生物膜等[2]。
細菌生物膜是細菌附著在生物或非生物表面,通過分泌胞外多聚物,將其自身進行包裹而形成的一種結構。生物膜細菌在生理方面與一般的浮游細菌不同,被生物膜包裹的細菌具有有限的代謝活性并受到細胞外基質的保護,使其對抗生素和宿主的先天免疫成分更具有抵抗性[3-4]。生物膜的形成受多個基因以及環(huán)境因素的影響,同時更多生物膜形成的機制還有待于進一步挖掘[4]。
前期經過多黏菌素誘導鮑曼不動桿菌ATCC19606獲得了穩(wěn)定耐藥的突變株AT19607,其對多黏菌素的最低抑菌濃度(minimum inhibitory concentration, MIC)比野生菌株提高了32倍,同時其生物膜的生成量也顯著提高。經全基因組測序與分析后發(fā)現(xiàn),與野生菌株相比,AT19607菌株在pmrAI13M、ptkD569N、 shlBR403H和iclRY49H 4個位點處發(fā)生了點突變。進一步分別構建此4個基因的單突變株,發(fā)現(xiàn)pmrAI13M的突變對耐藥性起主要貢獻,其單突變菌株AT196011對多黏菌素的MIC值較野生菌株提高了16倍,但生物膜的生成量與野生菌株并無顯著性差異。因此,本文主要探究AT19607菌株中另外3個點突變,與pmrAI13M點突變,是否在耐藥性以及生物膜的形成中,存在協(xié)同作用。本研究分別構建了AT196012、AT196013和AT196014 3株雙突變菌株,研究了其余3個點突變在鮑曼不動桿菌耐藥性及生物膜形成中的作用。
1 材料與方法
1.1 菌株與質粒來源
鮑曼不動桿菌標準菌株ATCC19606購自ATCC菌株保藏中心,突變株AT19611及含鮑曼不動桿菌重組系統(tǒng)的RecAb質粒pAT04,點突變模板質粒pLC001,pLC002和pLC003等由本實驗前期自行構建(表1)。
1.2 儀器與試劑
1.2.1 儀器
T100熱循環(huán)儀(Bio-Rad);Gene Pulser Xcell? 電穿孔儀(Bio-Rad);EPS-200數(shù)顯式穩(wěn)壓穩(wěn)流電泳儀及HE-220高通量水平電泳槽(上海天能);全自動微生物生長曲線儀(OY Growth Curves);隔水式電熱恒溫培養(yǎng)箱(上海躍進醫(yī)療器械有限公司);TECAN多功能酶標儀;HFsafe-1200LC系列生物安全柜(力康生物醫(yī)療科技控股有限公司)。
1.2.2 試劑
細菌培養(yǎng)材料主要購自英國Oxoid公司;卡那霉素(Kan),四環(huán)素(Tet)購自上海源葉生物有限公司;KOD FX酶購自東洋紡(上海)生物科技有限公司;結晶紫購自上海阿拉丁生化科技股份有限公司;Cell Counting Kit-8(CCK-8)試劑盒購自蘇州新賽美生物科技有限公司;多黏菌素E由上海醫(yī)藥工業(yè)研究院馮軍老師提供;瓊脂糖購自生工生物工程(上海)有限公司,本研究所用的引物均由該公司合成(表2)。
1.3 實驗方法
1.3.1 細菌培養(yǎng)
鮑曼不動桿菌野生菌株ATCC19606及各突變菌株的甘油保存管放置冰上,劃線于新鮮的相應抗性或無抗LB平板上,37℃培養(yǎng)箱培養(yǎng)16 h。挑取單個菌落接種于相應抗性或無抗LB液體培養(yǎng)基,37℃,220 r/min震蕩培養(yǎng)16 h。
1.3.2 基因敲除菌株的構建
以相應的定點誘變模板質粒pLC002,pLC003,pLC004為模板,以引物M13F和M13R為上下游引物PCR擴增含突變位點的基因片段,擴增結束后將PCR產物用膠回收試劑盒純化回收之后氮吹濃縮,制成約5 μg的點突變電轉片段,-20℃保存待后續(xù)實驗使用。
將含重組蛋白的pAT04質粒電轉(2.5 kV)入AT196011感受態(tài)細胞中,之后涂布在含四環(huán)素(15 ?g/mL)的LB固體培養(yǎng)基中,37℃靜置過夜培養(yǎng),挑取單菌落接種于含四環(huán)素(10 ?g/mL)的LB液體培養(yǎng)基試管中,37℃,220 r/min條件下過夜培養(yǎng),以3%接種量轉接于含50 mL LB液體培養(yǎng)基的搖瓶中,添加終濃度為1 mmol/L IPTG和10 ?g/mL四環(huán)素,37℃,220 r/min震蕩培養(yǎng)至A600nm=0.8~1.0;5000 r/min離心10 min收集菌體,用預冷的10%無菌甘油或無菌水洗滌2次,最終添加200 ?L冰預冷10%無菌甘油或無菌水中懸菌體并分裝到3支EP管中,每支EP管分裝100 ?L感受態(tài)細胞。將之前制備好的點突變電轉片段加入100 ?L感受態(tài)細胞中,利用2 mm電轉杯電轉,電壓為2.5 kV,電擊后立即添加900 ?L LB液體培養(yǎng)基,37℃,220 r/min復蘇1 h,菌液全涂于含四環(huán)素(終濃度15 ?g/mL)與卡那霉素(終濃度為100 ?g/mL)的LB固體培養(yǎng)基平板,37℃培養(yǎng)至單菌落長出,挑取單菌落進行菌落PCR驗證。
將菌落PCR驗證陽性的點突變菌株PCR擴增含突變點的片段,送生工生物工程(上海)有限公司進行測序驗證。
1.3.3 各菌株生長情況的測定
將過夜培養(yǎng)的各菌株以1:1000的稀釋比例接種于LB液體培養(yǎng)基中并加入到全自動生長曲線儀配套孔板各個孔中,每個菌株做3個復孔平行;設置培養(yǎng)溫度37℃,每1 h自動測定各個孔中A600值,繪制各菌株生長曲線,觀察各突變菌株的生長情況。
1.3.4 最低抑菌濃度的測定
參照美國臨床和實驗室標準化協(xié)會(CLSI)發(fā)布的微生物藥敏實驗檢測方法測定最低抑菌濃度(MIC)。挑單菌落過夜孵育,第二天將菌液1:1000稀釋至MH(Mueller Hinton) 培養(yǎng)基中,用于MIC的測定。在96 孔板各孔中分別加入100 μL MH 培養(yǎng)基,加入梯度稀釋的多黏菌素,最后加入100 μL前面稀釋好的菌液(多黏菌素最終濃度梯度為128、64、32、16、8、4、2、1、0.5、0.25和0.125 μg/mL)。放入恒溫培養(yǎng)箱中培養(yǎng)16~18 h,觀察細菌的生長情況,以澄清孔的最低濃度為MIC值。
1.3.5 多黏菌素對各突變菌株的時間-殺菌曲線
將過夜培養(yǎng)的每種突變菌株活化的菌液以1:1000的比例轉接到2個新的2 mL LB液體培養(yǎng)基試管中,每種突變菌株的2個轉接試管其中一個加入終濃度為8 μg/mL的多黏菌素,另一個試管不加任何藥物作為陰性對照。之后將各個試管放入37℃,220 r/min搖床中使菌液與藥物共同孵育,分別于加藥后0、2、4、8、12、24 h 6個時間點進行取樣,將每次取出的菌液進行10倍梯度的稀釋,取適宜稀釋倍數(shù)的稀釋液5 ?L點在LB固體培養(yǎng)基平板上,每個稀釋倍數(shù)做3個平行,待吹干之后將平板放入培養(yǎng)箱中恒溫培養(yǎng)16~18 h,進行菌落計數(shù),以菌落形成單位(colony-forming units,CFU)表示,并將各個組別不同時間點的菌落數(shù)量繪制成曲線。
1.3.6 突變菌株生物膜含量測定
將過夜培養(yǎng)的菌液用無菌LB液體培養(yǎng)基,按照1:100比例進行稀釋,獲得菌懸液。取一個無菌96孔板,每孔加入180 μL稀釋后的菌液,并置于37℃恒溫培養(yǎng)箱培養(yǎng)24 h。培養(yǎng)結束后,吸出96孔板里的菌液并用200 μL無菌生理鹽水洗滌3次,洗滌完成后將96孔板放入60℃烘箱中固定1 h,之后加入180 μL濃度為1%的結晶紫溶液染色15 min,染色結束后吸出結晶紫溶液,加入生理鹽水洗滌3次,之后加入180 μL 95%乙醇溶解結晶紫,測定溶液在A570nm的值來標定生物膜含量。
1.3.7 多黏菌素對突變菌株的生物膜形成抑制及生物膜活菌量測定
將過夜培養(yǎng)的菌液用LB液體培養(yǎng)基,按照1:100比例進行稀釋,獲得菌懸液。取一無菌96孔板,每孔加入180 μL稀釋后的菌液,再加入終濃度為1/2MIC的多黏菌素,并置于37℃恒溫培養(yǎng)箱培養(yǎng)24 h。
(1)生物膜含量的測定? ? 按照“1.3.6”的方法洗滌,固定,染色,洗脫之后,測定溶液在A570nm的值來標定藥物作用下生物膜含量。根據(jù)如下公式計算各突變菌株在1/2MIC的多黏菌素作用下,與未加藥物的對照組比較,其生物膜形成受到藥物抑制的抑制率:
(2)生物膜活菌量測定? ? 吸出96孔板里的浮游菌,并用200 μL無菌生理鹽水洗滌3次,再加入170 μL無菌生理鹽水和10μL的WST-8溶液,孵育1 h,測定A450的值用以表征生物膜內相對活菌量。
1.3.8 統(tǒng)計學方法
采用SPSS 22.0分析軟件對本實驗數(shù)據(jù)進行處理分析,每個實驗重復3次,數(shù)據(jù)均以均數(shù)±標準差表示。兩組之間的比較采用獨立樣本T檢驗,以P<0.05(*),P<0.01(**)和P<0.001(***)為顯示有統(tǒng)計學意義。
2 結果
2.1 點突變菌株的構建及測序驗證
將卡那霉素平板上長出來的單克隆菌落采用菌落PCR驗證,ptkD569N,shlBR403H和iclRY49H點突變菌株的驗證,分別采用p-F1/p-R1, S-F1/S-R1, i-F1/i-R1引物進行驗證,陽性菌落的條帶大小分別為3.6 kb,4.5 kb,3.1 kb,陰性菌落的條帶大小分別為2.6 kb,2.5 kb,2.4 kb。各點突變菌株PCR相關引物及位點設計如圖1所示。將ptkD569N,shlBR403H和iclRY49H點突變陽性菌落,分別設計引物p-F2/p-R2,S-F2/S-R2和i-F2/i-R2,對包含突變點的片段進行PCR擴增(圖2),并送生工生物工程(上海)有限公司進行測序驗證,測序結果顯示陽性菌落確實突變成功(圖3)。
2.2 點突變對菌株生長的影響
通過測定不同菌株的生長曲線確定基因點突變會對菌株生長產生一定的影響。如圖4所示,各突變菌株的生長速度均低于野生菌株ATCC19606,而各突變菌株之間沒有顯著性差異。
2.3 各突變菌株對多黏菌素耐藥性的測定
2.3.1 多黏菌素對各突變菌株最低抑菌濃度的測定
將多黏菌素對各突變菌株的MIC值進行測定,結果表明,AT196012和AT196014雙突變菌株的MIC值是AT196011單突變菌株的2倍,說明基因ptkD569N 和iclRY49H與基因pmrAI13M的突變,在耐藥性方面存在協(xié)同或疊加作用;而AT196013雙突變菌株的MIC值與AT196011單突變菌株一致,說明基因shlBR403H與基因pmrAI13M,在耐藥性方面無相關作用(表3)。
2.3.2 多黏菌素對各突變菌株的時間-殺菌曲線
為了進一步比較各突變菌株耐藥性的差異,測定了多黏菌素對不同突變菌株的時間-殺菌曲線,結果發(fā)現(xiàn),當在8 μg/mL多黏菌素作用下,AT196012和AT196014雙突變菌株及AT19607菌株幾乎沒有受到多黏菌素影響,其生長情況與未加藥物的陰性對照菌株的生長情況類似;而AT196013雙突變菌株與AT196011單突變菌株的生長明顯受到了多黏菌素的抑制,其在0~2 h菌落數(shù)出現(xiàn)了明顯的下降,但是由于8 μg/mL的多黏菌素對其沒有起到完全的抑制作用,2 h之后菌落數(shù)開始上升,最終在24 h時的菌落數(shù)仍然略低于另外3株加藥的突變菌株。通過測定突變菌株的時間-殺菌曲線,進一步說明ptkD569N和iclRY49H點突變與pmrAI13M點突變,在耐藥性方面存在協(xié)同或疊加作用。
2.4 不同基因雙突變對生物膜形成的影響
2.4.1 不同突變株生物膜量的差異比較
用半定量結晶紫染色法,對各突變菌株培養(yǎng)24 h時,所形成生物膜量進行比較。結果如圖6所示。各雙突變菌株的生物膜含量在24 h時,都顯著高于AT196011單突變菌株。其中AT196013和AT196014菌株的生物膜含量,要高于AT196012菌株,并且AT19607菌株的生物膜含量最高。這表明在生物膜的形成方面,基因ptkD569N、shlBR403H和iclRY49H,與基因pmrAI13M都存在協(xié)同作用,導致鮑曼不動桿菌生物膜量的增加,而AT19607的生物膜形成可能是多個基因作用共同疊加的結果。
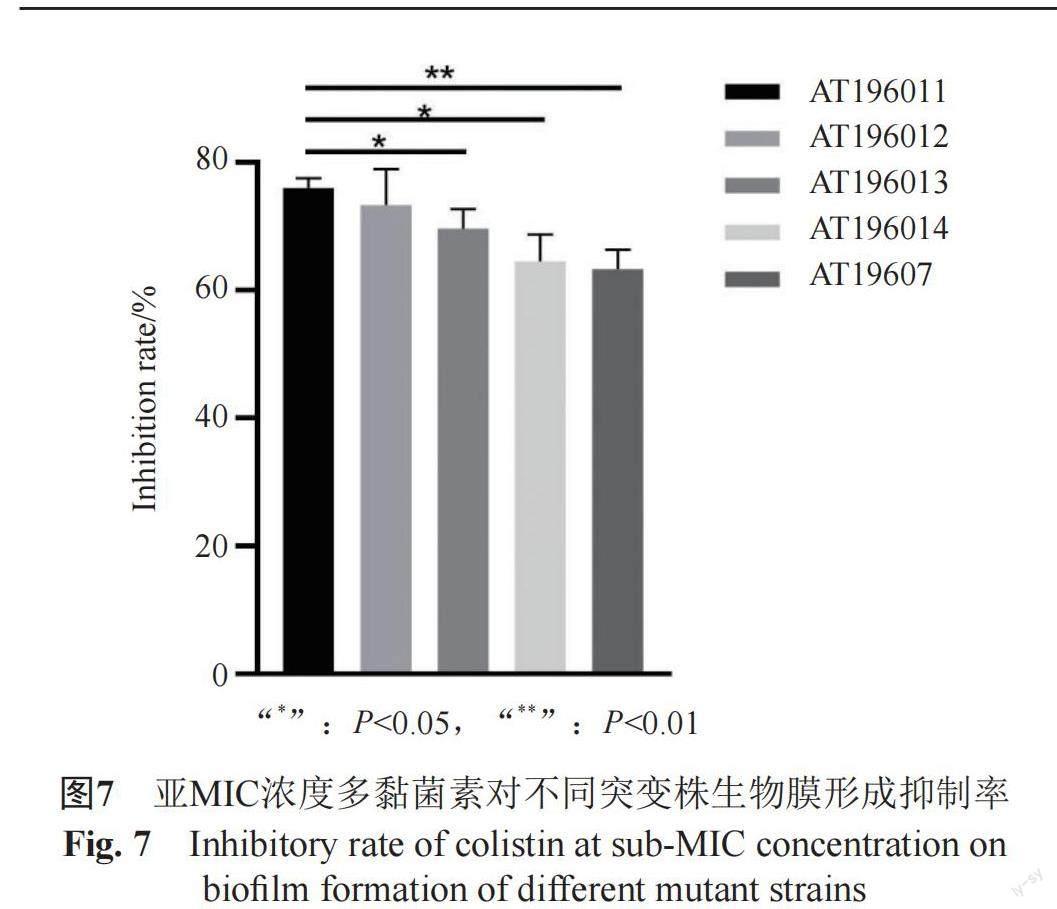
2.4.2 亞MIC條件下多黏菌素對各突變株生物膜形成的影響
為了研究多黏菌素是否會影響各突變菌株生物膜的形成,測定1/2MIC多黏菌素濃度下各突變株生物膜的形成情況。結果如圖7所示,在藥物作用下,AT196013和AT196014雙突變菌株的生物膜形成抑制率顯著低于AT196011單突變菌株,AT196012雙突變菌株生物膜形成抑制率要略低于AT196011單突變菌株,但兩者之間沒有顯著性差異,所有突變菌株中,多黏菌素對AT19607菌株的生物膜形成抑制率最低。
同時對1/2MIC濃度多黏菌素作用下不同突變菌株的生物膜活菌量進行了測定,如圖8所示, AT196013和ATCC196014雙突變菌株的生物膜活菌量顯著高于AT196011單突變菌株,而AT196012菌株的活菌量略高于AT196011單突變菌株,但兩者之間沒有顯著性差異,同時AT19607的生物膜活菌量最高,這進一步說明生物膜形成能力越強,生物膜菌對環(huán)境的耐受性也更強。
3 討論
近年來,對抗生素產生耐藥性的鮑曼不動桿菌已成為對全球公共衛(wèi)生的嚴重威脅,并被視為需要緊急關注的首要任務之一,而生物膜的形成是鮑曼不動桿菌在臨床上對抗生素產生耐受性的重要原因[5]。因此,對鮑曼不動桿菌的耐藥性及生物膜形成和調控機制進行深入探索對研發(fā)治療鮑曼不動桿菌感染的藥物具有重要的意義。
在對各突變菌株耐藥性分析中,本研究發(fā)現(xiàn),ptkD569N和iclRY49H點突變可以協(xié)同pmrAI13M點突變增加鮑曼不動桿菌的耐藥性。本研究顯示,AT19607耐藥性的增加雖然主要與已報道的pmrAI13M點突變上調脂質A的修飾相關[6],但與ptkD569N和iclRY49H點突變也存在一定相關性。前期研究表明,AT196015菌株的耐藥性略強于野生菌株ATCC19606,而AT196016菌株的耐藥性與ATCC19606類似[6],因此猜測ptkD569N點突變可能和pmrAI13M點突變具有疊加增強ATCC19606耐藥性作用,而iclRY49H點突變可能需要在pmrAI13M 點突變基礎上通過其他途徑上調細菌耐藥性。
當對各突變菌株生物膜含量進行研究時,結果發(fā)現(xiàn),ptkD569N,shlBR403H和iclRY49H點突變,與pmrAI13M點突變都具有協(xié)同作用,可以促進鮑曼不動桿菌的生物膜量的增加。目前有文獻表明,與ptk基因相關的莢膜多糖的產生,與生物膜的粘附與發(fā)展存在關聯(lián)[7-10];而IclR家族作為一種轉錄調控因子,有研究表明其可以通過調控細菌的群體感應系統(tǒng),以促進生物膜的生成[11-12]。因此,猜測ptkD569N和iclRY49H點突變,協(xié)同 pmrAI13M點突變,能導致生物膜形成量的增加,這可能與莢膜多糖的形成和細菌的群體感應系統(tǒng)有關;而shlB基因與細菌溶血素蛋白的生成有關[13-14],但目前尚無報道其與生物膜形成存在關聯(lián)。有研究表明,生物膜形成與多種細菌的毒力因子有關[4],因此關于shlB基因所調控的溶血素毒力因子與生物膜形成的關系仍然需要進一步研究。此外,本研究還發(fā)現(xiàn),在藥物作用下shlBR403H和iclRY49H點突變,與pmrAI13M點突變協(xié)同促進生物膜形成的能力更強,其生物膜內存在的活菌量也更多,進一步說明其對環(huán)境產生的耐受性也更強。由于AT19607菌株的幾個點突變是在多黏菌素作用下突變產生的,是菌株對環(huán)境產生耐受性的表現(xiàn),而幾株點突變菌株在對多黏菌素的MIC方面沒有較大的差異,因此,本研究認為另外3個點突變對菌株耐受性的貢獻可能主要體現(xiàn)在促進菌株生物膜形成進而增加其對環(huán)境的耐受性方面。
綜上所述,本研究深入討論了相關基因點突變與鮑曼不動桿菌的耐藥性,及生物膜形成的關系,為抗鮑曼不動桿菌藥物的研究提供了新的方向。但是這3個基因點突變,與pmrA基因相互作用對鮑曼不動桿菌藥物的敏感性及生物膜的調控的機制,仍然需要進一步探索。
參 考 文 獻
Lin M F, Lan C Y. Antimicrobial resistance in Acinetobacter baumannii: From bench to bedside[J]. World J Clin Cases, 2014, 2(12): 787-814.
Lee C R, Lee J H, Park M, et al. Biology of Acinetobacter baumannii: Pathogenesis, antibiotic resistance mechanisms, and prospective treatment options[J]. Front Cell Infect Microbiol, 2017, 7(55): 1-35.
Runci F, Bonchi C, Frangipani E, et al. Acinetobacter baumannii biofilm formation in human serum and disruption by gallium[J]. Antimicrob Agents Chemother, 2017, 61(1): e01563-16.
Gedefie A, Demsis W, Ashagrie M, et al. Acinetobacter baumannii biofilm formation and its role in disease pathogenesis: A review[J]. Infect Drug Resist, 2021, 14: 3711-3719.
Magiorakos A P, Srinivasan A, Carey R B, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: An international expert proposal for interim standard definitions for acquired resistance[J]. Clin Microbiol Infect, 2012, 18(3): 268-281.
Sun B, Liu H, Jiang Y, et al. New mutations involved in colistin resistance in Acinetobacter baumannii[J]. mSphere, 2020, 5(2): e00895-19.
Geisinger E, Isberg R R. Antibiotic modulation of capsular exopolysaccharide and virulence in Acinetobacter baumannii[J]. PLoS Pathog, 2015, 11(2): e1004691.
Lees-Miller R G, Iwashkiw J A, Scott N E, et al. A common pathway for O-linked protein-glycosylation and synthesis of capsule in Acinetobacter baumannii[J]. Mol Microbiol, 2013, 89(5): 816-830.
Russo T A, Luke N R, Beanan J M, et al. The K1 capsular polysaccharide of Acinetobacter baumannii strain 307-0294 is a major virulence factor[J]. Infect Immun, 2010, 78(9): 3993-4000.
Hua X, Zhou Z, Yang Q, et al. Evolution of Acinetobacter baumannii in vivo: International clone ⅱ, more resistance to ceftazidime, mutation in ptk[J]. Front Microbiol, 2017, 8: 1256.
Zhou Y, Huang H, Zhou P, et al. Molecular mechanisms underlying the function diversity of transcriptional factor IclR family[J]. Cell Signal, 2012, 24(6): 1270-1275.
Aguilar C, Schmid N, Lardi M, et al. The IclR-family regulator BapR controls biofilm formation in B. cenocepacia H111[J]. PLoS One, 2014, 9(3): e92920.
Konninger U W, Hobbie S, Benz R, et al. The haemolysin-secreting ShlB protein of the outer membrane of Serratia marcescens: Determination of surface-exposed residues and formation of ion-permeable pores by ShlB mutants in artificial lipid bilayer membranes[J]. Mol Microbiol, 1999, 32(6): 1212-1225.
Braun V, Helbig S, Patzer S I, et al. Import and export of bacterial protein toxins[J]. Int J Med Microbiol, 2015, 305(2): 238-242.

