豬繁殖與呼吸綜合征病毒GP3蛋白單克隆抗體制備及抗原表位鑒定
袁 麗,孫楊楊,張路捷,張 杰,孫海鳳,白 娟,姜 平
(南京農業大學農業農村部動物細菌學重點實驗室,南京 210095)
豬繁殖與呼吸綜合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)是影響世界養豬業的重要病原,臨床上可引起母豬繁殖障礙、仔豬高死亡率和各年齡階段豬的呼吸系統癥狀,給我國養豬業帶來了巨大經濟損失[1-2]。PRRSV 可分為歐洲型(PRRSV-1)和美洲型(PRRSV-2),二者的基因相似性為50%~70%,通過對ORF5序列的系統發育分析,PRRSV-1分為4個亞型,PRRSV-2分為9個譜系[3-4]。我國主要流行PRRSV-2,包括高致病性PRRSV(亞系8.7)、經典PRRSV(亞系5.1)、類NADC30毒株(亞系1.8)及QYYZ毒株(亞系3.5)等基因亞型毒株[5]。
PRRSV 基因組為單股正鏈 RNA,長度約為15 kb,包含至少 9 個開放閱讀框(ORFs)[6-7]。其中ORF3編碼的糖基化蛋白3(glycosylated protein 3,GP3)具有7個糖基化位點[8]。GP3蛋白由一個切割的信號肽、一個高度糖基化的結構域、一個短疏水區和一個未糖基化的C末端結構域組成。病毒顆粒中GP3與GP2、GP4蛋白形成異源三聚體,并與宿主細胞CD163相互作用,而CD163是 PRRSV進入細胞的關鍵受體[9-10]。GP3蛋白也可表現為細胞分泌形式,分泌的GP3可能作為一種誘餌,分散抗體遠離病毒顆粒[11]。病毒顆粒中GP3含量較少,但抗原性較高,參與誘導中和抗體產生[12]。目前,PRRSV GP3蛋白結構和抗原特性尚不十分清楚。
本研究根據PRRSV FJ1402毒株序列擴增ORF3基因,通過原核表達系統成功制備出重組GP3蛋白,將其作為免疫原免疫BALB/c小鼠,制備了7株GP3單克隆抗體,鑒定出4個B細胞表位,為 PRRSV診斷和生物學研究奠定了基礎。
1 材料與方法
1.1 主要材料
PRRSV FJ1402毒株、PRRSV N單抗、桿狀病毒系統表達PRRSV GP3蛋白(片段為28—203 aa,表達系統為pFastBacTMDual )、SP2/0細胞、大腸桿菌E.coliDH5α和Rosetta均由本實驗室保存。雌性BALB/c小鼠(6~8 周齡)購自揚州大學實驗動物中心。
2×Phanta Max Master Mix和Pres-tained Protein Marker,購自南京諾唯贊生物科技股份有限公司;限制性核酸內切酶和T4 DNA 連接酶,購自Thermo Fisher Scientific公司;山羊抗小鼠IgG(H+L)-HRP和HRP-SPA,購自上海碧云天生物技術有限公司;HisSep Ni-NTA Agarose Resin,購自上海翊圣生物科技有限公司;RPMI-1640培養基、胎牛血清,購自美國 Gibco 公司;FITC-羊抗鼠 IgG、小鼠單克隆抗體亞型鑒定試劑盒,購自Proteintech生物科技有限公司;TanonTM High-sig ECL Western blot底物試劑盒,購自天能科技有限公司;異丙基硫代-β-D-半乳糖(IPTG)、PEG1450、50×HAT和50×HT,購自美國Sigma公司;其他試劑均為國產分析純。
1.2 重組質粒構建
根據PRRSV FJ1402(GenBank No.KX169 191.1) ORF3基因序列,采用TMHMM Serverv.2.0 網站軟件分析GP3蛋白跨膜區為16~38位氨基酸(aa),刪除1~38 aa后的目的片段命名為 tGP3 (39~254 aa)。引物為 28a-tGP3-F:5′-CGGGATCCGTTAGGGGCAACTTCTCTTT-3′,28a-tGP3-R:5′-CCCTCGAGTTGCCGCGCGACATTGAGGA-3′,用于擴增 tGP3 片段,大小為 648 bp。PCR 反應條件:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 15 s,72 ℃ 60 s,循環35 次;72 ℃ 5 min。將目的片段和 pET-28a 載體通過BamHⅠ和XholⅠ雙酶切后進行連接,連接產物轉化至DH5α菌,經菌液PCR 和酶切鑒定正確后送通用生物公司測序,結果顯示正確,重組質粒pET-28a-tGP3于-20 ℃ 保存備用。
為了解析GP3蛋白抗原表位,根據 PRRSV FJ1402 ORF3基因序列設計一系列截短體引物并在引物的5′端引入EcoRⅠ酶切位點,3′端引入HindⅢ酶切位點,引物序列如表所示(表1),送南京金斯瑞公司合成。以重組質粒 pET-28a-tGP3為模板,采用PCR方法分別擴增出9個GP3蛋白基因截短體,將截短體和pET-32a載體雙酶切后進行連接,構建9 個GP3蛋白截短體重組質粒。

表1 GP3蛋白截短體 PCR 引物序列
1.3 重組蛋白誘導表達及純化
將重組質粒pET-28a-tGP3轉化Rosetta感受態細胞,挑取單菌落,37 ℃培養,測定菌液 OD600 nm為0.6~0.8時加入終濃度為1 mmol·L-1的IPTG,繼續培養6 h。收集菌體超聲破碎,分離上清和沉淀,SDS-PAGE 鑒定蛋白表達形式,采用鎳柱親和層析法純化目的蛋白,純化GP3蛋白用超濾管進行濃縮后測定蛋白濃度,Western blot 試驗鑒定GP3蛋白與PRRSV 陽性豬血清的反應性。
1.4 PRRSV GP3 蛋白單克隆抗體的制備
1.4.1 小鼠免疫 按照文獻報道[13],將重組GP3蛋白與等體積ISA206佐劑混合,充分乳化后皮下注射小鼠,60 μg·只-1,ELISA抗體效價≥1∶10 000時,通過腹腔注射50 μg重組GP3蛋白進行沖擊免疫。3 d后采集脾,進行細胞融合。
1.4.2 單克隆抗體制備 按照文獻報道[13-14],取沖擊免疫小鼠脾細胞和SP2/0細胞按照7∶1比例混合,加入 PEG1450進行融合。將融合細胞鋪于含有2% HAT選擇培養基的96孔細胞板中,培養6 d左右全換液,間隔24~36 h 取雜交瘤細胞上清,用間接 ELISA 進行檢測。篩選到的陽性雜交瘤細胞需要進行2~3次亞克隆,直至單克隆陽性率為100%。將穩定分泌抗體的雜交瘤細胞擴大培養至T25細胞瓶,凍存后于液氮中保存。
1.4.3 間接 ELISA 篩選陽性雜交瘤細胞 用重組GP3蛋白作為包被抗原,雜交瘤細胞上清作為一抗,同時設立陽性對照(免疫小鼠血清 1∶100 稀釋)和陰性對照(SP2/0 細胞上清);羊抗鼠IgG(H+L)-HRP孵育二抗;TMB顯色后加入終止液,酶標儀檢測OD450 nm時的讀數,P/N≥2.1判定為陽性。
1.4.4 腹水制備 按照文獻報道[15],取8周齡雌性 BALB/c小鼠,腹腔注射500 μL無菌液體石蠟。7 d后,腹腔注射3×106~4×106個雜交瘤細胞。7 d后觀察,小鼠腹部脹大并觸之有波動感時用頭皮針收集腹水,安樂死。收集的腹水4 000g離心10 min,取上清,分裝后,于-80 ℃保存備用。
(1)該水源地歷年變化分析得出氨氮、總磷等水質指標有逐年好轉的趨勢,但是COD存在一定的水質惡化風險。
1.5 單克隆抗體生物學特性鑒定
1.5.1 單克隆抗體細胞株的穩定性試驗 將陽性雜交瘤細胞株連續傳代,取 5、10、15代細胞上清,間接ELISA檢測抗體效價和抗體分泌穩定性。
1.5.2 單克隆抗體亞型鑒定 按照單克隆抗體亞型鑒定說明,將單抗細胞上清按照1∶200 稀釋,將待測樣品加入板條中,每孔50 μL;加入1×山羊抗小鼠 IgA+IgM+IgG-HRP,每孔50 μL,混勻;室溫孵育1 h;棄去孔內液體,PBST 洗板3次;加入顯色液,室溫避光顯色10~20 min,加入終止液,各孔的OD450 nm值最高的孔即為相應的單抗亞型。
1.5.3 單克隆抗體的特異性反應鑒定 以純化的PRRSV FJ1402、桿狀病毒系統和原核系統表達的重組GP3蛋白為抗原,同時設置相應陰性對照,進行SDS-PAGE 和Western blot。將蛋白轉印至NC膜上,雜交瘤細胞上清作為一抗,羊抗鼠IgG(H+L)-HRP孵育二抗,加入顯色液后判定單抗特異反應性。
1.5.4 間接免疫熒光試驗反應性鑒定 PRRSV接種Marc 145細胞,37 ℃培養48 h,加入4%多聚甲醛于37 ℃固定15 min,加入0.1%Triton X-100于室溫作用25 min,PBS洗滌后加入單抗37 ℃作用1 h,洗滌后加入FITC-羊抗鼠 IgG,37 ℃作用1 h,洗滌后于熒光倒置顯微鏡下觀察。
1.6 單克隆抗體表位鑒定
1.6.1 Western blot 將GP3蛋白基因截短體重組質粒轉化至表達菌種Rosetta,IPTG 誘導表達,SDS-PAGE 后將蛋白轉印至NC膜上,以單抗腹水為一抗,采用Western blot鑒定單抗識別的抗原表位。
1.6.2 抗原表位合成多肽間接ELISA 根據上述鑒定的抗原表位,合成多肽,以50 μg·mL-1劑量包被酶標板,加入GP3蛋白單克隆抗體,以豬抗PRRSV血清抗體(G2#)和PBS分別作為陽性和陰性對照,37 ℃作用1 h后,加入HRP-SPA,37 ℃作用1 h。TMB顯色后加入終止液,酶標儀檢測OD450 nm,P/N≥2.1判定為陽性。
1.7 GP3 單抗抗原表位氨基酸位點對比分析
選取17株不同譜系的PRRSV-2中國流行毒株及參考毒株序列(BB0907、SY0608、HUN4、JXA1、WUH4、GD1404、CH-1a、IngelvacATP、QYYZ、GM2、VR2332、BJ-4、S1、MN184C、NADC31、NADC30、FJ1402),利用Jalview軟件對比分析4種抗原表位序列在各毒株中的保守性。
1.8 GP3 單抗與不同毒株反應性
選取針對不同抗原表位的單克隆抗體,采用IFA和Western blot測定其與高致病性PRRSV毒株BB0907和經典PRRSV毒株S1的特異反應性。
2 結 果
2.1 GP3 蛋白基因表達與重組蛋白的制備

A.重組蛋白表達;B.包涵體純化;C.Western blot鑒定。M.蛋白質相對分子質量標準;1.誘導表達全菌;2.誘導表達上清;3.誘導表達沉淀;4.未誘導表達全菌;5.空載體誘導全菌;6.純化的重組 GP3 蛋白
2.2 單克隆抗體制備及效價測定
小鼠三免后10 d,間接ELISA測定抗體效價均≥1∶10 000。取效價最高的小鼠沖擊免疫,3 d后取脾進行細胞融合,通過間接 ELISA 篩選陽性雜交瘤細胞并進行亞克隆,最終獲得7株分泌 PRRSV GP3 蛋白抗體的雜交瘤細胞,分別命名為2E12、4H9、5B2、6B3、6G7、9F3 和 9H5。雜交瘤細胞連續傳代至15代,每隔5代取細胞上清檢測抗體效價,結果顯示效價基本穩定。用7株雜交瘤細胞分別制備小鼠腹水并測定其效價,結果如表2所示,7株腹水單抗(mAbs)ELISA效價為1∶(64 000~2 048 000)。

表2 雜交瘤細胞上清和小鼠腹水抗體效價的測定
2.3 單克隆抗體亞型鑒定
2E12、5B2單抗的重鏈屬于IgG2a亞類,4H9、6B3、6G7、9F3 和 9H5單抗的重鏈屬于 IgG2b 亞類,7株單抗的輕鏈類型均為 Kappa 型(表3)。

表3 單克隆抗體亞型鑒定(OD450 nm)
2.4 單克隆抗體Western blot特異性鑒定
7 株mAbs均能和PRRSV FJ1402、桿狀病毒系統和原核系統表達的重組GP3蛋白發生特異性反應,不與 Marc 145 細胞、sf9 細胞和 pET-28a空載體發生反應(圖2)。

A.2E12;B.4H9;C.5B2;D.6B3;E.6G7;F.9F3;G.9H5;M.蛋白質相對分子質量標準;1.純化的PRRSV;2.Marc-145細胞對照;3.桿狀系統表達 GP3 蛋白;4.sf9細胞對照;5.重組GP3蛋白;6.空載誘導全菌蛋白
2.5 單克隆抗體IFA特異性鑒定
圖3結果顯示,7 株mAbs均能和PRRSV FJ1402株感染的Marc 145細胞發生特異性的熒光,其中5B2和9H5熒光較強;6B3和9F3熒光較弱。

A.2E12;B.4H9;C.5B2;D.6B3;E.6G7;F.9F3;G.9H5;H.PRRSV N單抗;I.SP2/0上清
2.6 單克隆抗體的表位鑒定
本試驗構建了一系列GP3蛋白截短體(圖4A),Western blot結果顯示(圖4B),9個GP3蛋白基因截短體重組質粒原核表達蛋白均與His鼠單抗反應,說明重組質粒表達正確。7株單抗中,4H9、5B2、6G7、9H5識別55PLCPTRQAAAEILE68;9F3識別69PGKSFWCRI77;6B3識別78GHDRCSESDH87;2E12識別88DELGFMVPPGLSS100。

A.GP3 蛋白截短體;B.單抗識別區域
抗原表位合成多肽ELISA鑒定結果見表4,除9F3外,6株單克隆抗體識別的抗原表位多肽與Western blot結果一致,同時豬抗PRRSV血清抗體(G2#)和55-68 aa、78-87 aa和88-100 aa多肽反應為陽性。

表4 單克隆抗體表位ELISA鑒定
2.7 GP3蛋白抗原表位氨基酸位點對比分析
采用Jalview軟件對比分析PRRSV-2四個主要流行譜系(Lineage)毒株GP3蛋白氨基酸序列,結果見圖5,55PLCPTRQAAAEILE68和78GHDRCSESDH87保守性較差;而69PGKSFWCRI77在Lineage 5內具有較好的保守性;88DELGFMVPPGLSS100在Lineage 3和Lineage 5之間具有較好的保守性。
2.8 GP3蛋白與不同基因亞型PRRSV的反應性鑒定
采用針對4個不同抗原表位的單抗4H9、9F3、6B3和2E12,IFA和Western blot結果如圖6和7所示,2E12與FJ1402、BB0907、S1毒株反應。4H9、9F3和6B3與FJ1402毒株反應,但不和BB0907、S1毒株反應。
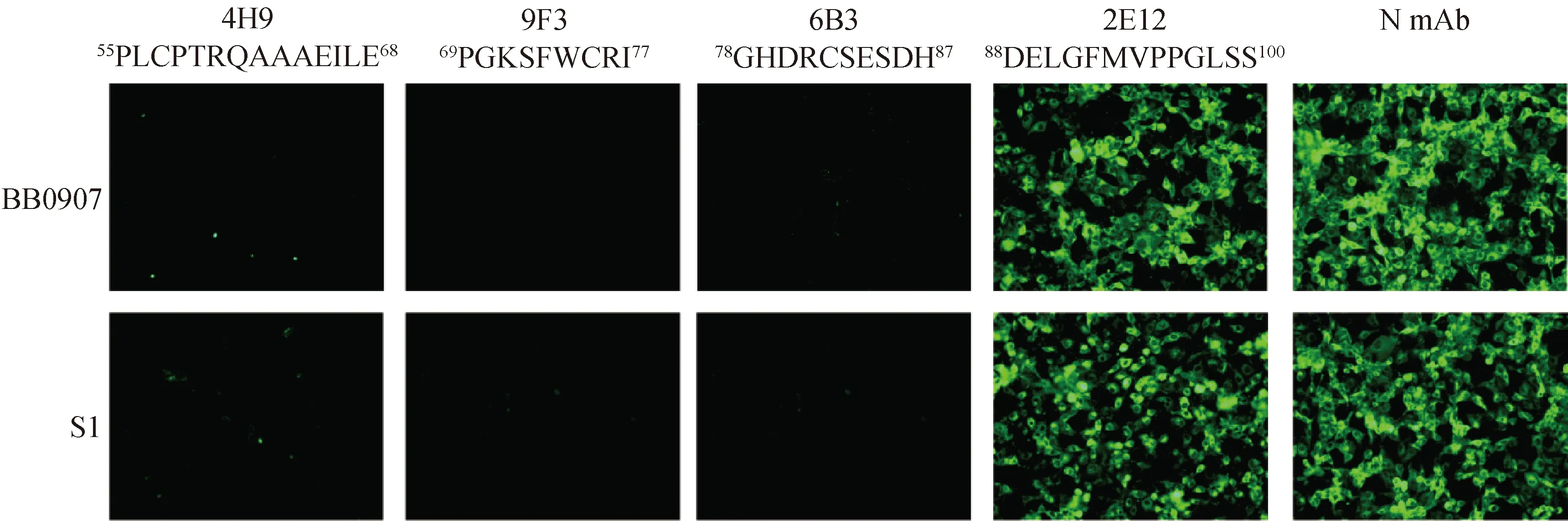
圖6 GP3蛋白單克隆抗體與不同亞型PRRSV的IFA反應特性鑒定 (200×)

A.4H9;B.9F3;C.6B3;D.2E12。M.蛋白質相對分子質量標準;1.FJ1402;2.BB0907;3.S1;4.Marc-145細胞對照
3 討 論
PRRSV存在基因變異和免疫抑制,商品化疫苗免疫保護效力有限[16-18]。研究PRRSV蛋白抗原特性對安全高效疫苗研究具有重要意義。PRRSV-1和PRRSV-2 GP3蛋白氨基酸序列相似性為 54%~60%,PRRSV-2不同基因譜系毒株 GP3蛋白基因保守性較差,可變區域主要位于蛋白N端[19]。本研究采用原核表達系統制備獲得GP3重組蛋白,研制出7 株 GP3蛋白單抗,其中2E12單抗與 FJ1402、BB0907和S1毒株存在IFA和Western blot反應特性,4H9、9F3和6B3只與FJ1402毒株反應,而不與BB0907和S1毒株反應,5B2和 6G7與FJ1402毒株感染細胞IFA熒光效果最佳,為PRRSV不同譜系毒株鑒別和GP3蛋白功能研究提供了有用工具。
PRRSV病毒粒子GP3蛋白含量低于 GP5、M 和N 蛋白,但具有較好免疫原性[20]。PRRSV GP3、M和N 蛋白免疫原性水平最高,且 GP3 蛋白與中和抗體產生有關[21]。GP3蛋白有7個糖基化位點,預測蛋白大小27~29 ku,明顯小于SDS-PAGE電泳顯示的蛋白大小(41~50 ku)[8]。本研究Western blot 結果顯示,7 株單抗與PRRSV感染細胞之間除了在40 ku左右有明顯反應條帶外,在其它位置存在數條反應條帶,這可能與GP3 蛋白糖基化有關。此外,由于桿狀病毒系統表達的GP3蛋白為第28―203 aa截短體,Western blot結果顯示該重組蛋白反應條帶分子量明顯小于原核系統表達的重組GP3及PRRSV抗原。
病毒蛋白抗原表位解析對明確蛋白結構和抗原特性有重要作用。Wang等[22]基于肽芯片技術鑒定出PRRSV GP3蛋白抗原活性區域之一位于其N端51-106 aa。張陽等[23]通過GP3 蛋白重疊多肽合成,篩選出兩個B細胞表位55PLCPTRQAAAEILEPGKS72和82CSENDHDELGFMVPPGLS99。Liang等[24]將GP3蛋白免疫顯性肽段55PLCPTRQAAAEILEPGKS72與BSA 偶聯制備免疫原,制備出GP3蛋白單抗1E5,證明其可與PRRSV高致病毒株反應,而與經典毒株和類NADC30毒株不能反應。Chen等[25]通過36株PRRSV-2分離株序列比對,發現GP3抗原表位87HDELGFMV94保守性良好,而59TRQAAAEILE68表位區域在其它低毒力毒株之間至少存在1個氨基酸差異。此外,也有報道GP3蛋白不同抗原表位存在部分重疊,如抗原表位59TRQAAAEILE68與兩個表位61QAARQRLEPGRN72和67YEPGRSLW74重疊[25]。Wang等[26]利用單克隆抗體鑒定出GP3蛋白的B細胞線性表位69PGKSFWCR76,但該表位不能被陽性血清識別,提示該表位不能在豬體內誘導抗體。本研究通過GP3蛋白基因截短體構建表達,采用研制的單克隆抗體,鑒定出4個B細胞線性表位,分別為55PLCPTRQAAAEILE68、69PGKSFWCRI77、78GHDRCSESDH87和88DELGFMVPPGLSS100,與文獻報道類似,但4個表位存在連續性,這可能與蛋白基因截短體構策略有關,這些抗原表位可能還需要更加精準定位。本研究抗原表位合成肽ELISA結果顯示,5B2、6G7、6B3和2E12的檢測結果均接近于臨界值,9F3的檢測結果為陰性,這可能與單抗結合能力和稀釋度、合成肽抗原性和包被濃度及抗原表位免疫原性弱等因素有關。本研究采用針對4個不同抗原表位的單抗4H9、9F3、6B3和2E12,采用IFA和Western blot檢測其與PRRSV 3個譜系毒株反應特性,結果均顯示,2E12與FJ1402、BB0907和S1三個譜系毒株均可發生特異反應,4H9、9F3和6B3只與FJ1402毒株反應,而不與BB0907和S1毒株反應,與這三個譜系毒株88-100 aa、55-68 aa、69-77 aa和78-87 aa抗原表位氨基酸比對分析結果一致,但值得注意的是,9F3單抗識別的69-77 aa抗原表位在FJ1402和BB0907毒株之間沒有差異,但是9F3單抗IFA和Western blot不能檢出PRRSV BB0907和S1毒株感染細胞,提示PRRSV BB0907和S1毒株感染細胞GP3蛋白存在方式與PRRSV FJ1402的存在差異,需要進一步研究證實。
4 結 論
本研究研制出7株PRRSV FJ1402毒株GP3單克隆抗體,鑒定出GP3蛋白4個抗原表位,分別位于55PLCPTRQAAAEILE68、69PGKSFWCRI77、78GHDRCSESDH87和88DELGFMVPPGLSS100。2E12單抗可識別FJ1402、BB0907和S1三個譜系毒株,但4H9、9F3和6B3單抗只與FJ1402毒株反應,可用于PRRSV 檢測和GP3蛋白功能研究。

