人工晶狀體的壓縮力評價
宋婷,馮勤(通信作者),林倩鈺,郝琦,陳瓊慧
1 浙江省醫療器械檢驗研究院 (浙江杭州 310018);2 國家藥品監督管理局生物醫學光學重點實驗室 (浙江杭州 310018);3 浙江省醫療器械安全性評價研究重點實驗室(浙江杭州 310018)
超聲乳化聯合人工晶狀體植入術被廣泛應用于臨床治療各類白內障和矯正屈光不正[1]。人工晶狀體植入人眼后,主要依靠襻支撐在囊袋或睫狀溝中。當人工晶狀體壓縮至某個給定直徑時襻施加的力,稱之為壓縮力。理想的壓縮力不僅能使人工晶狀體在眼內維持穩定狀態,還能抵抗持久的囊袋收縮。壓縮力過大易使兩襻軸上囊膜產生褶皺,雖然大部分褶皺對視力無太大影響,但由于人眼上皮細胞沿著褶皺分布,部分褶皺可能轉變為線性后囊混濁[2]。壓縮力過小則易引起人工晶狀體在眼內位置的改變,造成人工晶狀體光學主體旋轉、偏心和傾斜等,尤其是對于環曲面人工晶狀體,將直接影響患者術后的視力[3]。目前行業標準并未對人工晶狀體壓縮力限值提出要求,本研究通過臨床模擬,研究溫度、材料、襻型結構對人工晶狀體壓縮力的影響,分析人工晶狀體壓縮力大小的決定因素,為制定壓縮力限值提供參考依據,以期為白內障手術醫師選擇人工晶狀體提供參考。
1 試驗裝置與方法
1.1 試驗裝置
利用溫控模塊模擬眼內房水環境,并通過模擬睫狀肌收縮擴張運動圓弧形設計的測座和精度為0.001 mN 的壓力傳感器,將人工晶狀體限位于某個處方直徑且主體可自由移動,從而得到襻產生的壓縮力數值,試驗裝置原理圖見圖1。
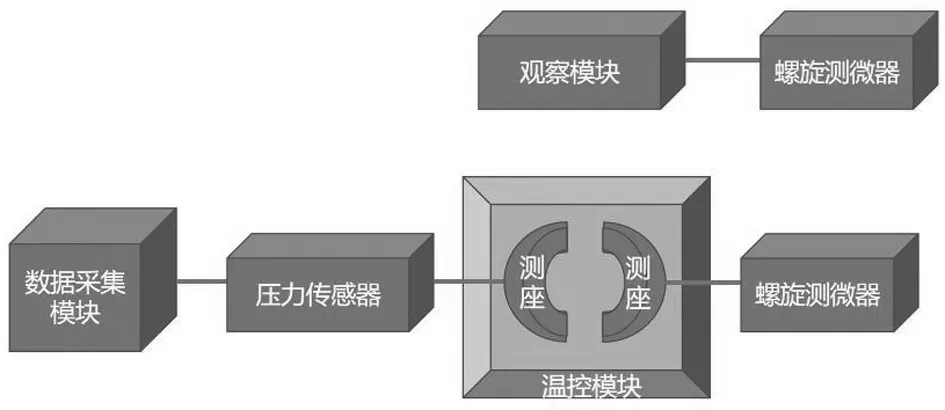
圖1 試驗裝置原理圖
1.2 試驗材料
大部分人工晶狀體由高分子材料制成,主要分為硬性材料和軟性材料。硬性材料如聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA),軟性材料如硅凝膠、水凝膠、疏水性丙烯酸酯、親水性丙烯酸酯等。與硬性材料相比,軟性材料比重低,制成的人工晶狀體更輕[4]。常見的襻型有C 型、L 型、板型、盤型、水滴形、蝶型等。
本研究主要考察目前市場上較為常見的PMMA材料和丙烯酸酯類材料制成的人工晶狀體在不同溫度及壓縮直徑下壓縮力的變化。通過分析C 型襻、L 型襻、改良C 型襻人工晶狀體(圖2)壓縮力隨壓縮直徑的變化,研究人工晶狀體的襻型對壓縮力的影響,并以L 型襻為例,分析人工晶狀體的襻型幾何結構參數與壓縮力的關聯性。
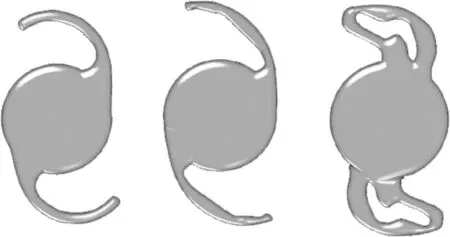
圖2 人工晶狀體襻型結構示意圖
1.3 試驗方法
參照YY 0290.3-2018《眼科光學人工晶狀體第3 部分:機械性能及測試方法》[5]中附錄A 的方法。使用壓縮力測量裝置,實驗前在溫控模塊中加入足夠的0.9%氯化鈉溶液,升溫至(35±2)℃,至少平衡30 min。通過調節與觀察模塊相鄰的螺旋測微器,將壓縮直徑調整至10 mm,并將與右側測座相連的螺旋測微器讀數清零,以此方式確定右側測座的零位。將右側測座向右移動,使人工晶狀體處于無壓縮狀態并置于兩測座上,向左緩慢移動右側測座,每隔0.1 mm 記錄數據采集模塊示數,直至零位;在零位處,通過調節溫控模塊,溫度從23 ℃升高至40 ℃,每隔1 ℃記錄1 次數據采集模塊示數。
2 結果與討論
2.1 不同材料人工晶狀體的壓縮力隨壓縮直徑變化
將總直徑為13.0 mm、不同材料的C 型襻人工晶狀體分別從無壓縮狀態壓縮至處方直徑10 mm 處,得到壓縮力變化曲線(圖3)。在處方直徑處,PMMA 材料人工晶狀體的壓縮力為1.38 mN,丙烯酸酯類材料人工晶狀體的壓縮力為0.18~0.25 mN,由這兩種材料制成的人工晶狀體產生的壓縮力,存在數量級的差異。由于PMMA 材料硬度較高,壓縮過程中具有良好的彈性,而丙烯酸酯類材料為軟性材料,壓縮過程中具有一定的柔性,因此材料種類對人工晶狀體壓縮力的影響主要取決于材料是硬性還是軟性。疏水丙烯酸酯類材料人工晶狀體壓縮力比親水性丙烯酸酯類人工晶狀體的壓縮力大0.06 mN,幾乎無明顯差異,可認為材料對人工晶狀體壓縮力的影響主要跟材料種類有關,與材料的親水、疏水性質無關。但壓縮過程中疏水性材料結構較為穩定,無明顯可見的壓縮力下軸向位移發生,而親水丙烯酸酯類人工晶狀體在壓縮過程中有明顯的遲滯現象,壓縮至12.2 mm 位置處時,由于雙側襻結構性變形,人工晶狀體產生了沿光軸方向的軸向位移,導致壓縮力的非連續性變化。

圖3 不同材料人工晶狀體壓縮力隨壓縮直徑變化的曲線
2.2 不同材料人工晶狀體壓縮力隨溫度變化
不同溫度條件下,高分子材料在實際應用中會表現出不同的熱物理特性[6]。臨床人工晶狀體植入人體后,隨著體溫的變化,不同材料人工晶狀體的壓縮力會發生不同的變化。因此本研究模擬人工晶狀體植入人眼內可能發生的溫度變化,可得到不同材料人工晶狀體壓縮力隨溫度的變化曲線,見圖4。在23~40 ℃范圍內,隨著溫度的升高,3 種材料的人工晶狀體壓縮力均有輕微減小。通過計算3 種材料人工晶狀體壓縮力數值隨溫度變化的變異系數(coefficient of variation,CV),得到PMMA 材料、親水丙烯酸酯類材料、疏水丙烯酸酯類材料的CV值分別為0.031、0.097 和0.030。從材料的變異系數可以看出,親水性材料對溫度有一定的敏感性,但根據傳統統計學方法,認為CV ≤0.1 表明研究變量屬于弱變異[7],因此,在23~40 ℃溫度范圍內,溫度變化對人工晶狀體壓縮力的影響屬于弱變異,且人體可達到的溫度遠低于高分子材料的玻璃化溫度[8-10],在玻璃化溫度內聚合物的分子結構相對穩定,因此體溫變化引起的壓縮力變化基本可忽略。
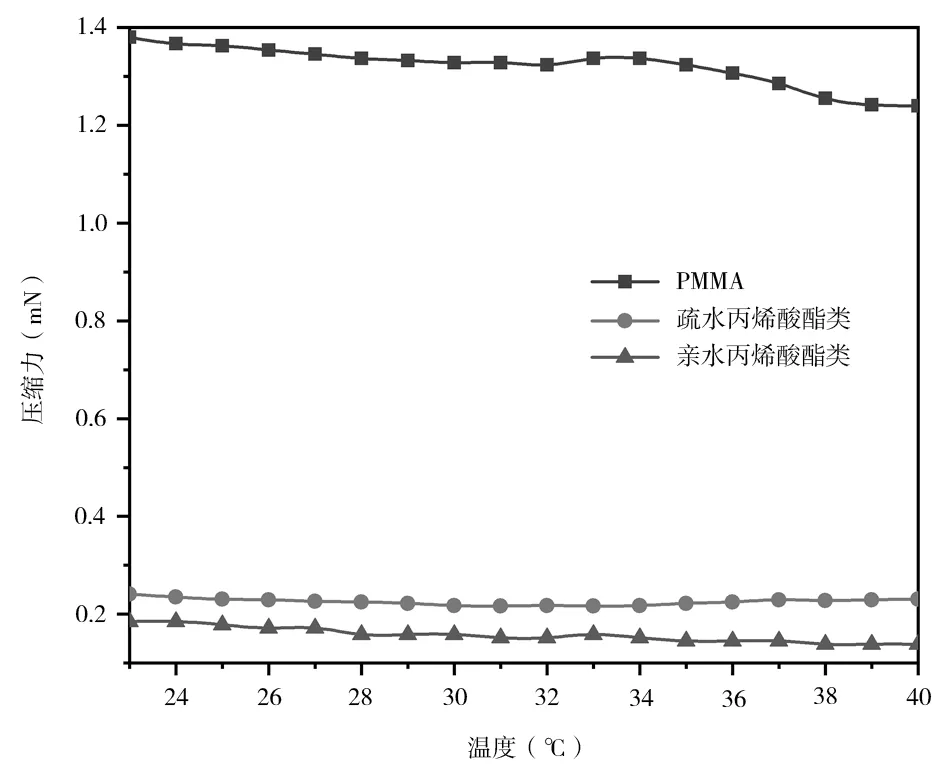
圖4 壓縮力隨溫度變化的曲線
2.3 不同襻型人工晶狀體壓縮力隨壓縮直徑變化
選擇總直徑相同的C 型襻、L 型襻、改良C 型襻親水丙烯酸酯人工晶狀體,分別將其壓縮直徑從12.5 mm 連續變化至10.0 mm,從而得到壓縮力隨壓縮直徑變化的曲線,見圖5。將3 種襻型人工晶狀體壓縮力隨壓縮直徑的變化進行線性擬合,得到3 個二元一次方程模型,其線性擬合優度R2均大于0.9,可認為線性模型的擬合程度良好。由方程的斜率可知,3 種襻型結構的人工晶狀體,隨著壓縮直徑的變化,壓縮力的變化率不同,C 型襻人工晶狀體壓縮力變化率最大為0.356,L 型襻和改良C 型襻人工晶狀體壓縮力變化率接近,分別為0.144 和0.160。
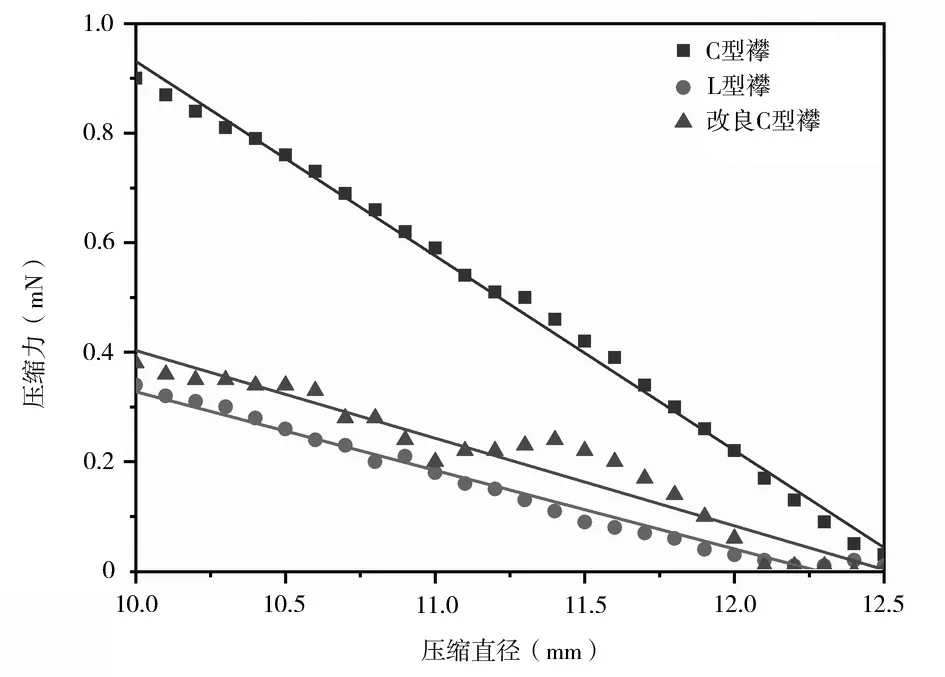
圖5 不同襻型人工晶狀體壓縮力隨壓縮直徑變化的曲線
3 種襻型人工晶狀體除了壓縮過程中的壓縮力變化率不同之外,處方直徑處的壓縮力也不同。處方直徑處C 型襻人工晶狀體壓縮力為0.9 mN左右,L 型襻和改良C 型襻人工晶狀體壓縮力為0.3 ~0.4 mN。這是因為改良C 型襻在襻的中間做了鏤空設計,當襻被壓縮時,內部中空結構會使襻的邊緣向內凹陷,分散了部分壓縮力。L 型襻在襻與人工晶狀體主體接觸處進行了拐點設計,使襻受壓縮時可通過向內折疊平衡一部分壓縮力,將力轉化為襻的機械形變,以增加人工晶狀體在囊袋內的穩定性。對襻的改良除了保證人工晶狀體在眼內位置的穩定性外,還應盡量減少壓縮力下軸向位移的產生,降低術后眼內間隙過小的風險。
2.4 襻型幾何結構與壓縮力的相關性分析
以L 型襻為例,將L 型襻幾何結構分解為以下幾個參數:襻的長度(LAB)、寬度(W)、厚度(T)、張開角(θ)、拐點曲率半徑(r)、襻與主體連接處的寬度(LCE)和長度(LCD),見圖6。通過6 個總直徑為13.0 mm、中光焦度、疏水性丙烯酸酯材料制成的L 型襻人工晶狀體模型,研究幾何結構設計參數對壓縮力的影響,運用Origin 2018 軟件分析LAB、W、T、θ、r、LCE、LCD等因素與人工晶狀體壓縮力的相關性。
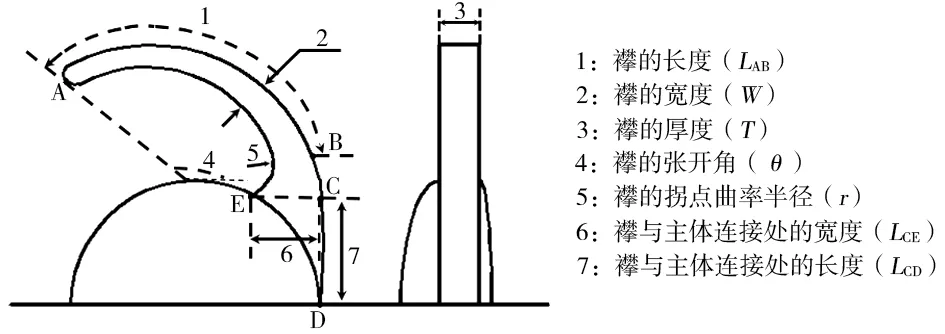
圖6 L 型襻幾何結構示意圖
實驗得到6 個不同幾何參數設計的L 型襻人工晶狀體的壓縮力為0.2~0.7 mN,分別對7 個幾何結構的設計參數進行分布擬合,各參數與壓縮力之間符合正態分布。通過軟件計算皮爾遜相關系數,得到襻幾何結構參數與壓縮力的相關系數。圖7(a)顯示人工晶狀體壓縮力與LAB、W、T、θ、r、LCD成正相關,與LCE成負相關,其中W與壓縮力的皮爾遜相關系數達到0.96,為高度相關;θ與壓縮力的皮爾遜相關系數達到0.57,為中度相關;T和LCD與壓縮力的皮爾遜相關系數大于0.3,為低度相關;LAB、r、LCE與壓縮力的皮爾遜相關系數低于0.3,幾乎不相關。
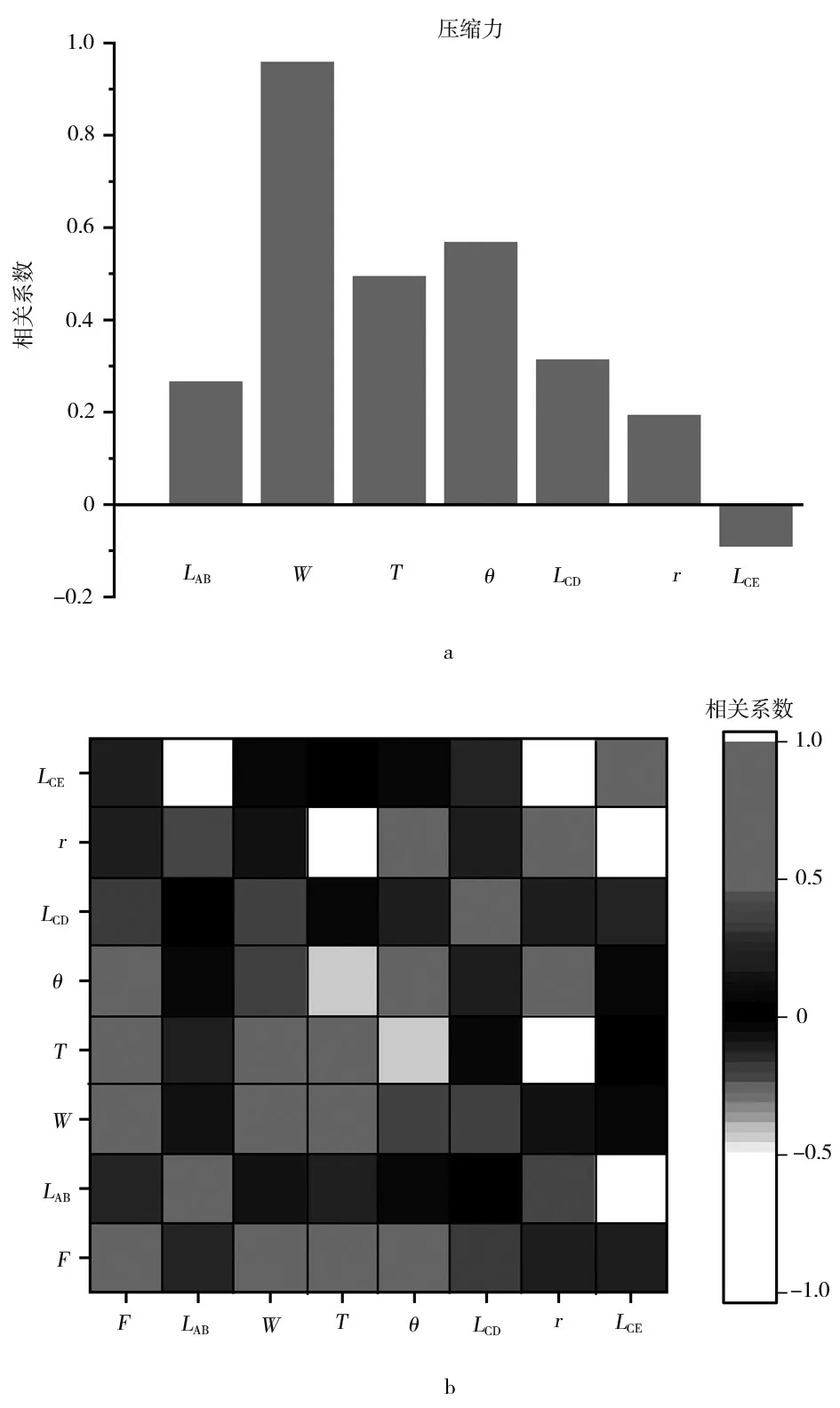
圖7 L 型襻幾何結構參數與壓縮力的相關性
圖7(b)表明,L 型襻的各個幾何結構參數之間也存在復雜的關聯,LAB主要與LCE成高度負相關;W主要與T成中度正相關;θ與r成中度正相關;r與T成中度負相關、與LCE成中度負相關。以上結果說明,襻的壓縮力與其幾何參數設計結構有關。Cabeza-Gil 等[11-12]的研究也表明,人工晶狀體襻型的幾何結構會影響人工晶狀體的機械穩定性。
3 總結
臨床人體眼內溫度變化對人工晶狀體壓縮力的影響基本可忽略,人工晶狀體的材料特性和襻型結構是導致人工晶狀體壓縮力大小差異的主要因素。相同襻型結構及壓縮直徑下,PMMA 材料人工晶狀體壓縮力遠大于丙烯酸材料,軟性親水丙烯酸酯材料制成的人工晶狀體壓縮過程中更易產生軸向位移,過大的軸向位移可能帶來一定的臨床危害。L 型和改良C 型襻設計對壓縮力的貢獻相當,相對于C 型襻可獲得更小的壓縮力。襻的幾何設計參數中,LCE、θ及T與人工晶狀體壓縮力呈現較高的相關性。
不同設計的人工晶狀體受到壓縮時穩定性的表現不同,設計初期應對人工晶狀體的材料選擇和襻型設計進行充分驗證,合理選擇人工晶狀體的材料并設計襻的結構,以確保人工晶狀體的安全性和有效性。手術醫師選擇人工晶狀體時,不僅要考慮患者的視力需求,還要考慮人工晶狀體材料和襻的結構,盡可能選擇眼內穩定性強的襻型設計,尤其是多焦和環曲面設計的人工晶狀體,避免人工晶狀體在眼內發生傾斜、旋轉和偏心,進而影響術后視覺水平。

