程序性死亡受體1 抑制劑治療晚期肺癌患者的臨床療效和安全性
李改英,李薇,蘇延軍
北京市房山區良鄉醫院腫瘤內科,北京 1024010
肺癌是全球惡性腫瘤相關死亡的主要原因之一,早期臨床癥狀無特異性,多數患者確診時病情已進展至晚期,較難通過手術根治,因此臨床多采取化療的方式延長患者的生存期[1]。一般臨床主要應用含鉑藥物對晚期肺癌患者進行化療,可在一定程度上延長患者的生存期,但不良反應較大,安全性欠佳[2-3]。隨著近年來中國醫療技術的不斷進步,免疫治療已逐漸成為晚期肺癌的重要治療手段,程序性死亡受體1(programmed cell death 1,PDCD1,也稱PD-1)抑制劑是臨床常用于治療晚期肺癌的免疫治療藥物,通過靶向PD-1 可有效增強腫瘤患者的免疫功能,進而發揮抗腫瘤效應,在腫瘤治療中具有十分重要的作用[4]。替雷利珠單抗是中國自主研發的抗PD-1 單克隆抗體,其可結晶片段經改造和優化后,與傳統PD-1 相比具有更良好的抗腫瘤活性,且其半數抑制濃度較同類藥物低,更具親和力,目前在多種惡性腫瘤的治療中均得了良好的療效[5]。基于此,本研究探討PD-1 抑制劑替雷利珠單抗治療晚期肺癌患者的臨床療效和安全性,現報道如下。
1 資料與方法
1.1 一般資料
收集2019 年1 月至2022 年1 月北京市房山區良鄉醫院收治的肺癌患者。納入標準:①符合《中華醫學會肺癌臨床診療指南(2018 版)》[6]中肺癌的診斷標準;②經病理檢查確診為肺癌;③TNM 分期為Ⅲ~Ⅳ期;④年齡為20~96 歲。排除標準:①合并其他惡性腫瘤;②合并免疫性或代謝性疾病。依據納入、排除標準,本研究共納入80 例患者,根據治療方法的不同將患者分為對照組和觀察組,每組40 例,對照組患者予以紫杉醇脂質體/培美曲塞+鉑類治療,觀察組患者在對照組的基礎上予以替雷利珠單抗治療。對照組中,男22 例,女18 例;平均年齡(68.56±4.26)歲;TNM 分期:Ⅲ期24 例,Ⅳ期16 例。觀察組中,男25 例,女15 例;平均年齡(68.12±4.36)歲;TNM 分期:Ⅲ期21 例,Ⅳ期19例。兩組患者的性別、年齡、TNM分期比較,差異均無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會審批通過,所有患者均知情同意。
1.2 治療方法
對照組患者予以紫杉醇脂質體/培美曲塞+鉑類治療。①紫杉醇脂質體+鉑類:第1 天,將135~175 mg/m2紫杉醇脂質體加入500 ml 5%葡萄糖中,靜脈滴注,3 h 內滴注完畢;第1 天,靜脈滴注卡鉑[時間曲線下面積(area under the curve,AUC)=5],21 天為1 個周期。紫杉醇脂質體用藥前30 min 給予患者靜脈注射5 mg 地塞米松、靜脈注射300 mg西咪替丁、肌內注射50 mg 苯海拉明。②培美曲塞+鉑類:第1 天,500 mg/m2培美曲塞,靜脈滴注;第1 天,75 mg/m2順鉑,靜脈滴注,21 天為1 個周期,順鉑給藥前后給予充分水化治療。治療開始前5天給予患者葉酸片,每日400 μg口服至1個周期結束;首次治療前1 周給予患者肌內注射1000 μg 維生素B12,每隔3 個周期注射1 次;另外還需要在培美曲塞給藥前1 天、給藥當天和給藥后1 天給予地塞米松4.5 mg 口服,每日2 次。
觀察組患者在對照組的基礎上予以替雷利珠單抗治療,每次200 mg,靜脈滴注,21 天為1 個周期。兩組患者均持續治療2 個周期。
1.3 觀察指標及評價標準
①臨床療效。依據實體瘤療效評價標準(response evaluation criteria in solid tumour,RECIST)[7]評估兩組患者的臨床療效。完全緩解(complete response,CR):腫瘤病灶完全消失,至少持續1 個月;部分緩解(partial response,PR):腫瘤病灶最大徑之和減少≥30%,至少持續1 個月;疾病穩定(stable disease,SD):腫瘤病灶最大徑之和減少<30%或增加<20%;疾病進展(progressive disease,PD):腫瘤病灶最大徑之和增加≥20%或出現新病灶。客觀緩解率=(CR+PR)例數/總例數×100%。②血清腫瘤標志物水平。分別在治療前和治療2 個周期后采集兩組患者空腹靜脈血6 ml,置于抗凝試管(抗凝劑:乙二胺四乙酸)中,3000 r/min 離心15 min,取上清液,置于-20 ℃冰箱中保存待用。采用電化學發光法檢測糖類抗原125(carbohydrate antigen 125,CA125)、癌胚抗原(carcinoembryonic antigen,CEA)、糖類抗原19-9(carbohydrate antigen 19-9,CA19-9)水平,試劑盒購自武漢伊萊瑞特生物科技股份有限公司,儀器選擇IMMULITE 化學發光免疫分析儀。③健康狀態。分別在治療前和治療2個周期后采用卡氏功能狀態評分判定患者的健康狀態,總分為100 分,評分越高表明患者健康狀態越好。④不良反應發生情況。記錄并比較兩組患者的不良反應發生情況,包括胃腸道反應、骨髓抑制、惡心嘔吐、肌痛、甲狀腺功能異常、腎功能異常、肝功能異常。
1.4 統計學方法
采用SPSS 22.0 軟件對數據進行統計分析,計量資料以均數±標準差(±s)表示,組間比較采用t檢驗;計數資料以例數和率(%)表示,組間比較采用χ2檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 臨床療效的比較
觀察組患者的客觀緩解率為62.50%(25/40),高于對照組患者的40.00%(16/40),差異有統計學意義(χ2=4.053,P=0.044)。(表1)
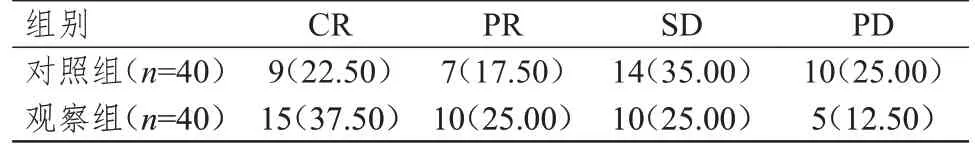
表1 兩組患者的臨床療效[n(%)]
2.2 血清腫瘤標志物水平的比較
治療前,兩組患者的CEA、CA125、CA19-9 水平比較,差異均無統計學意義(P>0.05);治療后,兩組患者的CEA、CA125、CA19-9 水平均低于本組治療前,觀察組患者的CEA、CA125、CA19-9 水平均低于對照組,差異均有統計學意義(P<0.05)。(表2)

表2 治療前后兩組患者血清腫瘤標志物水平的比較
2.3 健康狀態的比較
治療前,兩組患者的卡氏功能狀態評分比較,差異無統計學意義(P>0.05);治療后,觀察組患者的卡氏功能狀態評分明顯高于對照組,差異有統計學意義(P<0.01)。(表3)
2.4 不良反應發生情況的比較
觀察組患者的不良反應總發生率為40.00%(16/40),與對照組患者的50.00%(20/40)比較,差異無統計學意義(χ2=0.808,P=0.369)。(表4)

表4 兩組患者的不良反應發生情況[n(%)]
3 討論
肺癌患者確診時多處于晚期,出現了遠處轉移,只能通過化療延長其生存期[7-8]。紫杉醇和培美曲塞均是臨床常見的化療藥物,其中紫杉醇屬于抗微管藥物,可通過促進微管蛋白形成、抑制微管蛋白解聚,抑制腫瘤細胞有絲分裂;培美曲塞屬于抗代謝類抗腫瘤藥物,可通過破壞細胞內葉酸依賴性的正常代謝過程,抑制腫瘤細胞復制。順鉑和卡鉑均是廣泛應用于晚期惡性腫瘤的化療藥物,順鉑與卡鉑的抗腫瘤譜極為相似,均能通過損傷DNA 的方式促使腫瘤細胞凋亡。紫杉醇或培美曲塞與鉑類聯合應用均能發揮協同作用,有助于進一步增強鉑類藥物的穩定性,有效抑制腫瘤細胞生長,在穩定晚期肺癌患者病情方面效果顯著。但目前單純化療在晚期惡性腫瘤治療中可發揮的作用有限,較難延長患者的生存期,增加劑量雖然能夠在一定程度上提升療效,但不良反應也會隨之增加,對穩定病情更為不利[9-10]。近幾年,免疫治療逐漸應用于晚期惡性腫瘤,一定程度上改變了晚期肺癌的治療方式[11-12]。
將腫瘤細胞表達的程序性死亡受體配體1(programmed cell death 1 ligand 1,PDCD1LG1,也稱PD-L1)與T 細胞表面PD-1 相結合,可促使T 細胞受體(T cell receptor,TCR)信號通路磷酸化。PD-1抑制劑進入人體后,可充分阻斷PD-1 通路,進而促使T 細胞盡快恢復活性,同時還能進一步增強免疫應答,調節機體免疫力,從而達到滅活腫瘤細胞及抑制腫瘤細胞生長、轉移的目的,有助于改善患者的預后[13-14]。替雷利珠單抗屬于人源化免疫球蛋白G4(immunoglobulin G4,IgG4)抗PD-1單克隆抗體,該抗體經改造優化Fc段后較難被巨噬細胞捕獲,一定程度上降低了吞噬作用,可促使更多有活性的T細胞攻擊腫瘤細胞[15-16]。替雷利珠單抗聯合化療治療肺癌,可通過釋放抗原促使樹突狀細胞盡快成熟,增強效應T細胞功能,同時還能激活機體適應性免疫,殺滅腫瘤細胞,進而達到提高疾病緩解率的目的[17-18]。本研究結果顯示,治療后,與接受單純化療的患者相比,接受化療與PD-1抑制劑聯合治療患者的客觀緩解率和卡氏功能狀態評分均更高,血清腫瘤標志物水平更低。提示PD-1 抑制劑治療晚期肺癌患者可提高臨床療效,降低血清腫瘤標志物水平,改善健康狀態。本研究結果還顯示,兩組患者的不良反應總發生率比較,差異無統計學意義(P>0.05)。說明PD-1抑制劑治療晚期肺癌不會增加不良反應發生率,具有一定的安全性。分析主要是因為替雷利珠單抗可促使患者免疫力恢復,進而提高免疫細胞對腫瘤細胞的殺傷力,且該藥物不良反應較小,可有效保障治療的安全性[19-20]。然而,本研究為回顧性分析且樣本量較少,研究結果可能存在偏倚,且部分藥物相關不良反應可能在院外發生,數據記錄極有可能不完全。建議臨床在后續研究中加大樣本量進行前瞻性分析,并通過長期上門或電話隨訪的方式記錄患者院外不良反應發生情況,從而保障研究結果的真實性、可靠性。
綜上所述,PD-1 抑制劑治療晚期肺癌患者可提高臨床療效,降低血清腫瘤標志物水平,改善健康狀態,且安全性較好。

