生物被膜初始黏附調控機制及其在食品品質控制中的應用研究進展
熊儒恒,閻 俊,謝 晶
(上海海洋大學食品學院,農業農村部水產品貯藏保鮮質量安全風險評估實驗室(上海),上海水產品加工及貯藏工程技術研究中心,上海 201306)
細菌是影響食品品質的主要因素[1],其通過自身代謝作用,產生初級或次級代謝產物,使得食品基質發生劣變,形成揮發性有機物等有害物質,進而影響食品風味和食品安全性,導致食品安全問題的發生[2-4]。細菌在自然界中有兩種生存模式[5]:浮游態和生物被膜態,其中生物被膜態是細菌細胞在自然界中普遍且主要的存在形式。生物被膜是細菌細胞黏附于物體表面后,自身分泌胞外聚合物(extracellular polymeric substance,EPS),并將細菌細胞包裹其中而形成的菌體聚集膜狀物[6]。EPS主要包括胞外蛋白、胞外多糖、核酸、脂質等胞外大分子以及其他生物分子等[7],它能使細菌固定在物體表面并形成穩定的微生物群落,維持生物被膜結構。生物被膜的形成增強了細菌細胞的代謝能力[8]、環境耐受性[9]等,賦予了細菌復雜的代謝功能,增強了細菌的持續感染力、毒力以及耐藥性等[7,10]。
生物被膜的生命周期分為4 個階段:初始黏附、微菌落形成、生物被膜成熟和生物被膜降解[11]。初始黏附是浮游態細菌通過細菌表面元器件、EPS等作用與物體表面產生一系列理化作用并吸附到生物或非生物表面的過程[12]。細菌初始黏附分為可逆黏附和不可逆黏附兩個階段。在可逆黏附階段,浮游態細菌首先在重力、布朗運動以及自身鞭毛和菌毛[13-14]等作用下到達生物或非生物界面,在界面環境的影響下,細菌細胞表面物質逐漸發生構象變化,并在液體流速[15]、黏附介質等外界因素[16]的影響下,與界面表面分子產生分子間作用力或靜電引力等理化作用,發生可逆黏附作用。同時,細菌細胞將胞外基質的受力變化和環境變化等信號傳導到細胞內,激活細菌特異性基因的表達,如細菌外排泵基因的激活[17]等,促進細菌發生不可逆黏附作用。細菌發生不可逆黏附后,其EPS如胞外多糖等能進一步增強細菌與外界接觸表面的不可逆黏附[8,18-19],并最終使細菌完成初始黏附過程[20]。細菌經不可逆黏附過程完成初始黏附后,才能順利形成生物被膜[20]。初始黏附是細菌形成生物被膜過程中的重要階段,也是細菌能否形成生物被膜的決定性階段。
細菌初始黏附受到多種因素的影響,其中細菌細胞內的調控系統是影響其初始黏附的重要因素。環二鳥苷酸(cyclic diguanylate,c-di-GMP)、雙組分調控系統和群體感應系統是細菌細胞中常見的調控系統[21]。c-di-GMP是細菌細胞中常見的第二信使分子,其含量變化會影響細菌EPS如胞外多糖和胞外蛋白的合成和分泌,以及細菌鞭毛的遷移率,導致細菌黏附性發生變化,并最終影響細菌的初始黏附作用[19,22];雙組分調控系統是細菌細胞常見的調控系統,其能根據細菌細胞外界環境如營養物質水平等的變化,通過磷酸化等化學反應調節細菌細胞中基因的轉錄水平,并影響細菌初始黏附等生命活動[23-24];群體感應系統是細菌由于群體密度增加,在細菌細胞與細胞之間產生的一種調控系統。群體感應系統對細菌細胞的調控作用主要通過細菌分泌的群體感應信號分子實現,細菌細胞可以通過感受自身細胞或其他細菌細胞分泌的群體感應信號分子的種類和濃度,調節自身初始黏附作用和生物被膜的形成[25]。c-di-GMP、雙組分調控系統和群體感應系統等調控系統的存在能幫助細菌感知和應答外界環境信號,是影響細菌發生初始黏附作用、形成生物被膜,并最終影響食品品質和安全的重要因素。因此,研究不同調控系統對細菌初始黏附作用的調控十分有必要。
本文闡述并分析了c-di-GMP、雙組分調控系統和群體感應系統3 種調控系統(圖1)對細菌初始黏附的調控作用及其作用機制,并對從控制初始黏附角度進行食品品質控制的應用進行了總結和展望。本文可為控制細菌造成的食品品質危害提供一定的理論依據,有助于生物被膜靶向控制技術的開發,對食品產業的發展具有一定意義。
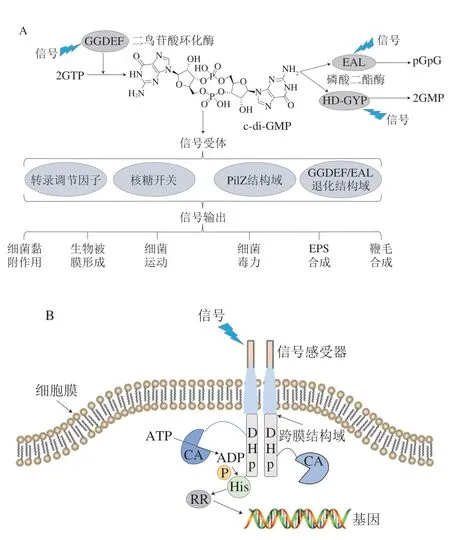
圖1 細菌調控系統Fig.1 Bacterial regulatory system
1 c-di-GMP調控系統
c-di-GMP是在1987年由Ross等[26]于木糖醋桿菌(Acetobacter xylinum)中首次發現的一種化合物。隨著研究的深入,c-di-GMP在細菌尤其是革蘭氏陰性菌中的調控作用得到越來越多的關注。c-di-GMP的合成和降解分別在二鳥苷酸環化酶(diguanylate cyclase,DGC)和磷酸二酯酶(phosphodiesterases,PDE)的催化作用下進行[27],編碼DGC和PDE的基因在細菌細胞中廣泛存在[27]。光照[28]、氧氣[29]和溫度[30]等外界環境條件可通過調控DGC和PDE編碼基因的表達來調節細菌細胞中DGC和PDE的表達水平,進而影響細菌體內c-di-GMP的含量。細菌體內c-di-GMP含量的變化對調節細菌生理代謝有十分重要的作用。一般情況下,細菌細胞內c-di-GMP含量較高時,細菌傾向于生物被膜態;當細菌細胞內c-di-GMP含量較低時,細菌傾向于浮游態[31]。
c-di-GMP調控細菌下游表型的方式分為3 種:c-di-GMP作為核糖開關,結合mRNA在核糖體上的結合位點,調節mRNA的轉錄和翻譯[32-33];c-di-GMP的受體蛋白為轉錄因子,與轉錄因子結合,調控轉錄因子對基因轉錄的調控能力,從而調控下游靶基因的表達[34-35];c-di-GMP的受體蛋白為激活/阻遏蛋白,與受體蛋白結合,通過調控靶蛋白的活性來影響細菌生命活動[36-37],其中c-di-GMP作為核糖開關調控下游表型的現象較少,目前僅在艱難梭菌(Clostridium difficile)中被發現[32-33]。通過結合轉錄因子直接調控下游細菌基因的表達,以及通過調節靶蛋白活性以調控細菌代謝等生命活動的兩種調控方式,是c-di-GMP調控細菌初始黏附和生物被膜形成的主要方式。c-di-GMP在細菌初始黏附過程中起到了不可忽視的作用。在細菌初始黏附階段,c-di-GMP先通過調節細菌元器件如鞭毛的合成、控制鞭毛轉動速度等調節細菌菌體接觸外界固體表面,并選擇性調節EPS組分如胞外蛋白和胞外多糖的合成和分泌基因的表達,促進細菌細胞黏附在外界固體表面[19,36-37]。c-di-GMP能夠調控多數EPS組分的合成和分泌,這是其調控細菌初始黏附的重要方式。
1.1 c-di-GMP對胞外多糖的影響
胞外多糖是EPS的重要組成部分,在細菌初始黏附、生物被膜的形成和成熟過程中發揮了重要作用,并能增強細菌對宿主的浸染力以及環境耐受性[5]。胞外多糖的結構、流變學和熱力學特性受到溫度和pH值等多種因素的影響[38],且不同胞外多糖的理化性質也有很大差異[38-39]。細菌能產生多種形式的胞外多糖,常見的有纖維素、聚-N-乙酰葡萄糖胺、海藻酸鹽、Psl多糖和Pel多糖等[40-41]。其中,c-di-GMP通過調控Pel和Psl多糖的合成和分泌來調控細菌初始黏附作用受到了研究人員的廣泛關注。
Pel是一種陽離子胞外多糖[42],它的合成和轉運由pelA~G操縱子編碼的蛋白質負責[43-44]。Pel多糖的合成和轉運過程如圖2A所示,PelD、PelE、PelF和PelG在細菌細胞內或內膜上形成復合物,該復合物負責Pel多糖前體的合成和轉運;Pel多糖前體在PelE的協助下經過內膜到達周質空間,再經PelA的去乙酰化修飾后形成Pel多糖;最后,Pel多糖在PelC和PelA的幫助下經過PelB穿過外膜后輸出到細菌細胞表面發揮作用[43,45]。

圖2 細菌胞外多糖合成和轉運Fig.2 Synthesis and transport of bacteria extracellular polysaccharides
c-di-GMP能通過多種方式影響細菌胞外多糖Pel的合成和轉運,進而調控細菌的初始黏附。早期的研究發現,銅綠假單胞菌(Pseudomonas aeruginosa)中存在一種結合蛋白FleQ,該蛋白能抑制pel基因的表達,影響細菌的初始黏附。當細菌中c-di-GMP水平升高時,c-di-GMP與FleQ結合,并解除后者對pelA基因轉錄的抑制作用,促進Pel多糖的正常合成和分泌[46]。同時,近一步的研究表明,在c-di-GMP水平升高的情況下,細菌細胞中pelA基因的轉錄水平也相應升高,細菌黏附能力和形成生物被膜的能力也得到加強[41]。c-di-GMP對Pel多糖的直接調控體現在對Pel多糖合成基因pelD轉錄產物的調控上。研究人員發現,在銅綠假單胞菌(P.aeruginosa)的Pel多糖合成基因中,pelD基因能直接接受c-di-GMP的調控,作為c-di-GMP的效應蛋白,pelD轉錄蛋白上含有環狀核苷酸受體和GGDEF結構組成的雙結構域,這個結構有助于pelD轉錄蛋白和c-di-GMP結合形成復合物,該復合物能有效促進Pel多糖的合成和分泌,并促進細菌的初始黏附[47-48]。c-di-GMP對Pel多糖的影響通過多種形式進行,這也是c-di-GMP通過影響Pel合成和分泌,進而調控細菌初始黏附,從而應對復雜多變的外部環境的一種有效形式。
與Pel不同的是,Psl是一種中性的細菌胞外多糖[49]。Psl的合成和轉運由Psl胞外多糖生物合成系統負責[50],該系統是一個包含12 個基因(pslA~L)的psl操縱子,Psl胞外多糖的合成和轉運如圖2B所示,dTDP-鼠李糖等Psl多糖合成原料經PslB作用后,通過PslI、PslH、PslF和PslC等轉移糖基形成Psl多糖單元,其由內膜蛋白PslA提供結合位點,在結合位點的幫助下,Psl多糖單元被組裝到細胞質的類異戊二烯脂質上,然后在PslJ、PslK和PslL等內膜蛋白的作用下經過聚合作用形成Psl多糖,并在PslE協助下穿過細胞內膜,隨后在PslG的幫助下穿過周質空間,并經PslD轉運到細胞膜外[50]。Psl有助于增強細菌黏附作用,促進細菌附著于宿主細胞表面[51-52]。此外,Psl能夠通過增強細胞黏附作用增加細菌毒性,對菌株有一定的保護作用[53]。
c-di-GMP通過影響Psl多糖的編碼基因來影響Psl合成和轉運。研究表明,當細菌細胞中c-di-GMP水平升高時,細菌中pslA基因的轉錄水平也相應升高,從而增強了細菌的初始黏附和抗藥性等作用[41,54]。研究人員在對銅綠假單胞菌(P.aeruginosa)的研究中發現,當鳥苷酸環化酶SadC在細菌中過表達時,銅綠假單胞菌(P.aeruginosa)細胞外Psl的產量顯著增加,這一促進作用可能與SadC結構中的跨膜結構域有關,其雖然不會影響c-di-GMP的合成,但卻對Psl的形成和分泌有調控作用[55]。此外,Psl可誘導DGC如SiaD和SadC的合成,提高細菌細胞內c-di-GMP的水平,實現正反饋調節[56]。目前,關于c-di-GMP調控Psl合成和分泌的研究還比較少,c-di-GMP調控Psl操縱子的作用還需要進一步研究。
1.2 c-di-GMP對胞外蛋白的影響
胞外蛋白作為生物被膜的主要成分之一,在細菌初始黏附和生物被膜形成過程中也起到重要的作用。黏附蛋白是細菌胞外蛋白的組分之一,c-di-GMP不僅影響細菌胞外多糖的合成和分泌,也能調控細菌黏附蛋白的合成,并通過影響胞外蛋白的黏附作用調控細菌的初始黏附[57]。目前,研究人員已在不同的菌種中發現多種黏附蛋白[58-59],其中,c-di-GMP調控BpfA和LapA蛋白并影響細菌初始黏附的作用機理是研究人員關注的熱點。
BpfA 蛋白最初是在奧奈達希瓦氏菌M R-1(Shewanella oneidensisMR-1)中發現的,該蛋白的分子質量為285 kDa,是一種非常大的蛋白,并由bpfa基因(SO4317)編碼,通過I型蛋白質分泌系統(the type I secretion system,TISS)分泌,它是細菌進行初始黏附和維持成熟生物被膜結構所必需的[60]。細菌細胞內c-di-GMP水平的變化會影響細菌BpfA蛋白的含量。Cheng Yuanyuan等[61]通過研究發現,腐敗希瓦氏菌CN32(Shewanella putrefaciensCN32)中存在一種轉錄調解因子FlrA,其能阻遏BpfA蛋白操縱子的表達,進而影響BpfA蛋白的合成和分泌;當細菌細胞中c-di-GMP水平升高時,c-di-GMP可以與輔助蛋白FlhG結合,解除FlrA對BpfA操縱子的抑制,從而使bpfa基因得到正常表達。同時,研究證實,BpfA的合成和分泌受BpfD和BpfG兩種蛋白質的調控[62]。通過進一步的研究發現,c-di-GMP可根據其在細菌細胞內的含量變化,調控BpfA在細菌細胞表面的含量(圖3A)。當細菌細胞內c-di-GMP水平較高時(圖3A中a),c-di-GMP可以激活c-di-GMP結合蛋白BpfD并形成復合物,該復合物能結合周質蛋白酶BpfG,從而阻止BpfG水解BpfA蛋白,幫助細菌完成初始黏附并形成生物被膜。但當細胞內c-di-GMP水平較低時(圖3A中b),BpfG的抑制作用被解除,BpfA在BpfG的水解作用下從細胞表面釋放,細菌的黏附作用被大幅降低。而在環磷酸腺苷(cyclic adenosine monophosphate,cAMP)存在的情況下(圖3A中c),低濃度的c-di-GMP可以和cAMP以及cAMP受體蛋白(cAMP receptor protein,CRP)相互作用,協同維持BpfD和BpfG之間的相互作用,防止BpfA蛋白被BpfG水解;只有當細菌細胞內c-di-GMP水平低到一定程度,不足以和cAMP發揮協同作用時(圖3A中d),BpfG蛋白才會發揮正常作用[63]。c-di-GMP能在不同水平上通過調控BpfA蛋白影響細菌初始黏附和生物被膜形成等,這也是c-di-GMP通過影響細菌胞外蛋白從而調控細菌初始黏附的一種重要手段。

圖3 c-di-GMP對胞外蛋白BpfA和LapA的調控模式Fig.3 Regulatory patterns of c-di-GMP on extracellular proteins BpfA and LapA
LapA蛋白是一種在銅綠假單胞菌(P.aeruginosa)中發現的黏附蛋白,其也可以通過TISS分泌到細胞表面并發揮黏附作用[64]。與BpfA相比,c-di-GMP對LapA蛋白的調控機理較為簡單(圖3B)。LapA的分泌受到LapE、LapD和LapG等蛋白的調控。LapE是細胞外膜孔徑蛋白,LapA蛋白的N-端部分可與外膜孔蛋白LapE錨定,并被束縛在細胞周質區域內,使LapA蛋白其余部分固定在細胞外側,發揮黏附作用。LapD是一種c-di-GMP受體,當細菌細胞內c-di-GMP含量較高時(圖3B中a),LapD可以與c-di-GMP結合形成復合物,該復合物能與周質蛋白酶LapG相互作用,阻止LapG切割LapA的N-端區域,使LapA可留在細胞表面,增強細菌細胞的黏附作用;當細菌細胞內c-di-GMP含量較低時(圖3B中b),LapD與c-di-GMP無法形成復合物,周質蛋白酶LapG可以順利切割黏附蛋白LapA的N-端區域,并將LapA從膜孔徑蛋白LapE中釋放,削弱細菌細胞的初始黏附作用[65]。細菌細胞內c-di-GMP的水平并不直接影響LapA的合成和分泌,但是能通過調控LapD蛋白與周質蛋白酶LapG的結合作用,影響LapG對LapA的水解,進而影響細菌細胞外膜表面LapA的含量,這也是c-di-GMP調控細菌初始黏附作用的一種有效方式。
除此之外,c-di-GMP還可以通過調節細菌鞭毛結合蛋白與鞭毛組分的相互作用[66]以及鞭毛蛋白的合成等作用[67],影響細菌初始黏附。c-di-GMP與細菌菌毛蛋白和菌毛運動之間的相互作用也對細菌初始黏附有很大的影響[68-69]。細菌多種生命活動都需要c-di-GMP參與,c-di-GMP對細菌初始黏附作用的調控已經得到了廣泛研究,但其作用機制還需要進行深入的探討。
2 雙組分調控系統
雙組分調控系統是細菌細胞中一種常見的調控系統(圖1B),該系統主要由組氨酸激酶(histine kinase,HK)和應答調節蛋白(response regulator,RR)組成,并通過磷酸化作用進行信號轉導[70-71]。雙組分調控系統是細菌感知外界環境并調控細胞生理活動的重要方式之一[72-74]。一般情況下,細菌HK蛋白的胞外感受器會在外界信號的作用下,通過跨膜區和連接區將信號轉移到胞內的二聚和組氨酸磷酸轉移(dimerization and histidine phosphotransfer,DHp)區域,并使DHp區域發生螺旋翻轉,同時連接在該區域上的ATP結合區會結合ATP,并將其分解為ADP,轉移一分子磷酸基團到DHp區域上的保守組氨酸殘基,使HK蛋白自磷酸化。自磷酸化的HK進一步將磷酸基團轉移到下游RR的保守天冬氨酸殘基上,該殘基可以接收由HK傳遞的磷酸基團并被磷酸化。磷酸化的RR發生構象轉變,變為激活狀態,與細菌的基因相結合,從而調控細菌相關基因的表達以實現對外界信號刺激的應答[75-76]。
細菌細胞能通過雙組分調控系統對環境信號如營養[77]、氧氣濃度[78]、滲透壓[79]等做出響應,并調節自身活動以適應環境變化。不同的雙組分調控系統能響應的外界信號類型不同,且細菌同一種生命活動受多種雙組分調控系統影響。雙組分調控系統對細菌生物被膜的調控已得到廣泛關注[80-81],研究顯示,僅在銅綠假單胞菌(P.aeruginosa)中就已發現SagS[82]、BfiS/BfiR[83]和MifS/MifR[84]等多種調控細菌初始黏附和生物被膜形成的雙組分調控系統,其會對細菌初始黏附產生很大的影響。
ArlS/ArlR是較為典型的雙組分調控系統,該系統于2000年在金黃色葡萄球菌(Staphylococcus aureus)中發現[85],arls基因的轉錄產物ArlS蛋白與組氨酸蛋白激酶有很強的功能相似性,這使得科研人員進一步發現了ArlS/ArlR類型的雙組分調控系統,研究證實,雙組分調控系統ArlS/ArlR可以通過影響細菌分泌的肽聚糖水解酶活性來控制細菌對聚合物表面的附著[86]。這是早期較為成熟的關于雙組分調控系統影響細菌初始黏附作用的報道。進一步的研究發現,ArlS/ArlR系統還可以通過影響下游效應蛋白MgrA的活動來控調控金黃色葡萄球菌(S.aureus)在宿主細胞或活體組織表面的初始黏附[87]。比較特殊的是,ArlRS-MgrA系統并不是通過直接調控細菌黏附相關因子來調控細菌初始黏附作用的。細菌EPS中其他大分子表面蛋白會對黏附蛋白的黏附行為產生干擾作用,ArlRS-MgrA能通過解除這種干擾作用來增強黏附蛋白的黏附作用(圖4)。細菌通過功能性ArlRS-MgrA的級聯作用抑制大分子表面蛋白如Ebh、SraP、SasG等的活性,并增強細菌黏附因子與配體的結合,從而增強細菌初始黏附作用(圖4A)。當ArlRS-MgrA級聯作用失活時,Ebh、SraP和SasG會出現在細菌細胞表面并阻止相鄰的黏附因子與其配體結合,從而大幅抑制細菌的初始黏附作用(圖4B)。需要注意的是,ArlS/ArlR系統通過解除細菌初始黏附的抑制作用,間接增強細菌的初始黏附作用,這為研究特異性的細菌調控系統調控細菌初始黏附作用提供了新的思路。
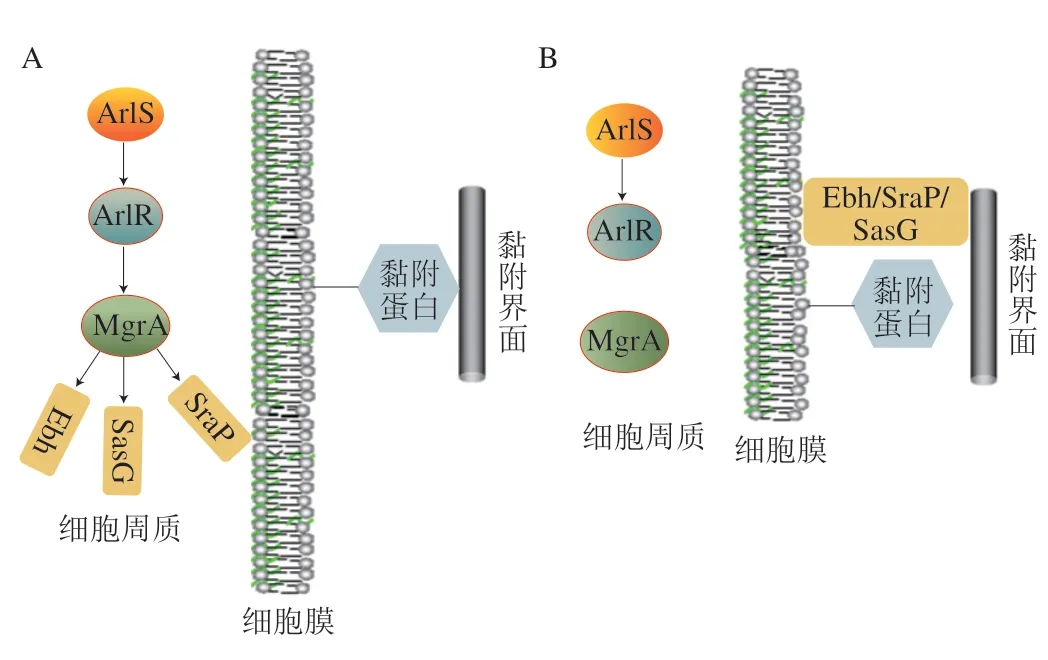
圖4 ArlS/ArlR雙組分調控系統Fig.4 Two-component system ArlS/ArlR
雙組分調控系統可以單獨調控細菌多種生命活動,也可以與其他生物大分子共同發揮調控作用。SagS是在銅綠假單胞菌(P.aeruginosa)中發現的一種雜合HK[88]。與普通雙組分調控系統不同的是,SagS不僅具有HK的保守蛋白結構,還能編碼類似反應調節蛋白的結構。研究表明,SagS可以和銅綠假單胞菌(P.aeruginosa)中的調控系統Gac/Rsm以及雙組分調控系統BfisR相互作用,共同調控細菌的初始黏附以及生物被膜的發育和成熟[89]。此外,SagS與第二信使c-di-GMP的級聯效應也是銅綠假單胞菌(P.aeruginosa)調節初始黏附作用的一種重要方式。研究發現,當細菌培養環境中6-磷酸葡萄糖的水平上升時,細菌泳動性降低,且其細胞內c-di-GMP含量上升,細菌初始黏附作用增強,6-磷酸葡萄糖并不直接促進DGC合成c-di-GMP,而是通過SagS的作用促進c-di-GMP水平上升,當細菌細胞內6-磷酸葡萄糖水平上升時,SagS可被激活并與DGC NicD結合形成復合物,該復合物可促進c-di-GMP的合成,提高細菌細胞內c-di-GMP的水平,進而增強細菌的初始黏附作用[82]。與其他雙組分調控系統不同的是,SagS系統并不是根據外部信號直接調控細菌的初始黏附,而是作為中轉信號調控細菌c-di-GMP,由c-di-GMP含量的變化調節細菌初始黏附等生命活動。這種調控方式與普通的雙組分調控系統和c-di-GMP調控系統相比更為復雜,涉及到細菌細胞內更多的生命活動,但也拓寬了不同調控系統的調控范圍,增加了各系統調控功能間的關聯性,有利于細菌適應不同的外部環境。
雙組分調控系統可以同時調控包括細菌初始黏附在內的多種生命活動,如在單核細胞增生李斯特菌(以下簡稱單增李斯特菌)中,LisRK雙組分調控系統可以同時調控細菌的抗生素抗性和初始黏附作用,在無LisRK系統的調控下,單增李斯特菌的抗藥性大幅降低,同時,細菌初始黏附作用也較野生菌株有所減弱[90]。雙組分調控系統的存在使得細菌應對復雜多變外界環境的能力大幅提高。與其他調控系統相比,雙組分調控系統調控方式多樣,調控行為復雜,且與其他調控系統有不同程度的相互作用,目前的研究還未能完全闡明雙組分調控系統的具體調控路徑,且該系統與其他生物大分子和調控系統的相互作用也需要進一步研究。
3 群體感應系統
群體感應系統是研究人員先后在肺炎鏈球菌(Stretococcus pneumonia)和費氏弧菌(Vibrio fischeri)中發現的[91]。細菌細胞向培養環境中釋放群體感應信號分子至一定濃度時,群體感應信號分子與細胞上的受體結合,調節細菌中相關基因的表達,從而調控細菌生命活動[92-94](圖1C)。細菌群體感應信號分子主要分為3 類:革蘭氏陰性菌中的N-酰化高絲氨酸內酯類(N-acyl-L-homoserine lactones,AHLs)、革蘭氏陽性菌中的自誘導肽類(autoinducing peptides,AIPs)以及革蘭氏陰性菌和革蘭氏陽性菌之間的自誘導子-2類(autoinducer-2,AI-2)[93-95]。目前,關于AIPs調控細菌黏附作用的報道還比較少[96],AHLs[25]和AI-2[95]是細菌黏附領域初始黏附中研究較為廣泛的兩類群體感應信號分子。
3.1 AHLs對細菌初始黏附的影響
基于AHLs的群體感應系統已經取得了廣泛的研究[97],該系統主要包括AHLs信號分子、AHLs合成酶和AHLs受體3 個部分。AHLs經AHLs合成酶(LuxI)合成后,被分泌到細菌細胞外并積累;當AHLs濃度隨著細菌細胞密度的提高而增加到一定程度后,AHLs信號分子將結合并激活受體蛋白(LuxR)形成AHLs-LuxR蛋白復合體,調控目標基因轉錄,從而達到影響細菌生命活動的目的[93,98]。
以AHLs為代表的群體感應分子在濃度低時并不能直接調控細菌的初始黏附作用,當環境中的群體感應信號分子達到一定閾值后,其可作為外源性信號分子與其他細菌細胞上的受體結合并上調此類細菌細胞基因(如編碼胞外多糖和胞外蛋白等基因)的表達[98-100],增加細菌胞外多糖和胞外蛋白的含量,并增強細菌黏附作用,這是細菌應對環境變化的一種有效方式。AHLs通過上調EPS編碼基因的表達,增加EPS的含量,加快細菌黏附作用和生物被膜的形成,是調控細菌生物被膜形成的重要的方式[25,100],但是以往的研究多集中在細菌自身產生的AHLs對細菌細胞本身調控的影響方面,關于外源AHLs對細菌生物被膜和細菌初始黏附作用影響的報道還比較少。研究人員分別探究了兩種常用的AHL分子——N-己酰基-L-高絲氨酸內酯(N-hexanoyl-homoserine lactone,C6-HSL)和N-辛酰基-L-高絲氨酸內酯(N-octanoylhomoserine lactone,C8-HSL)在不同濃度下對銅綠假單胞菌(P.aeruginosa)初始黏附和其他生命活動的影響[101]。研究結果顯示,外源AHLs分子C6-HSL和C8-HSL不僅能影響細菌的運動性、代謝活性和細菌有關基因的調控水平,還能有效促進細菌生物被膜的形成,并影響細菌的初始黏附作用。在一定濃度范圍內,隨著外源AHLs信號分子濃度的增加,細菌初始黏附作用強度也得到不同程度的增強。細菌生物被膜形成的強度與細菌初始黏附作用也表現出一致性,當外源性AHLs對細菌初始黏附作用的影響降低時,細菌生物被膜形成的強度也隨之降低。外源性AHLs能通過增強細菌初始黏附作用來促進細菌生物被膜的生成,這有助于揭示外源性信號分子對細菌初始黏附作用和生物被膜形成等生命活動的影響機制,同時,對于如何理解細菌自身產生的AHLs信號分子促進細菌生物被膜形成的機理也有一定的啟示作用。
關于AHLs信號分子調控細菌初始黏附作用等生命活動機制和方式的研究目前還處于起始階段。探究外源性AHLs信號分子對細菌初始黏附作用等的影響,對于揭示外源以及細菌自身AHLs類信號分子對細菌調控的影響有十分重要的意義。
3.2 AI-2對細菌初始黏附的影響
除了AHLs,AI-2類群體感應信號分子也得到了研究人員的廣泛關注[102]。AI-2常與LuxS蛋白一同構成群體感應系統,且AI-2類群體感應信號分子的合成在luxS基因的轉錄產物LuxS蛋白的協作下完成[103],AI-2類群體感應系統已在多種細菌中被發現[104-105],同時luxS基因是一種高同源性基因,不同細菌分泌的AI-2信號分子結構相似,這使得AI-2的應用范圍更為廣泛[106]。
一般情況下,當菌體密度低、A I-2 水平低時(圖5A),LuxQ在LuxQ感應激酶的作用下發生自磷酸化作用,磷酸基團經過磷酸轉移蛋白LuxU被轉移至調節蛋白LuxO[107],LuxO-P激活細菌細胞內小分子核糖核酸(small RNAs,sRNAs)的轉錄,sRNAs和sRNAs伴侶蛋白Hfq結合,促使luxR無法正常轉錄;當菌體密度高、AI-2水平高時(圖5B),AI-2與受體蛋白LuxP結合,并通過LuxQ導致LuxO去磷酸化失去活性,使LuxR蛋白得到正常合成,調控下游基因正常轉錄[108]。

圖5 AI-2調控系統Fig.5 Regulatory system AI-2
與AHLs類似,AI-2對細菌黏附作用和生物被膜的形成也有一定的影響。研究人員評估了多種空腸彎曲桿菌的黏附和生物被膜形成能力。結果發現,實驗中所有的空腸彎曲桿菌都可以黏附到聚苯乙烯塑料表面;而不含LuxS/AI-2群體感應信號系統的菌株黏附和生物被膜形成能力與存在這種系統的細菌有明顯差別[109]。這種現象揭示了AI-2對細菌初始黏附作用可能有一定的調控作用。進一步的研究證實,當敲除luxS基因時,空腸彎曲桿菌在聚乙烯材料表面的黏附能力也隨之降低[110]。阪崎腸桿菌是一種常見的食源性致病菌,該細菌能導致嬰兒壞死性小腸結腸炎和敗血癥等多種嚴重疾病。不同類型的阪崎腸桿菌致病性和黏附/侵染能力也不同。研究人員針對兩種序列類型相同但黏附性和侵染力不同的阪崎腸桿菌進行了蛋白組學分析,并鑒定了多種表達差異的蛋白質。結果表明,強黏附/侵染菌株中LuxS蛋白的含量是弱黏附/侵染菌株的近4 倍[111]。LuxS表達量的降低或消失能導致細菌黏附力下降,這種現象在其他細菌的研究中也得到了證實[112]。越來越多的研究表明,LuxS/AI-2系統對阪崎腸桿菌的黏附/侵染能力起關鍵作用,是調節細菌初始黏附的一種重要調控系統。
AI-2信號系統和AHLs類似,對細菌初始黏附和其他生命活動等都有一定的調控作用,是研究細菌黏附作用不可忽視的調控系統。目前,關于AI-2對細菌黏附和生物被膜形成能力的研究已取得了很大的進展,AI-2對細菌初始黏附作用的報道也得到越來越多的重視。但是,AI-2對細菌初始黏附的調控作用仍有很多工作待開展,如AI-2系統對細菌初始黏附作用的調控機制,外源AI-2信號分子對細菌黏附作用和生物被膜形成的調控作用等。因此,AI-2調控細菌初始黏附作用的機理仍需進一步研究。
4 初始黏附機制在食品品質控制中的應用
細菌初始黏附是開啟細菌生物被膜形成的重要過程,該過程受到細菌體內調控系統等多種因素的影響[6,13]。利用細菌調控系統等作用調控細菌初始黏附,對抑制細菌初始黏附、消除細菌生物被膜、保障食品品質和安全有積極的影響。細菌初始黏附作用發生在生物被膜成熟之前[9],因此,在細菌處于初始黏附階段時,通過生化等方法抑制細菌的初始黏附能夠有效抑制細菌生物被膜的形成,對降低因細菌生物被膜而造成的危害有十分積極的作用。目前,根據調控系統調控細菌初始黏附的機理及通過抑制細菌初始黏附作用來控制食品品質的方法如表1所示。細菌初始黏附是一個動態的過程,細菌在不同生命活動過程中表現出的理化性質和生物學特性等較為復雜,食品工業中常規的抗菌方法如巴氏滅菌法、焙烤、蒸煮等熱加工技術雖然能直接殺滅細菌,但也會影響食品活性成分如多酚和黃酮類物質的含量、結構以及活性等[113],造成食品風味的變化,影響食品品質;乙醇和含氯殺菌劑等雖然能有效抑制細菌黏附和生物被膜的形成,但也存在殺菌劑殘留、低濃度殺菌劑增強單增李斯特菌等微生物黏附性和生物被膜形成能力等隱患[114-115]。聚二甲基硅氧烷(polydimethylsiloxane,PDMS)[116]或超疏水性材料[117-118]等特種材料和改性材料雖然能對包括食源性細菌在內的多種細菌展現出良好的抗黏附性,但其應用條件苛刻、材料成本高等缺點也不可忽視。電場[119]和磁場環境[120]等雖然也表現出了抗細菌黏附的優勢,但受電場強度和磁場方向等環境因素的影響,存在抗細菌黏附效果低、作用不穩定等問題,也限制了其在食品品質控制領域的應用。因此,如何在不影響食品品質和安全性的前提下,采用經濟有效的方法抑制細菌初始黏附,是保障食品安全和人類健康的一個重要問題。Karygianni等[121]曾提出以細菌基質為靶點來消除不同細菌中普遍存在的EPS組分,可能為抑制細菌初始黏附和生物被膜形成、控制食品品質提供潛在的思路。同時,在其他領域應用細菌調控系統控制細菌初始黏附作用和生物被膜形成,也為研究人員利用細菌初始黏附機制控制食品品質提供了參考。

表1 食品工業中細菌初始黏附的控制Table 1 Control of initial bacterial adhesion in food industry
5 結語
細菌初始黏附作用發生在細菌生物被膜形成階段的初期,是細菌形成生物被膜并造成食品工業污染和浪費,進而危害人類健康的重要因素。細菌初始黏附作用是一個復雜的動態過程,該過程發生在細菌生命周期的整個階段,且不同細菌的初始黏附作用特點也不盡相同,這就為如何高效且有針對性地抑制細菌初始黏附造成了較大困難。c-di-GMP、雙組分調控系統和群體感應系統等細菌調控系統能通過感受外界環境信號,調控包括EPS合成和分泌等多種細菌生命活動,影響細菌初始黏附作用。目前,關于c-di-GMP、雙組分調控系統和群體感應系統調控細菌初始黏附作用的研究已經獲得不同程度的進展,根據上述研究結果提出有針對性地抑制食源性細菌初始黏附作用的方法也得到了研究人員的關注。但是,不同調控系統調控細菌初始黏附作用的方式不同,且不同環境條件下每個調控系統對細菌初始黏附作用的影響也不一樣,因此,深入闡明細菌調控系統對細菌初始黏附作用的調控機制,以及多種調控系統對細菌初始黏附作用的協同調控效果,對于正確研究不同調控系統對細菌初始黏附作用的影響,以及針對性地提出抑制細菌黏附的方法有積極的作用,對進一步研究細菌初始黏附作用的影響因素和特點也有一定的指導意義。

