不同土壤水分下元素化學計量對微生物多樣性的塑造特征
陳俊芳,吳憲,劉嘯林,劉娟,楊佳絨,劉宇*
1.華東師范大學-阿爾伯塔大學生物多樣性聯合實驗室/華東師范大學生態與環境科學學院,上海 200241;2.浙江天童森林生態系統國家野外科學觀測研究站,浙江 寧波 315114;3.白浮圖鎮農林中心,山東 成武 274200
以碳(Carbon,C)、氮(Nitrogen,N)和磷(Phosphorus,P)為代表的化學元素是構成生物體的主要組成部分。生物生長實質上是對這些元素的積聚和相對比例的調節過程(Elser et al.,2010)。在高度異質化的土壤生態系統中,C、N 和P 為土壤微生物提供了基本能量和養分需求(Elser et al.,2007),元素化學計量可以影響微生物的多樣性和群落組成(Jiao et al.,2021),進而維持植物-土壤系統中元素吸收和釋放間的平衡(Makino et al.,2003)。元素的生態化學計量(ecological stoichiometry,EST)旨在解釋生物的生活方式和生態系統的結構及功能與非生物介質(水分和土壤)和生物體的C、N 和P 化學計量的關系(Sardans et al.,2012)。元素化學計量構成生物地球化學循環和食物網結構及過程的內在聯系,可謂是生態系統功能的核心(Zechmeister-Boltenstern et al.,2015)。元素化學計量的最早研究開展于水生生態系統,后來逐漸過渡到陸地生態系統(Austin et al.,2012)。盡管目前關于生態系統中的植物、凋落物及土壤的化學計量已涌現許多相關的研究,但有關驅動元素循環的土壤微生物方面的認知還相對有限。有研究發現土壤元素(C、N 和P)及其化學計量(C?N、C?P 和N?P)是陸地生態系統中有機質分解和養分循環的主要驅動力,而這些過程主要由微生物群落所介導(Finzi et al.,2011;Zechmeister-Boltenstern et al.,2015)。
土壤微生物群落是地球上數量最多樣、種類最豐富的群落,在生態系統中發揮著重要的作用,包括養分循環、初級生產和凋落物分解等(Delgado-Baquerizo et al.,2016;Van Der Heijden et al.,2008)。盡管這一龐大群體對生態系統的功能和服務十分重要,但目前關于陸地生態系統土壤微生物多樣性模式解釋的理論框架和實證數據仍有所欠缺(Bardgett et al.,2014;Delgado-baquerizo et al.,2017)。近年來,研究發現土壤元素C、N 和P 含量及其比率可以作為微生物多樣性的驅動因素(Delgado-Baquerizo et al.,2016;Jiao et al.,2021)。例如,有研究發現高P、低C 含量能促進微生物多樣性,而元素化學計量(C?N、C?P 和N?P)與微生物多樣性卻呈現負相關關系(Delgado-Baquerizo et al.,2017)。但總體而言目前有關氣候變化下土壤化學計量對土壤微生物多樣性塑造的重要性仍不清楚(Delgadobaquerizo et al.,2017;王譽陶等,2020)。
鑒于生物體通常具有保守的元素化學計量,從環境中獲取C、N 和P 的能力極大地限制了生物體和群落對氣候變化的響應(Finzi et al.,2011)。當環境發生變化時,土壤微生物可以通過改變自身的代謝途徑來維持細胞膜的功能性(Hall et al.,2010),在生態系統層面上此過程要求充足的C、N 和P 供應(Schimel et al.,2007)。隨著全球氣候變暖和降水格局的改變,土壤的水熱條件發生變化,正在影響陸地生態系統土壤的元素化學計量特征(Delgado-Baquerizo et al.,2013;Li et al.,2018)。在全球氣候變化的大背景下,評估土壤元素和元素化學計量如何影響土壤微生物的多樣性和群落組成,對我們深入探索不斷變化的環境下生態系統的功能并制定可持續的管理政策至關重要(圖1)。因此,本研究利用在天童20 hm2森林動態監測樣地內采集到的1 287 個土壤樣品,評估不同土壤水分下,C、N 和P 含量和化學計量在確定土壤微生物多樣性在局域尺度格局中的作用,以期為理解陸地生態系統如何響應氣候變化的機制提供理論基礎。

圖1 氣候變化背景下土壤元素和化學計量與微生物多樣性關系的框架圖Figure 1 An illustrative framework of the linkages between elemental stoichiometry and soil microbial diversity under climate change
1 材料與方法
1.1 研究區概況
本研究區位于中國浙江省寧波市天童國家自然保護區(華東師范大學)20 hm2亞熱帶森林動態監測樣地(29°48′N,121°47′E),屬于東部浙閩山地丘陵,是典型的常綠闊葉林區。氣候類型為亞熱帶季風氣候,夏季炎熱潮濕,冬季寒冷干燥,年平均氣溫為16.2 ℃,年平均降水量為1 374 mm,降雨主要集中在6-8 月(Hu et al.,2020)。該森林樣地設立于2008 年,東西長500 m,南北寬400 m,平均海拔為 447.2 m,是全球森林觀測站(ForestGEO,https://forestgeo.si.edu/)網絡的組成部分之一(Qiao et al.,2020)。植被以米櫧(Castanopsis carlesii)、栲樹(Castanopsisfargesii)和木荷(Schimasuperba)等為主(Hu et al.,2020)。土壤質地為紅黃壤,土層厚度不一。
1.2 土壤取樣和處理
于2018 年9 月采集土壤樣品,用于理化性質測定和微生物分析。將20 hm2(500 m×400 m)的樣地以20 m 為間隔劃分為500 個20 m×20 m 的小樣方,共計546 個頂點,均為取樣點。然后隨機選擇70%的頂點進行延伸取樣,即從8 個方向(正向和正向各偏45°)中隨機選擇一個方向設置為取樣方向,從該方向上2、5、8 m 等3 個距離中任選兩個設置為取樣點(John et al.,2007)。去除土壤表面凋落物后,在每個采樣點周圍0.5 m 范圍內使用直徑為10 cm 的土壤采樣器隨機采集4 個表層土芯(0-10 cm)并混合為一個土壤樣品。將所有采集到的1 287 個土壤樣品放入滅菌自封袋并保存于保溫箱中,迅速帶回實驗室進行樣品前處理。將所有土壤樣品過2 mm 篩后分為2 份子樣品,一份儲存在?80 ℃下,用于提取土壤DNA 并進行微生物分析;另一份經風干或烘干后用于土壤理化性質的測定。在這項研究中,依據鮑士旦《土壤農化分析》(鮑士旦,2000)中的方法測定了土壤含水量(Water content,WC)、有機碳(Organic carbon,OC)、全氮(Total nitrogen,TN)、全磷(Total phosphorus,TP)含量。其中,半微量開氏法測定土壤TN 含量,重鉻酸鉀容量法測定土壤OC 含量,HClO4-H2SO4消煮-鉬銻抗比色法測定TP 含量,105 ℃烘干法測定土壤WC。將所有土壤樣品按水分高低含量等分為相對較高(High_WC)和較低(Low_WC)兩個水平,其中相對較高的土壤水分范圍為75.5%-34.8%,相對較低的土壤水分范圍為34.8%-4.83%。
1.3 土壤DNA 提取和PCR 擴增
根據說明書,使用MagPure Soil DNA KF Kit試劑盒從每個樣品中取0.5 g 進行土壤DNA 抽提,其DNA 質量在質量分數為1%的瓊脂糖凝膠電泳上進行檢測,濃度和純度使用 NanoDrop One(Thermo Fisher Scientific,Waltham,MA,USA)進行測定。使用引物515F(5′-GTGCCAGCMGCCG CGGTAA-3′)和907R(5′-CCGTCAATTCMTTT RAGTTT-3′)擴增細菌16S rRNA 基因的V4-V5高變區序列,引物ITS3(5′-GCATCGATGAAGAAC GCAGC-3′)和ITS4(5′-TCCTCCGCTTATTGATA TGC-3′)擴增真菌的第一個內部轉錄間隔序列(ITS1)。在由 25 μL 2×Premix Taq(Takara Biotechnology(Dalian)Co.Ltd.,China)組成的反應系統中,使用BioRad S1000(Bio-Rad Laboratory,Hercules,CA,USA)一式三份進行PCR 擴增,上下游引物各1 μL(10 μmol·L?1)DNA 模板為3 μL(20 ng·μL?1)。使用PCR 擴增DNA 樣品,程序如下:95 ℃預變性5 min,然后30 個循環(94 ℃變性30 s,52 ℃退火30 s,72 ℃延伸30 s),然后72 ℃穩定延伸10 min。
1.4 Illumina 高通量測序與生物信息學分析
PCR 產物的長度和濃度用質量分數為1%瓊脂糖凝膠電泳檢測,選擇具有明亮主帶(長度在正常范圍內)的樣品用于下步實驗。根據GeneTools Analysis Software(版本4.03.05.0,SynGene)以等密度比混合PCR 產物。然后,PCR 產物用E.Z.N.A.?Gel Extraction Kit 凝膠提取試劑盒(Omega Bio Tek,Norcross,GA,USA)合并和純化。建庫操作按照NEBNext?Ultra?DNA Library Prep Kit for Illumina?標準流程進行。將純化的擴增子以等濃度匯集,并在廣東Magigene 生物技術有限公司在IlluminaHiseq2500 平臺上對擴增子文庫進行末端配對(PE250)測序。
使用Trimmomatic(Bolger et al.,2014)軟件對原始的16S rRNA 和內部轉錄間隔(ITS)基因測序序列進行質控,過濾含N 的reads、質量值低于20 及質控后序列長度低于100 bp 的reads,獲得paired-end clean reads。使用FLASH(Mago? et al.,2011)(https://ccb.jhu.edu/software/FLASH/)軟件拼接,具有以下標準:(1)根據PE 序列間的重疊關系,將成對序列拼接成一條序列,最小重疊長度設置為10 bp;(2)拼接序列的重疊區域的最大錯配率為0.1,過濾掉不符合的序列,獲得原始的拼接序列(Raw Tags);(3)使用Mothur(Schloss et al.,2009)軟件(http://www.mothur.org)進行歸類操作。根據標簽(barcode)和引物(primer)信息等將序列分配到對應的樣品中,并調整序列方向。barcode 允許的錯配數為2,最大引物錯配數為3。然后,去除barcode 和primer,得到有效的拼接片段(Clean Tags)。使用USEARCH 軟件(Edgar,2010),根據97%的相似度對高質量的核酸序列聚類到操作分類單位(Operational taxonomic units,OTUs)水平,并剔除嵌合體和單條序列。每個細菌(https://doi.org/10.6084/m9.figshare.21692744.v1)和真菌(https://doi.org/10.6084/m9.figshare.21687824.v1)OTU 的代表序列分別與Silva(版本128,https://www.arb-silva.de/)和Unite 數據庫(版本7.2,http://unite.ut.ee/index.php)比對獲取物種的注釋信息,比對設定置信度閾值默認為0.5 以上。刪除在所有樣本中序列總和小于20 的OTUs 后,共獲得8 373 個細菌OTUs 和11 961 個真菌OTUs。此外,所有樣本的序列信息均根據最小序列數進行抽平,以校正測序深度的差異。
1.5 統計分析
本研究所涉及的數據分析和相關圖表均在R 軟件(https://www.r-project.org/)4.1.2 版本中完成。利用曼特爾檢驗(Mantel test),分析微生物群落組成與土壤水分的相關性。使用Vegan 包(Dixon,2003)中的‘diversity’和‘ggplot2’函數計算土壤微生物的α 多樣性并繪制箱線圖。基于Bray-Curtis 相異度矩陣生成不同土壤水分下的主坐標分析(Principal Co-ordinates Analysis,PCoA),并采用Anosim 檢驗進行顯著性分析,評估細菌和真菌的群落組成在不同土壤水分下是否存在顯著差異。利用線性回歸模型評估不同水分下土壤元素和化學計量的變化情況。利用Spearman 相關分析解析不同土壤水分下元素和化學計量分別與微生物多樣性的關系。使用Pheatmap 包繪制熱圖,分析不同水分下土壤元素和化學計量對微生物主要門類的影響。
2 結果與分析
2.1 不同土壤水分下微生物群落多樣性和組成差異
曼特爾檢驗(Mantel test)顯示,土壤水分與微生物(細菌和真菌)群落組成存在顯著的相關關系(表1)。通過對微生物群落α 多樣性(圖2)的分析發現,土壤水分對細菌和真菌多樣性均產生了顯著影響,相較于高土壤水分,在低土壤水分下,細菌和真菌群落的α 多樣性分別顯著提高了0.830%和2.62%。此外,通過PCoA 分析并結合Anosim 檢驗可以發現,不同土壤水分下細菌和真菌群落出現分離,細菌和真菌前兩軸的總解釋率分別為31%和10%,且細菌和真菌的群落結構在不同土壤水分下均存在顯著差異(圖3)。

表1 土壤水分與細菌和真菌群落組成的關系(曼特爾檢驗)Table 1 Relationship of soil moisture and community composition of bacteria and fungi (Mantel test)
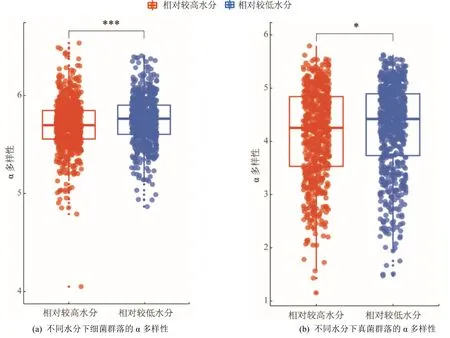
圖2 不同土壤水分下細菌和真菌群落的α 多樣性Figure 2 The α diversities of bacterial and fungal community under relatively high vs.low water contents
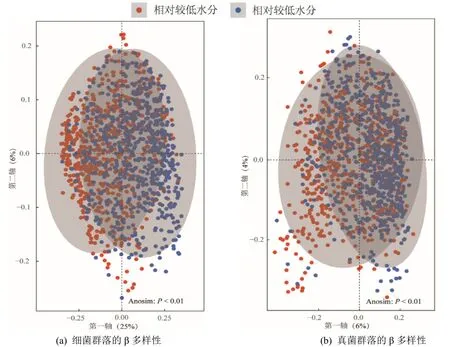
圖3 細菌和真菌群落的β 多樣性Figure 3 The β diversities of bacterial and fungal community
繪制不同土壤水分下細菌和真菌物種組成圖,細菌主要劃分為12 個門,其中酸桿菌門(Acidobacteria;38%)、變形菌門(Proteobacteria;33%)和放線菌門(Actinobacteria;5%)的相對豐度較高。真菌主要劃分為 5 個門,其中子囊菌門(Ascomycota;32%)、擔子菌門(Basidiomycota;31%)和隱菌門(Rozellomycota;12%)的相對豐度較高(圖4)。此外,通過對比微生物在門水平上相對豐度的變化可以發現,無論是細菌還是真菌,門水平下的微生物類群在不同土壤水分下均表現出不同的響應模式。具體而言,相較于低土壤水分,高土壤水分顯著提高了細菌5 個門類(圖5),即變形菌門( Proteobacteria )、放線菌門(Actinobacteria)、浮霉菌門(Planctomycetes)、WPS菌門(WPS-2)和藍藻菌門(Cyanobacteria)和真菌2 個門類,即隱菌門(Rozellomycota)和結合菌門(Zygomycota)的相對豐度,增幅分別為6.50%-97.4%和0.530%-39.7%;顯著降低了細菌7 個門類,即酸桿菌門(Acidobacteria)、疣微菌門(Verrucomiocrobia)、擬桿菌門(Bacteroidetes)、綠彎菌門(Chloroflexi)、芽單胞菌門(Gemmatimonadetes)、髕骨菌門(Patescibacteria)和迷蹤菌門(Elusimicrobia)和真菌2 個門類,即子囊菌門(Ascomycota)和球囊菌門(Glomeromycota)的相對豐度,降幅分別為6.90%-39.7%和7.09%-7.33%。
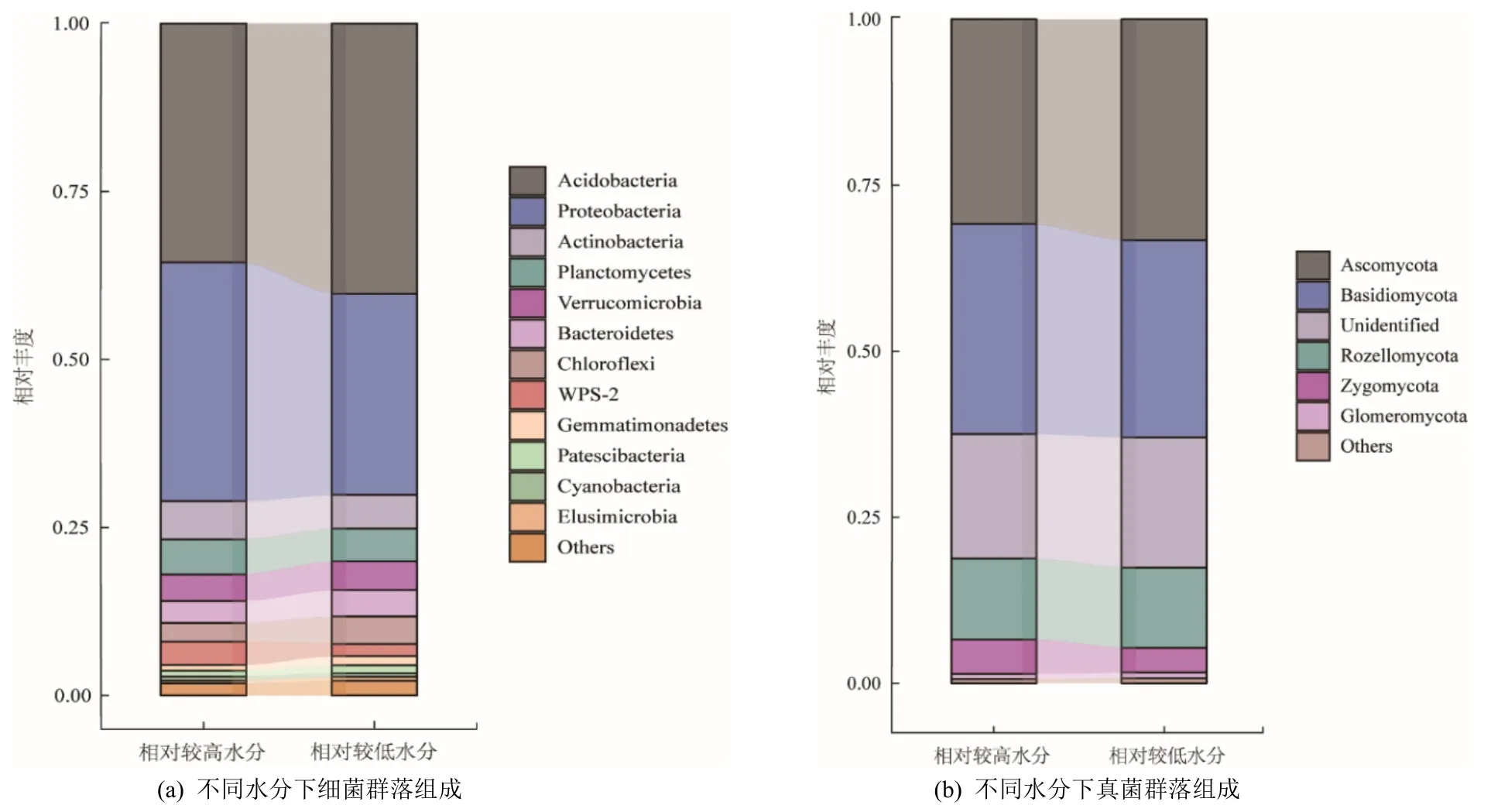
圖4 不同土壤水分下細菌和真菌群落組成Figure 4 Bacterial and fungal community compositions at phylum-level under relatively high vs.low water contents
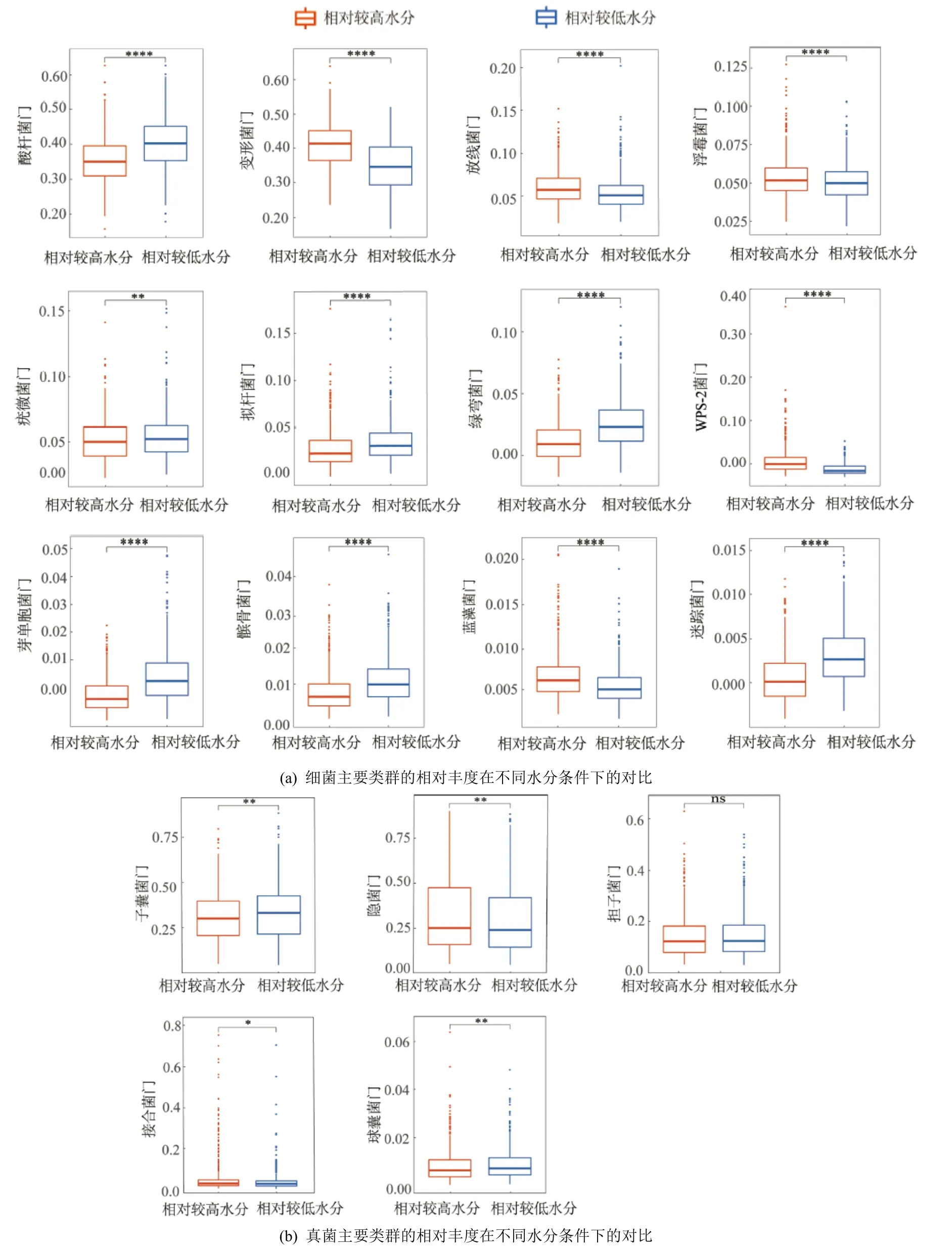
圖5 細菌和真菌主要類群的相對豐度在不同水分條件下的差異對比Figure 5 Comparisons of the relative abundance of bacterial and fungal major groups under relatively high vs.low water contents
2.2 不同土壤水分下的土壤元素和化學計量
基于線性回歸分析可以發現(圖6),土壤元素和化學計量(C?N、C?P 和N?P)與土壤水分間的模型擬合均達到了顯著水平,即土壤水分對土壤元素和化學計量均產生了顯著影響(P<0.001)。無論在High_WC 還是Low_WC 下,土壤元素和化學計量均隨著土壤含水量的增加而顯著增加。此外,結合秩和檢驗發現,High_WC 下OC、C?N 和C?P 均顯著高于Low_WC(表2)。
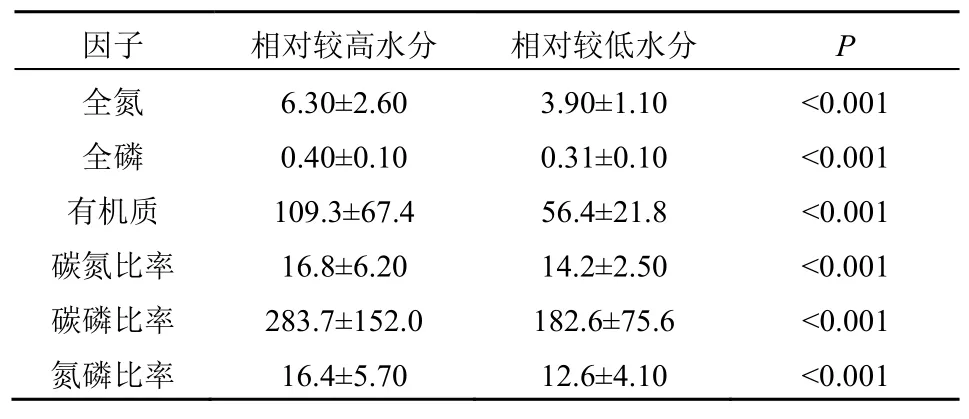
表2 土壤元素和化學計量在不同土壤水分下的差異比較Table 2 Comparisons of soil elements and stoichiometry under relatively high vs.low water contents
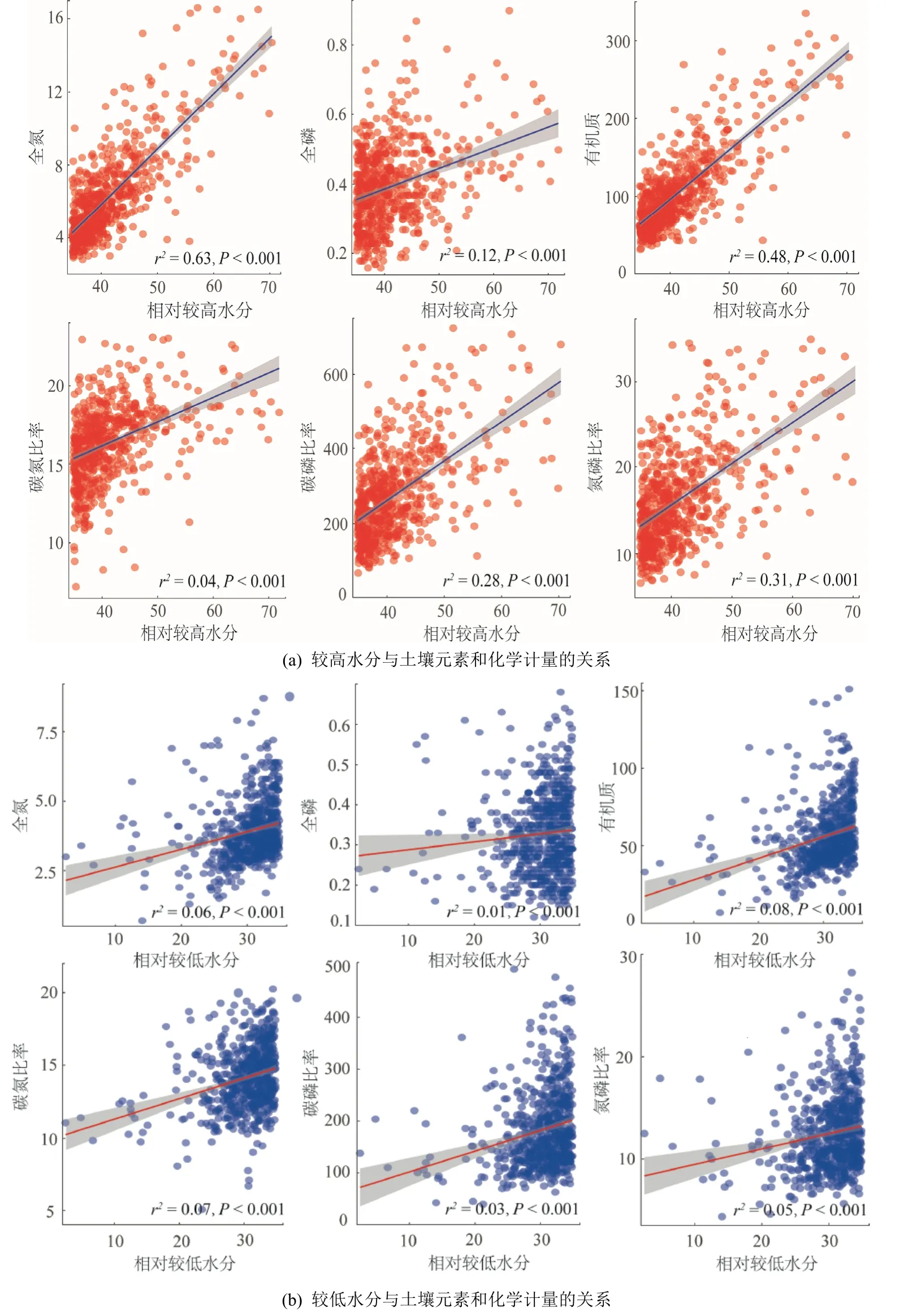
圖6 土壤水分與土壤元素和化學計量的關系Figure 6 Relationships of relatively high vs.low water contents and soil elements and stoichiometry
2.3 不同水分下元素和化學計量與微生物多樣性的關系
基于Spearman 相關分析可以發現,細菌群落的α 多樣性隨著C?N、C?P 和N?P 的增加而顯著降低(圖7),而TP 與之相反,且較高和較低的土壤水分并沒有改變其變化趨勢(圖7)。TN 和OC 與多樣性的關系受到土壤水分的影響,即High_WC下呈現顯著的負相關關系(P<0.001),而在Low_WC 下兩者間未呈現顯著的相關關系(P>0.05)。真菌群落的α 多樣性與土壤元素和化學計量的關系基本與細菌保持一致關系(圖7)。
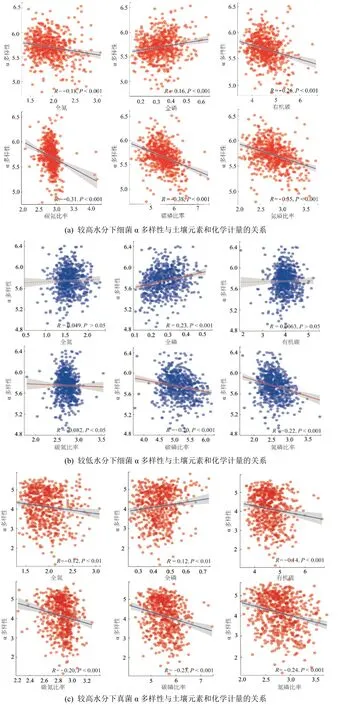
圖7 不同水分下土壤元素和化學計量與微生物α 多樣性的關系Figure 7 Relationships between soil elements and stoichiometry and microbial α diversity under relatively high vs.low water contents
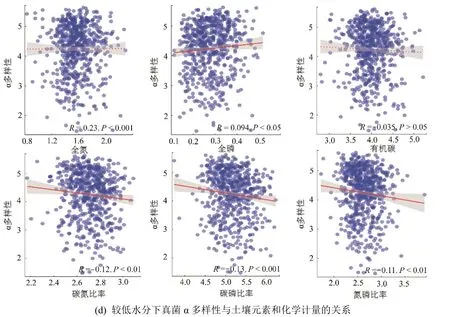
續圖7 不同水分下土壤元素和化學計量與微生物α 多樣性的關系Continued figure 7 Relationships between soil elements and stoichiometry and microbial α diversity under relatively high vs.low water contents
通過熱圖(圖8)可以發現,細菌和真菌主要門類的相對豐度在不同的土壤水分下與土壤元素和化學計量之間存在一定的相關性。其中,酸桿菌門(Acidobacteria)、綠彎菌門(Chloroflexi)和擬桿菌門(Bacteroidetes)與OC、TN、C?N、C?P 和N?P 呈現顯著的負相關關系(P<0.01);而放線菌門(Actinobacteria)和變形菌門(Proteobacteria)與土壤元素和化學計量呈現顯著的正相關關系(P<0.01)。此外,在High_WC 下,隱菌門(Rozellomycota)與土壤元素和化學計量均呈現顯著的負相關關系(P<0.01),而在Low_WC 下,其相對豐度僅僅與土壤元素TP 呈現顯著的正相關關系(P<0.01)。同時,擔子菌門(Basidiomycota)的相對豐度在Low_WC 下僅與土壤C?N 存在顯著的正相關關系(P<0.01)。
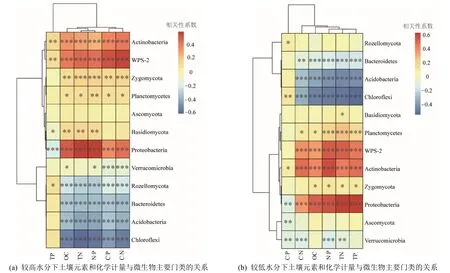
圖8 不同水分下土壤元素和化學計量與微生物主要門類的關系Figure 8 Relationships between soil elements and stoichiometry and the primary microbial phyla under relatively high vs.low water contents
3 討論
3.1 土壤水分對微生物多樣性和群落組成的影響
在全球氣候變化和降水格局不斷改變的背景下(New et al.,2001),世界范圍內干旱事件發生的頻度和強度顯著增加(Huang et al.,2016),對陸地生態系統的結構、功能及生物多樣性產生嚴重的影響。作為土壤的重要組成部分之一,土壤水分是植物和微生物生存的重要物質基礎。同時,土壤水分也是干旱脅迫對全球生態系統生產力產生壓力的主導因素(Liu et al.,2020)。本研究表明土壤水分對細菌和真菌的多樣性及其群落組成均存在顯著影響,這與以往的研究結果相一致(Ochoa-Hueso et al.,2018)。在微生物多樣性方面,本研究發現High_WC 下微生物多樣性反而相對較低,這可能是由于土壤中的水分含量較高時,微生物偏愛性的營養資源處于相對易于被利用狀態,引起微生物出現趨同性,進而導致群落多樣性降低。在微生物群落組成方面,不同微生物類群對土壤水分呈現出截然相異的響應模式,這可能是因為不同的微生物群落存在適宜其生長的水分生態位(Lennon et al.,2012)。以往基于草地生態系統的研究發現,細菌類群中的放線菌門(Actinobacteria)的相對豐度隨著干旱程度的增加而增加(Barnard et al.,2013;Ochoa-Hueso et al.,2018),這些門類對干旱通常具有較強的抵抗性,屬于“準備型”策略,即在低土壤水分條件下,放線菌門(Actinobacteria)可以增加自身核糖體的合成,以便在土壤條件變得有利于養分獲取時處于優勢地位,這使得它們在較低的水分條件下比其它微生物類群更能幸存(Battistuzzi et al.,2009)。而酸桿菌門( Acidobacteria ) 和疣微菌門(Verrucomiocrobia)遵循“快速響應”的生命策略,即在較低的土壤水分下,并非投資自身核糖體的合成,而依賴于水分充足后快速合成核糖體(Barnard et al.,2013)。然而,在本研究中,放線菌門(Actinobacteria)在High_WC 下的相對豐度較高,這可能是因為不同生態系統具有復雜性和異質性,土壤微生物菌群對水分的變化存在差異化的響應(Maestre et al.,2015;Xu et al.,2018),微生物會本能地選擇適應自身生長的策略生存。這些與土壤水分相關的細菌生命策略表明,降雨格局的改變可能通過影響微生物群落的活性來影響土壤養分循環(Barnard et al.,2013)。這也為我們以后研究不同生態系統中同種微生物類群的不同響應模式提供了新的見解
3.2 不同土壤水分下的元素和化學計量的變化
隨著全球氣候的不斷變化,受到生物化學過程介導的土壤C、N 和P 循環可能會逐漸解耦(Finzi et al.,2011),這與土壤元素的可利用性受到水分的驅動有關(Austin et al.,2004;Schwinning et al.,2004)。土壤水分的降低能夠打破元素循環間的平衡,進而影響元素的可利用性。我們的研究結果表明,土壤元素和化學計量與土壤水分存在顯著正相關關系,這與以往的研究結果相似(Schlesinger et al.,1990;Delgado-Baquerizo et al.,2013)。總體而言,土壤水分的降低能夠引起土壤元素的C、N和P 失衡,進而對生態系統的功能(生產力、分解等)和服務(糧食生產和碳儲存等)產生嚴重后果。此外,本研究結果顯示,在High_WC 下OC、C?N和C?P 較高,這可能是水分提高了微生物的活性,促進微生物的生長和代謝,進而釋放有機物質,增加土壤中的有機C 含量(Qi et al.,2022)。同時,較高的土壤水分可能減緩有機物的分解速率,使得土壤中的有機物質保持相對較高的含量。此外,較高的土壤水分可以減緩養分的流失和淋溶,并緩解養分限制,促進植物的生長和代謝,進而增加土壤中的養分含量。
3.3 元素和化學計量與土壤微生物多樣性的關系
元素化學計量影響陸地生態系統中微生物的生長和養分循環(Sterner et al.,2003)。例如,土壤C?N 可以重塑生態系統的微生物過程(養分的礦化和固化等)(Zechmeister-Boltenstern et al.,2015)。本研究結果顯示,微生物群落的多樣性隨著C?N、C?P 和N?P 的增加而降低,這與以往的研究結果相一致(Delgado-baquerizo et al.,2017),且土壤水分的高低并不會改變其趨勢(王譽陶等,2020),這可能歸咎于微生物對土壤養分環境存在較高的依賴性(黃菊瑩等,2018)。微生物多樣性與土壤元素化學計量間存在顯著負相關關系,其可能的原因是在較低的元素化學計量(高養分利用效率)生境下,微生物會通過促進生態位的分化來增加其多樣性(Hooper et al.,2000)。此外,根據生長速率假說(growth-rate hypothesis,GRH),生長速率較快的類群(比如細菌)由于合成核糖體、RNA 和ATP 等需要更高水平的P 含量,通常以低C?P 化學計量為特征(Pe?uelas et al.,2009)。另一方面,C 和N 元素會隨著土壤的發育在生態系統中不斷積累,P 元素來自巖石風化后母質的供應,但這些元素會逐漸被耗竭或者固化在植物和動物體內,因此能夠提供給微生物的可利用性養分的濃度減少,進而限制快速生長的微生物的多樣性(Mcgill et al.,1981)。同時,在High_WC 下,OC 含量與細菌的多樣性呈現顯著的負相關關系,即低C 水平能夠提高細菌的多樣性。
酸桿菌門(Acidobacteria)和綠彎菌門(Chloroflexi)等門類與土壤元素和化學計量間呈現顯著的負相關關系,說明這些微生物類群適合生長在養分相對貧瘠的土壤;而放線菌門(Actinobacteria)和變形菌門(Proteobacteria)與土壤元素和化學計量呈現顯著的正相關關系,說明這些類群更宜生長在養分相對充足的土壤。此外,擔子菌門(Basidiomycota)的相對豐度隨土壤水分的降低而減少,在氣候變暖且土壤干旱頻發的大背景下,其相對豐度是否會逐漸降低有待進一步探究。此外,隱菌門(Rozellomycota)的相對豐度在不同的土壤水分下與元素和化學計量間的關系發生明顯變化,在Low_WC 下,其相對豐度僅僅與土壤元素TP 呈現顯著的正相關,而在High_WC 下,其相對豐度基本上與土壤元素和化學計量呈現顯著的負相關關系。這說明,水分可以通過影響土壤元素和化學計量,改變其含量和比率(李一春等,2020),微生物則調整自身的多樣性來響應環境的變化(王譽陶等,2020)。
4 結論
本研究通過對采自天童20 hm2亞熱帶森林動態監測樣地的1 287 份土壤樣品的理化性質和微生物測序分析發現,高P、低C?N、C?P 和N?P 水平可以促進局域尺度格局中土壤微生物的多樣性,且相對較高或較低的土壤水分不改變其趨勢。因此,土壤元素化學計量可以作為土壤養分的重要指標,指示土壤對微生物生長發育所需要的養分情況。在全球氣候變化的大背景下,未來的森林管理可以通過人為施入肥料的方式調節土壤養分,進而動態調控土壤微生物群落以抵抗環境變化。評估森林土壤元素和元素化學計量的變化如何影響土壤微生物,對我們了解在全球氣候變化下生態系統的功能以及制定可持續的管理政策至關重要。

