單中心早期開展腹腔鏡胰十二指腸切除術后肝膿腫四例診療分析
劉小慧 賀曼曼 馮喆 趙飛 馮運章 牛廣旭
腹腔鏡胰十二指腸切除術(laparoscopic pancreaticoduodenectomy,LPD)目前已成為壺腹周圍腫瘤的主流術式[1]。該手術解剖關系復雜、切除臟器多、消化道重建復雜[2],術后并發癥發生率高[1]。肝膿腫是胰十二指腸切除術(pancreaticoduo denectomy,PD)少見并發癥,可導致膿毒血癥、感染性休克等嚴重并發癥,是PD后死亡的重要因素[3]。本中心收治LPD術后繼發肝膿腫4例。現報道如下。
對象與方法
一、對象
2017年1月~2021年1月間在我院接受LPD病人82例。通過查閱病歷、實驗室檢查、影像學檢查篩選出LPD后繼發肝膿腫4例,男性1例,女性3例。診斷標準:LPD后肝膿腫參考以下診斷標準[4]:(1)有發熱、寒戰、肝區不適、腹痛,肝區叩擊痛等臨床表現;(2)肝臟多普勒超聲或CT、MRI等影像學檢查診斷為肝膿腫或發現肝臟病變;(3)微生物培養(血培養或膿液培養)結果陽性,或抗菌藥物治療有效;(4)經皮肝穿刺術或手術治療后證實病變為細菌引起的化膿性感染。符合(1)、(2),同時滿足3條以上。
二、方法
1.收集一般資料,包括性別、年齡、手術時間,術中出血量、術后病理、術后膽瘺(膽瘺診斷及分級參照文獻[5]、胰瘺(胰瘺診斷及分級參照[6])、肝膿腫癥狀,術后發生肝膿腫的時間、膿腫位置及數目等指標。
2.收集實驗室結果,包括住院治療期間白細胞計數(WBC)最高值、中性粒細胞百分比(%NEUT)最高值、血紅蛋白最低值、血小板最低值、白蛋白最低值、C反應蛋白(CRP)最高值、降鈣素原(PCT)最高值、膿液培養結果、置管引流后拔管時間。
3.收集影像學資料:包括術前、術后影像學資料,回顧手術視頻。能夠查閱的影像學資料由2位影像學副主任醫師雙盲閱片,分析LPD后肝膿腫可能病因。
4.收集治療方案及轉歸:根據病歷記錄及醫囑單收集其治療方案,包括抗生素使用、有無置管引流或者再手術,電話或微信隨訪其預后轉歸,截至病人死亡或2022年5月。
三、統計學方法
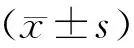
結果
1.一般資料:遵前述標準,共納入LPD后LPA病人4例(4.88%)。男性1例,女性3例,平均年齡(56.75±11.15)歲。例2行LPD+腸系膜上靜脈楔形切除術,余病人常規行LPD,無中轉開腹,平均術中出血量(375.00±206.16)ml,平均手術時間(389.50±24.24)分鐘。例3接受術中輸血,包括紅細胞及血漿,余3例術中未輸血。術后病理診斷為膽管癌3例,壺腹部腺癌1例。例1、2病人術后發生A級膽漏,均發生于術后第1天,引流通暢保守治愈。例1、3病人術后發生胰腺生化瘺,保守治愈,例2,4病人術后發生B級胰瘺,均經彩超定位另置入引流管通暢引流后治愈。4例病人于LPD后18~88天根據臨床癥狀、腹部CT或彩超檢查發現肝膿腫,發現肝膿腫中位時間27天。4例肝膿腫均發生在肝右葉,例1為多發肝膿腫(同時2個膿腔,不相通),余均為單腔膿腫。肝膿腫最大徑平均為(5.75±2.41)cm。4例病人中3例為二次住院,平均住院時間(26.75±12.09)天。
2.實驗室檢查結果:4例病人體溫最高峰均>38.5 ℃。WBC最高平均值(19.1±3.1)×109/L,中性粒細胞百分比最高平均值(92.3±2.3)%,血紅蛋白最低平均值(102.2±8.4)g/L,血小板最低平均值(128.0±103.3)×109/L。白蛋白最低平均值(28.1±3.8)g/L,CRP平均最高值(152.1±38.8)mg/L,PCT平均最高值(2.5±1.4)ng/ml。4例病人均進行肝穿刺引流和膿液培養,3例為大腸埃希菌,1例為肺炎克雷伯氏桿菌,均為多重耐藥菌。4例病人經置管引流后平均拔管時間(23.50±6.19)天。見表2。
3.影像學檢查結果:通過對比手術前后影像學資料,回顧手術視頻,查閱病歷及隨訪,分析推測LPD后肝膿腫病因:例1顯示肝右動脈主干分支損傷截斷。例2根據術前增強CT及手術記錄發現肝右動脈變異,來源于腸系膜上動脈,術中未辨別清楚輕易結扎切斷。例3查閱手術記錄發現病人因腫瘤侵犯腸系膜上靜脈,行腸系膜上靜脈楔形切除后應用5-0血管縫合線直接縫合,導致腸系膜上靜脈節段性狹窄,狹窄段長度約1.5 cm。例4術后間斷發熱、寒戰,均對癥處理好轉,初未重視,術后應用奧沙利鉑+替吉奧膠囊方案化療2個周期,于術后88天因寒戰高熱入院,復查彩超提示肝膿腫,治療痊愈后復查磁共振對比術前,未發現明顯供肝血管動靜脈損傷,但病人肝膿腫治愈后仍有間斷性發熱癥狀,復查磁共振提示肝內膽管壁增厚,多發炎性改變,考慮系膽腸吻合術后復膽道逆行感染。見表1、圖1~4。

A:LPD術前增強CT顯示肝右動脈主干分支走形(黑色箭頭所示);B:LPD術后25天肝臟平掃CT證實肝膿腫,且為2個不相通膿腔(黑色箭頭所示);C:LPD術后41天復查增強CT顯示肝膿腫已吸收拔管,但與A對比發現肝右動脈主干分支已截斷(黑色箭頭所示);D:術后14個月增強CT發現肝臟多發轉移(黑色箭頭所示),術后16個月因肝臟多發轉移、腹水死亡。圖1 例1病人影像學資料

A:LPD術前增強CT顯示肝右動脈起源自腸系膜動脈,黑色箭頭所示為肝右動脈自腸系膜上動脈分出起始部位,紅色箭頭所示為擴張的膽總管;B:LPD術后18天肝臟平掃CT證實肝膿腫(黑色箭頭所示),置管引流治愈,術后已健康存活19個月。圖2 例2病人影像學資料

A:LPD術前增強CT顯示腫瘤侵犯腸系膜上靜脈(紅色箭頭所示);B:LPD術后28天彩超引導下置管引流后即刻復查肝臟平掃CT顯示肝膿腫(黑色箭頭所示);C:LPD術后近24個月復查增強CT顯示肝臟轉移(黑色箭頭所示)、脾窩腹腔積液,且伴有膽腸吻合復發,肝門區及胰頭區淋巴結轉移,最終于術后26個月因肝臟多發轉移、梗阻性黃疸死亡圖3 例3病人影像學資料

A:病人術前磁共振,黃色箭頭所示為壺腹部腫瘤位置,伴低位膽道梗阻;B:病人LPD術后88天彩超證實肝膿腫;C:病人LPD術后10個月余復查磁共振顯示膿腫治愈,但已經發現肝臟轉移(紅色箭頭所示)及肝脾周圍腹腔積液,且黃色箭頭所示肝內膽管壁明顯增厚,呈炎性改變,提示反復膽道感染。病人術后13個月因反復膽道逆行感染死亡圖4 例4病人影像學資料

表1 LPD后肝膿腫病人一般資料
4.治療與轉歸:4例病人白細胞計數明顯升高,且CRP、PCT等均不同程度升高。例1因為重癥感染導致血小板危急值,最低10×109/L,在發病初期經驗性使用美羅培南抗炎治療,同時均行彩超定位經皮經肝膿腫穿刺置管引流術。其中病例1為肝右葉多發膿腫,第1次彩超定位置入1個豬尾引流管引流,但兩個膿腔并不相通,再次彩超定位困難,選擇CT定位在2個膿腔各置入1個豬尾引流管引流,引流沖洗治愈。余3例病人均彩超下置管1次引流治愈。4例病人術后均伴有不同程度的低蛋白血癥、貧血等營養不良表現。例1 額外輸注血小板治療,并給予進口胸腺法新增強免疫力。4例動態復查彩超,待膿液減少或消失,停抗生素3天無發熱癥狀后帶管出院,根據引流及復查情況決定來院拔管時間,平均拔管時間(23.50±6.19)天。
5.隨訪:例1術后16個月因肝臟多發轉移、腹水死亡;例2肝膿腫治愈后移居他市失訪,2022年5月電話隨訪,術后已健康存活19個月,無復發轉移;例3術后26個月因肝臟多發轉移、胰頭區淋巴結轉移致黃疸死亡;例4術后13個月因反復膽道逆行感染死亡。LPD后肝膿腫病人實驗室檢查結果見表2。

表2 LPD后肝膿腫病人實驗室檢查結果
討論
肝膿腫(liver abscess,LA)是細菌、真菌或溶組織阿米巴原蟲等致病菌通過膽道、肝動脈、門靜脈、直接蔓延等途徑侵入肝臟引起的肝內局灶性、化膿性病變[7-8]。臨床上細菌性肝膿腫(pyogenic liver abscess,PLA)最常見,占總發病率80%,阿米巴性肝膿腫約占10%,真菌性肝膿腫低于10%[8]。此外,由炎癥性腸病等導致的無菌性肝膿腫也已引起醫學界的重視[9]。PLA病因復雜多樣,近年來發病率上升,且復發率較高,有研究認為其歸咎于糖尿病、惡性腫瘤及其他免疫抑制人群生存期延長、膽道及消化道介入手術增多、多重耐藥和高毒力致病菌的產生等[10]。有研究表明,糖尿病、惡性腫瘤、肝腎疾病、免疫抑制狀態、高齡等是PLA發病的高危因素[11],肝膽或胰腺疾病、胰十二指腸手術、肝移植手術等是PLA的潛在危險因素[7]。目前,關于外科手術后繼發肝膿腫的研究主要集中于肝原發或繼發腫瘤病人介入化療栓塞術后肝膿腫[12]。此外,也有膽道支架置入術后肝膿腫[13]、PD后肝膿腫的少數病案報告[3]。目前,LPD手術量多集中于國內大型醫療中心,在我國地市級醫院并未廣泛開展,LPD后肝膿腫僅見于個案報道[3,14]。
肝臟易受感染而形成膿腫與其血供豐富、膽腸相通等因素有關[15]。目前多數學者認為,LPD后肝膿腫與肝動脈、門靜脈損傷導致肝缺血梗死以及膽道系統逆行感染[3,13-14,16]相關。徐強等[3]PD后診斷為肝梗死、肝膿腫的病例11例,發現7例明確合并肝固有動脈、副右肝動脈的截斷或狹窄,1例術前存在腹腔干根部狹窄,3例存在門靜脈狹窄,認為PD后肝動脈、門靜脈的缺血是發生肝梗死、肝膿腫的主要原因。Mukesh等[17]報道肝膿腫好發于肝右葉,可能與門靜脈及右葉的血流主要來源于腸系膜上靜脈相關。Fei等[14]報道1例病人因“慢性胰腺炎”接受PD,術后反復肝膿腫4次,后尋找病因發現肝總動脈起源異常損傷導致肝膿腫,反復穿刺后仍有復發,最終于PD后17個月行右半肝切除才痊愈。本研究4例病人中,例1于術后25天出現肝膿腫且為多發肝膿腫,復查增強CT發現肝右動脈主干分支損傷截斷,其供血供氧肝段缺血缺氧壞死。例2病人LPD后18天發現肝膿腫,為究其病因查看術前增強CT才發生肝右動脈變異,術中未辨識清楚輕易結扎切斷。例3系膽總管腫瘤侵犯部分腸系膜上靜脈,因本中心早期開展LPD血管吻合技術不成熟,術中聯合腸系膜上靜脈楔形切除,導致腸系膜上靜脈遺留長度1.5 cm明顯狹窄段,推測其術后肝膿腫與腸系膜上靜脈狹窄導致胃腸道淤血、門靜脈血流減少密切相關。此外,腸道細菌易位、反復膽道逆行感染可以引起肝內細菌感染,逐步演變為肝膿腫[13,18]。早期動物實驗也證實,Roux-en-Y膽管空腸吻合術后1 周時肝內細菌濃度已明顯升高,2個月后僅下降約50%,且肝內分離到的細菌類型與膽腸吻合口分離到的菌種大部分一致[19]。本研究例4病人LPD后曾有間斷性發熱、寒戰等膽道感染的癥狀,初未重視,應用奧沙利鉑+替吉奧膠囊方案化療2個周期,于術后88天因寒戰、高熱入院,彩超檢查提示肝膿腫,痊愈后復查磁共振對比術前,未發現明顯供肝血管動靜脈損傷,但病人肝膿腫治愈后仍有間斷性發熱癥狀,復查磁共振提示肝內膽管壁增厚,多發炎性改變。推測其肝膿腫病因可能源于反復膽道逆行感染,當化療后機體免疫力受抑制,細菌入侵肝臟,最終發展為肝膿腫。
肝膿腫的治療方案主要包括抗生素治療、介入治療、外科手術以及射頻消融等[7,20]。目前我國PLA的致病菌譜已由大腸埃希菌轉變為肺炎克雷伯菌,尤其以高毒力肺炎克雷伯菌為主[20],而在歐洲國家則演變為以糞球菌為主[21]。本研究4例病人膿液培養大腸埃希菌3例,肺炎克雷伯菌1例,與上述結果不符,可能是源于研究的病例數太少或者LPD后肝膿腫致病菌譜與原發性LPD有所差別。抗生素使用強調早期、足量、足療程,不建議逐步升級。后期根據膿液培養及藥敏結果調整抗生素,建議逐步降級為窄譜抗生素,避免耐藥[7]。在抗生素治療的同時易盡早介入治療。彩超或CT定位經皮經肝膿腫置管引流是優選治療方案,簡單方便,臨床易掌握。因肝膿腫好發于肝右葉,常需經肋間穿刺,狹窄的肋間隙以及引流管刺激肋間神經痛限制了粗大引流管的使用[22]。因此,本研究4例病人均采用頭端卷曲伴有側孔的8F豬尾引流管置管引流均獲得滿意治療效果。只有當上述治療效果不滿意,復雜膿腫或膿腫巨大緊靠肝邊緣易破潰或膿腫位置毗鄰第一、二肝門導致穿刺難度高者才慎重選擇手術治療[22]。射頻消融術治療肝膿腫是一種新型的治療方法[20],但也有射頻消融術治療肝轉移瘤后導致肝膿腫的報道[23]。這種治療方案的有效性、安全性還需研究證實。
綜上,LPD后肝膿腫主要與手術中肝臟供血動靜脈損傷、膽腸吻合術后反復膽道逆行感染有關。抗生素聯合介入治療均能獲得滿意治療效果。本研究LPD后肝膿腫發病率較高,可能與早期開展LPD尚未度過學習曲線有關。早期擬開展LPD的醫學中心應重視術前CT增強血管重建技術[14],術前了解供肝血管走形與變異,充分術前評估。

