長孢輪枝菌犜犪狇Man MGB探針實(shí)時(shí)熒光PCR快速檢測方法
段維軍 李雪蓮 呂燕等





關(guān)鍵詞 長孢輪枝菌;實(shí)時(shí)熒光PCR; TaqMan-MGB探針;
檢測
中圖分類號:S 432.44 文獻(xiàn)標(biāo)識碼:A DOI:10.16688/j.zwbh 2022332
長孢輪枝菌Verticillium longisporum(C.Stark) Karapapa,Bainbr.&Heale,隸屬于真菌界Fungi,子囊菌門Ascomycota,盤菌亞門Pezizomy-cotina,糞殼菌綱Sordariomycetes,肉座菌亞綱Hypocreomycetidae,小叢殼目Glomerellales,不整小球囊菌科Plectosphaerellaceae,輪枝菌屬Verti-cillium[1]。該病菌目前主要分布于歐洲的瑞典[2]、德國[3]、英國[4-5]、比利時(shí)[6]、俄羅斯[7],北美洲的美國[8]和加拿大[3],亞洲的日本[9]和中國[10]。該病菌在中國局部分布,是近年新發(fā)現(xiàn)的植物病害。
長孢輪枝菌其主要寄主作物是十字花科植物,主要包括油菜Brassica napus、甘藍(lán)B.oleracea、花椰菜B.oleracea var. botrytis、卷心菜B.oleraceavar.capitata、抱子甘藍(lán)B.oleracea var. gemmif-era、苤藍(lán)B.oleracea var. gongylodes、蕪菁B.ra-pa、辣根Armoracia rusticana等[9,11-16]。在有些植物中,長孢輪枝菌與其近似種大麗輪枝菌Verticilli-um dahliae沒有顯著的寄主劃分,例如油菜[2]、辣根[17]、甜菜Beta vulgarjs[18]、擬南芥Arabidopsis thaliana[19-20]和蘿卜Raphanus sativus[21]。致病性測定研究表明,長孢輪枝菌也可侵染非十字花科植物[22],如小麥Triticum aestivum、豌豆Pisum sati-vum和燕麥Avena sativa[23]。
輪枝菌常隨植物商品貿(mào)易而廣泛擴(kuò)散,如大麗輪枝菌[24],長孢輪枝菌不產(chǎn)生氣生孢子,是一種土傳病原菌[14],從該病菌A1/D1株系的廣泛傳播可以看出,人類活動在病害傳播過程中起了重要作用[24]。對病菌進(jìn)行有效快速檢測是防范其危害的重要技術(shù)基礎(chǔ),可為抗病育種、植物檢疫、防治效果評價(jià)等多項(xiàng)工作提供技術(shù)手段。目前,針對長孢輪枝菌的主要檢測鑒定方法多為形態(tài)學(xué)結(jié)合DNA序列分析方法等[2-5,7,10,15],費(fèi)時(shí)費(fèi)力,且靈敏度不高。和常規(guī)PCR檢測方法相比,實(shí)時(shí)熒光PCR檢測方法具有檢測時(shí)效快、特異性強(qiáng)、靈敏度高和易于操作等優(yōu)點(diǎn)。本研究以長孢輪枝菌的actzn序列片段為靶標(biāo),建立了基于Taq Man-MGB探針的長孢輪枝菌快速檢測方法,為長孢輪枝菌的檢測提供技術(shù)支持。
1材料與方法
1.1供試菌株與引物、探針的設(shè)計(jì)合成
供試菌株共計(jì)46株,分別為:從青海蘿卜上分離鑒定的7株長孢輪枝菌(均為A1/D1株系),從荷蘭微生物菌種保藏中心獲得的2株長孢輪枝菌(CBS 124.64為AID3株系,CBS 110220株系不詳),以及一些其他種屬的植物真菌37株(表1)。以上菌株均保存于本實(shí)驗(yàn)室,采用無菌水保存法保存,備用。
通過分析長孢輪枝菌及其近似種actin基因間的差異,應(yīng)用Primer Express 3.0軟件設(shè)計(jì)了特異性引物VLAF1(5′-GTGCCGCGGGCAAA-3′)、VLARl(5′-ACCGACAATGGAAGCTTGAAA-3′)以及探針VLAP1(5′-CTCGACATGATCTTTG-3′),預(yù)期產(chǎn)物大小為62bp(圖1)。引物和TaqMan-MGB探針由上海立菲公司合成。
1.2 DNA提取
1.2.1菌絲DNA提取
用滅菌槍頭刮取PDA平板上培養(yǎng)10 d的菌絲體,根據(jù)TANBeadPlant DNA Auto Kit操作說明,利用自動化核酸提取儀(ThermoFisher,King-fisher mL型),提取DNA。經(jīng)超微量分光光度計(jì)(ThermoFisher,NanoDrop 2000C型)檢測DNA濃度后,保存于-20℃?zhèn)溆谩?/p>
1.2.2組織樣品DNA提取
取蘿卜組織約0.1 g,切成細(xì)絲狀,提取DNA所用設(shè)備及試劑盒同1. 2.1。
1.3引物和探針特異性檢測
采用10μL擴(kuò)增反應(yīng)體系:2×TaqMan Uni-versal PCR Master Mix 5μL,正向引物VLAF1(10μmol/L)0.5μL,反向引物VLAR1(10μmol/L)0.5μL,探針VLAP1(10 μmol/L)0.5μL,模板(供試菌株)DNA 1μL,超純水2.5μL。以超純水為空白對照。
反應(yīng)條件為:95℃10 min;95℃15s,60℃1min,40個(gè)循環(huán)。
1.4實(shí)時(shí)熒光PCR體系的優(yōu)化
1.4.1引物濃度優(yōu)化
以菌株LV19-5 DNA為模板,正、反向引物濃度分別以0.1μmol/L遞增,分別從0.1μmol/L遞增至1.0μmol/L,1.3體系中其余各成分濃度保持不變,進(jìn)行實(shí)時(shí)熒光PCR擴(kuò)增,反應(yīng)條件同1.3。
1.4.2探針濃度優(yōu)化
以菌株LV19-5 DNA為模板,探針濃度以0.1μmol/L遞增,從0.1μmol/L遞增至1.0μmol/L,采用1.4.1優(yōu)化后的引物濃度,1.3體系中其余各成分濃度保持不變,進(jìn)行實(shí)時(shí)熒光PCR反應(yīng)擴(kuò)增,反應(yīng)條件同1.3。
1.5靈敏度檢測
以菌株LV19-5DNA為模板,用滅菌超純水將DNA進(jìn)行10倍梯度稀釋,每個(gè)梯度進(jìn)行3次重復(fù),開展靈敏度檢測。在10μL反應(yīng)體系中,DNA含量分別為10ng、1.0ng、100pg、10pg、1.0pg。利用優(yōu)化后的引物及探針濃度進(jìn)行實(shí)時(shí)熒光PCR,反應(yīng)條件同1.3。
1.6重復(fù)性試驗(yàn)
以菌株LV19-5 DNA為模板進(jìn)行重復(fù)性檢測。用上述相同的條件分別進(jìn)行3次獨(dú)立重復(fù)試驗(yàn),分析組內(nèi)、組間差異。計(jì)算平均Ct值、標(biāo)準(zhǔn)偏差(standard deviation,SD)和變異系數(shù)(coefficient of variation, CV)。
1.7樣品檢測
選取2021年10月從青海采集的蘿卜黑心病感病樣品7份,從寧波菜市場購買的健康蘿卜13份,參照1.2.2方法,取蘿卜肉質(zhì)組織提取DNA,進(jìn)行實(shí)時(shí)熒光PCR檢測,檢驗(yàn)該方法的實(shí)用性。
2結(jié)果與分析
2.1特異性檢測
在相同條件下,對表1中參試的9株長孢輪枝菌及其他37株菌進(jìn)行實(shí)時(shí)熒光PCR檢測。結(jié)果顯示,所選取的來自不同地理來源的9株長孢輪枝菌可擴(kuò)增產(chǎn)生明顯擴(kuò)增曲線,無擴(kuò)增的為其他參試菌及空白對照。說明此實(shí)時(shí)熒光PCR檢測方法具有較好的種特異性。
2.2實(shí)時(shí)熒光定量PCR的體系優(yōu)化
2.2.1引物濃度優(yōu)化
引物濃度優(yōu)化試驗(yàn)結(jié)果顯示,在0.1~0.8μmol/L范圍內(nèi),Ct值隨著濃度增大而減小,而△Rn值隨著濃度增大而增大。因此,引物的最佳濃度為0.8μmol/L,此時(shí)Ct值最小,并且△Rn值達(dá)到最大(圖2)。
2.2.2探針濃度優(yōu)化
在確定最佳引物濃度的基礎(chǔ)上進(jìn)行探針濃度優(yōu)化試驗(yàn)。結(jié)果顯示,在0.1~0.8μmol/L范圍內(nèi),Ct值隨著濃度增大而減小,而△Rn值隨著濃度增大而增大。因此,探針的最佳濃度為0.8μmol/L,此時(shí)Ct值最小,并且△Rn值達(dá)到最大(圖3)。
2.2.3優(yōu)化后的反應(yīng)體系
通過優(yōu)化引物和探針濃度,得到優(yōu)化后的反應(yīng)體系:2×TaqMan Universal PCR Master Mix5μL,引物VLAR1(10μmol/L)0.8μL,引物VLAF1(10μmol/L)0.8μL,探針VLAP1(10μmol/L)0.8μL,DNA 1μL, ddHO補(bǔ)足10μL。
2.3靈敏度檢測及標(biāo)準(zhǔn)曲線的建立
靈敏度試驗(yàn)結(jié)果表明,本研究所建立的實(shí)時(shí)熒光PCR最低檢測限是10 pg(圖4)。
通過實(shí)時(shí)熒光PCR檢測已知濃度梯度的總DNA,發(fā)現(xiàn)DNA濃度越高,Ct值越小,3個(gè)平行試驗(yàn)結(jié)果顯示,所得標(biāo)準(zhǔn)曲線為y=-3.66x+26.83(R=0.9984),x代表DNA濃度的對數(shù),y代表相應(yīng)的Ct值(圖5)。
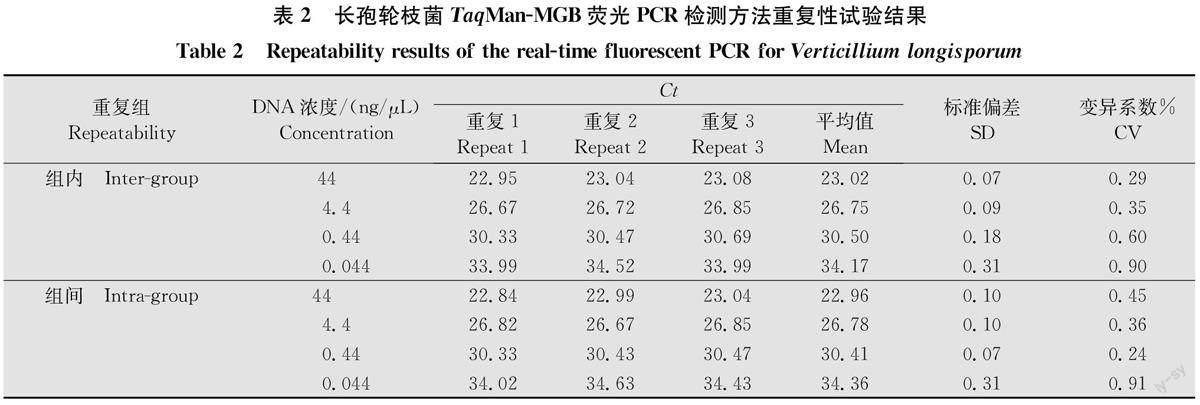
2.4重復(fù)性檢測
以菌株LV19-5 DNA的4個(gè)濃度(44、4.4、0.44、0.044ng/μL)進(jìn)行組內(nèi)、組間重復(fù)測定,各3次。通過統(tǒng)計(jì)分析可見,組內(nèi)、組間重復(fù)CV值均小于1%,分別為0.29%~0.90%,0.24%~0.91%,說明本研究所建立的針對長孢輪枝菌的Taq Man-MGB熒光PCR檢測方法,具有較好的重復(fù)性和穩(wěn)定性。
2.5實(shí)際樣品檢測
對收集的20份樣品進(jìn)行檢測,其中7份為表現(xiàn)蘿卜黑心病癥狀樣品,13份為健康的蘿卜樣品。以LV19-5菌株的DNA為陽性對照。結(jié)果表明,20份樣品中,7份疑似長孢輪枝菌感染的蘿卜樣品DNA擴(kuò)增后均可產(chǎn)生熒光信號,健康蘿卜未產(chǎn)生熒光信號(圖6)。
3結(jié)論與討論
輪枝菌是一類土傳真菌,主要引起植物的維管束病害,可導(dǎo)致嚴(yán)重經(jīng)濟(jì)損失。在缺乏寄主情況下,病原菌可通過產(chǎn)生微菌核、休眠菌絲和厚垣孢子等休眠結(jié)構(gòu)在土壤中長期存活,以度過不良環(huán)境[25],由于沒有有效的化學(xué)藥劑,且缺乏有效的抗病品種,生產(chǎn)中往往難以控制輪枝菌所造成的病害[14,26]。開展嚴(yán)格檢疫是防范重要病原菌傳播擴(kuò)散乃至危害的重要技術(shù)手段,而這有賴于準(zhǔn)確、特異、靈敏的檢測方法。在對該屬真菌分類學(xué)研究尚未查清之前,國內(nèi)外針對輪枝菌中的重要病原菌如黑白輪枝菌V.albo_atrum[27-29],大麗輪枝菌V.dahliae[29-38],長孢輪枝菌V.longisporum[36]和三體輪枝菌V.tri-corpus[39-40]等已經(jīng)開展了一些研究,建立了基于PCR、實(shí)時(shí)熒光PCR等技術(shù)的檢測方法。但是,上述檢測方法多建立在輪枝菌分類問題有效解決之前,因此準(zhǔn)確性難以得到有效保證。例如黑白輪枝菌,V.albo-atrum sensu lato目前已被劃分為3個(gè)不同的物種V.alfalfae、Vnonalfalfae和V.albo-atrum sensu stricton[15,41]。又如,長孢輪枝菌在很長一段時(shí)間被認(rèn)為是大麗輪枝菌的一個(gè)變種即大麗輪枝菌長孢變種Verticillium dahliae var.longispo-rum C.Stark,其分生孢子中DNA含量接近大麗輪枝菌的1.75倍[2,42-43],長孢輪枝菌在細(xì)胞骨架蛋白(ACT)、翻譯延伸因子(EF)、3-磷酸甘油醛脫氫酶(GPD)、線粒體草酰乙酸轉(zhuǎn)運(yùn)蛋白(OX)和色氨酸合酶(TS)等多個(gè)基因上具有等位基因,但在核糖體基因內(nèi)轉(zhuǎn)錄間隔區(qū)(ITS)片段上不具有等位基因[16]。很明顯,在獲得上述科學(xué)認(rèn)知之前,針對輪枝菌不同種類的快速檢測存在很大局限性。
迄今為止,國內(nèi)外已經(jīng)開展了一些長孢輪枝菌檢測技術(shù)的研究。Yu等[44]采用核糖體小亞基mtSSU rDNA和細(xì)胞色素b(cytochrome b)序列分析等方法,將北京地區(qū)大白菜黃萎病病原鑒定為長孢輪枝菌,并根據(jù)其核糖體ITS序列設(shè)計(jì)了特異性引物HWl-F/HW1-R,建立了該病菌的快速檢測方法,但特異性研究中未能包括長孢輪枝菌近似種,如V.alfalfae、V.nonal falfae等,因此其特異性難以保證。Banno等[9]根據(jù)ITS、mtSSU-rDNA、cyto-chrome b、交配型(mating type)基因序列,結(jié)合RAPD研究,將日本群馬縣的甘藍(lán)Brassica olera-cea var.capitata黃萎病病原鑒定為長孢輪枝菌。苗增建等[10]采用形態(tài)學(xué)與ITS序列分析相結(jié)合的方式,鑒定出引起青海省蘿卜黑心病的病原為長孢輪枝菌、三體輪枝菌和瓜小織球殼菌Plectos phae-rella cucumerina。呂燕等[45]采用形態(tài)學(xué)特征觀察結(jié)合多基因序列分析,進(jìn)一步將青海地區(qū)蘿卜黑心病病原鑒定為長孢輪枝菌A1/D1株系。此類檢測鑒定方法建立在序列分析基礎(chǔ)之上,耗時(shí)較長。In-derbitzin等[46]建立了針對多種輪枝菌的特異性PCR和多重PCR檢測方法,但對于親緣關(guān)系較近的種類,如大麗輪枝菌和長孢輪枝菌,無法通過特異性PCR區(qū)分,需要采用多重PCR才能加以區(qū)分,但該研究未對反應(yīng)靈敏度進(jìn)行研究,同時(shí)也僅采用分離株提取的DNA進(jìn)行了驗(yàn)證,未在實(shí)際帶菌樣品中開展檢驗(yàn)。特異性和靈敏度,是研究快速檢測技術(shù)中最重要的考慮因素[47]。本研究在以ITS為靶標(biāo)設(shè)計(jì)引物和探針過程中發(fā)現(xiàn),長孢輪枝菌及其近似種ITS片段高度相似,難以設(shè)計(jì)出合適的引物和探針,因此改用actin片段作為靶標(biāo)。為了設(shè)計(jì)出能夠有效區(qū)分長孢輪枝菌的引物和探針,借鑒了輪枝菌屬最新分類成果,在引物探針設(shè)計(jì)階段對長孢輪枝菌及其近似種的多個(gè)基因序列進(jìn)行了比對,最終篩選出變異區(qū)段較大且位于共同親本A1的actin片段為靶標(biāo)設(shè)計(jì)引物探針,該靶標(biāo)存在于長孢輪枝菌3種不同株系中,且同源性較高,保證了特異性。同時(shí),為了驗(yàn)證其特異性,我們在特異性試驗(yàn)中收集了長孢輪枝菌近似種V.alfae、V.nonalfalfae、V.albo-atrum、V.dahliae和V.tricorpus作為參試菌株,同時(shí)也包括了原劃分在輪枝菌屬中的Gibellu-lopsis nigrescens等菌株進(jìn)行特異性驗(yàn)證。另外,供試長孢輪枝菌中包括了長孢輪枝菌模式分離物CBS124.64。特異性試驗(yàn)結(jié)果表明,本文所建立的實(shí)時(shí)熒光PCR方法對不同寄主來源或株系的長孢輪枝菌菌株均可檢出,其他近似種或供試菌均不能檢出,具有較好的種間特異性和種內(nèi)一致性。
大多數(shù)已知的真菌雜交種報(bào)道與植物病原體相關(guān),由于全球貿(mào)易等人類活動影響,造成以前地理隔離的物種之間相互接觸并雜交,從而產(chǎn)生毒力增強(qiáng)和寄主范圍擴(kuò)大的新病原[48-49]。長孢輪枝菌起源于3次不同時(shí)間的進(jìn)化。長孢輪枝菌有1個(gè)共同的親本A1和3個(gè)不同的親本D1、D2和D3,其中A1和D1親本可能來源于未知的輪枝菌種類,而D2和D3親本則可能源自大麗輪枝菌[16]。長孢輪枝菌不同株系間分離物存在致病性差異,如A1/D1和A1/D3株系常見于多種十字花科植物上。A1/D1株系主要報(bào)道于油菜上,在油菜上致病力最強(qiáng)[50]。目前分布在法國、德國、瑞典、加拿大、美國和日本等國家,但是在油菜以外的寄主植物上也有相關(guān)發(fā)生報(bào)道[25,45,51-52]。而A1/D2株系則僅見于辣根上[16,53]。本研究所設(shè)計(jì)的檢測靶標(biāo)位于長孢輪枝菌A1親本分支actin序列上,由于長孢輪枝菌3種不同株系均含有Al親本序列,因此,本研究所建立方法能夠檢測目前已經(jīng)報(bào)道的長孢輪枝菌全部3個(gè)株系。在今后的研究工作中,可進(jìn)一步針對長孢輪枝菌不同株系特征序列設(shè)計(jì)檢測方法,以實(shí)現(xiàn)針對特定株系的快速檢測。
Taq Man實(shí)時(shí)熒光PCR是在普通PCR的基礎(chǔ)上,增加1條熒光標(biāo)記的特異性探針,在完全封閉條件下通過熒光信號的強(qiáng)弱來實(shí)時(shí)監(jiān)測PCR擴(kuò)增產(chǎn)物量的變化,具有特異性強(qiáng)、靈敏度高、操作簡單和不易污染等優(yōu)點(diǎn)[54-55]。截至目前,國內(nèi)外已有大量采用實(shí)時(shí)熒光PCR技術(shù)檢測植物病原真菌的相關(guān)研究與報(bào)道[33-34,36,38,47,55-57],其靈敏度通常在1 pg左右。本研究中檢測靈敏度為10pg,與以往針對其他病菌actin片段為靶標(biāo)的檢測靈敏度相似[55],可能是由于本檢測靶標(biāo)位置在A1親本的actin片段上,而該片段在長孢輪枝菌DNA中拷貝數(shù)較低故含量較低所致。DNA檢測靶標(biāo)片段對于靈敏度有較大影響,通常基于ITS片段的引物探針靈敏度更高,例如向日葵黑莖病菌Plenodomus lindquistii靈敏度可達(dá)0.1 pg[47],杜鵑花枯萎病菌Ovulinia azaleae可達(dá)0.25 pg[56],這可能是ITS片段在上述病菌DNA中拷貝數(shù)較多,因此相對含量較高所致。應(yīng)用此方法,可成功從疑似受長孢輪枝菌侵染的蘿卜樣品中檢測鑒定長孢輪枝菌。本檢測技術(shù)也可進(jìn)一步用于其他疑似受該菌侵染樣品的檢測,如土壤、種子和植株等受侵染樣品。
利用TaqMan-MGB探針,本研究首次建立了長孢輪枝菌實(shí)時(shí)熒光PCR快速檢測方法,通過優(yōu)化反應(yīng)體系,確定了最佳引物終濃度和探針終濃度,均為0.8μmol/L;通過靈敏度試驗(yàn),確定了最低檢測限量為10μL反應(yīng)體系中總DNA含量10 pg。該方法重復(fù)性好、穩(wěn)定性高,檢測過程完全閉管,無PCR后續(xù)處理需求,減少了PCR產(chǎn)物的污染,簡化了檢測步驟,節(jié)約了時(shí)間,具有良好的應(yīng)用前景。

