真空預冷結合氮氣(N2)包裝處理對小白杏糖代謝的影響
田全明, 路 帆, 殷貝貝, 劉雪艷, 魏 佳, 吳 斌
(1.新疆農業科學院農產品貯藏加工研究所,烏魯木齊 830091;2.新疆農業大學食品科學與藥學學院,烏魯木齊 830052)
0 引 言
【研究意義】2020年新疆杏種植面積達到2×105hm2,年產量超過1.5×106t,位居全國第一[1,2]。小白杏是新疆南疆地區主要種植鮮杏品種之一,因其風味獨特,含有多種碳水化合物、維生素及豐富的營養價值[3]。小白杏屬于呼吸躍變型果實,采收后會在較短時間內出現后熟軟化現象,與采收初期相比,后期貯藏過程中其內部的糖酸類物質含量會發生顯著變化,極易出現軟化腐爛等問題,影響果實風味[4,5],影響鮮食杏在市場流通[6,7]。研究杏果實中糖代謝與貯藏品質之間的關聯性,控制糖含量變化,對提高杏果實的貯藏品質,減少小白杏后熟軟爛有重要意義。【前人研究進展】真空預冷是一種快速降低果實中心溫度且冷卻均勻的果蔬預冷技術[8,9]。陳亞鵬等[10]對芥藍的研究中,真空預冷可以有效降低葉和根的溫差,并降低呼吸強度、失重率和葉綠素含量,抑制丙二醛(MDA)含量的增長。在鮮食蓮子[11]采后貯藏研究中發現,真空預冷結合補水處理能顯著降低失重率,抑制褐變,較好的保持其外觀品質,延長貯藏期。氮氣(N2)是一種廣泛應用于果蔬貯藏保鮮中熏蒸氣體,研究表明,氮氣包裝處理對果蔬有顯著的保鮮效果。86.6%的氮氣對白玉菇進行保鮮處理,可有效的推遲呼吸高峰,保持其硬度,保鮮期可達7 d以上[12]。對新疆小白杏[13]的研究中發現,真空預冷結合氮氣處理,可以通過調節細胞壁代謝延緩小白杏果實采后軟化,較好的保持小白杏的品質。【本研究切入點】關于真空預冷結合氮氣包裝對果品糖代謝影響的報道及研究較少。需研究真空預冷結合氮氣(N2)包裝處理對小白杏糖代謝的影響。【擬解決的關鍵問題】采用真空預冷結合N2熏蒸方法,對新疆小白杏進行采后處理,分析真空預冷結合N2熏蒸方式對采后小白杏糖代謝的影響,為杏果實在采后保鮮方面的應用提供理論依據。
1 材料與方法
1.1 材 料
1.1.1 小白杏
綠熟期小白杏(TSS≥12.18%)于2020年5月采自新疆庫車縣小白杏種植基地。挑選無病蟲害、無機械損傷,且大小、顏色、外觀一致的小白杏,采用真空預冷機將果心溫度預冷至4℃備用。
1.1.2 試 劑
氫氧化鈉、3,5二硝基水楊酸,天津市光復精細化工廠;蔗糖、葡萄糖、果糖、山梨糖醇(均為標準品)德國Dr.Ehrenstorfer股份有限公司;蔗糖合成酶、蔗糖磷酸合成酶、蔗糖分解酶、中性轉化酶、酸性轉化酶(均為試劑盒),北京Solarbio科技有限公司。
1.1.3 儀 器
高效液相色譜(安捷倫 美國PerkinElmer公司);十萬分之一分析天平 MS105DU(瑞士Mettler Toledo公司);Centrifge 5810 R型高速冷凍離心機(德國Eppendorf公司);激光打孔機(日本HITACHI公司);GD1913 型氣調包裝機(廣州行遠包裝機械有限公司)。
1.2 方 法
1.2.1 樣品處理
將氣調包裝機的氣調比例調到100% N2,通過O2和CO2檢測器測量確定保鮮盒中的O2濃度≤0.05%(v/v)。將預冷后的果實放入保鮮盒中(每盒20個),氣調包裝。用激光打孔機于2 h后打孔,貯于10℃恒溫箱中,每隔3 d測定各項生理指標。杏果實用液氮凍樣后,放入-40℃冰箱貯存。真空預冷4℃、真空預冷4℃結合N2熏蒸2 h分別表示為CK、N2-2。
1.2.2 測定指標
1.2.2.1 可滴定酸(Titratable Acid TA)含量和還原糖含量
參照曹建康等[14]方法測定。
1.2.2.2 HPLC測定果糖、蔗糖、葡萄糖、山梨糖醇含量
糖含量測定采用Chunmei等[15]方法。取5 g杏粉加入25 mL超純水中,超聲30 min,8 000 r/min離心20 min,取上清液,過0.22 μm水相濾膜后待測。
1.2.2.3 SPS、SS、SS-I、AI、NI活性
蔗糖合成酶、蔗糖磷酸合成酶、蔗糖分解酶、中性轉化酶、酸性轉化酶按照北京Solarbio科技有限公司試劑盒使用說明書測定相關酶活性。
SPS、SS活性以每g組織1 min催化產生1 μg蔗糖定義為一個酶單位(U/g)。
SS-I、NI、AI活性以每g組織1 min產生1 μg還原糖定義為一個酶單位(U/g)。
1.2.2.4 標準溶液的制備
用超純水制備1 000 mg/L蔗糖、果糖、葡萄糖、山梨糖醇標準母液避光儲存于-4℃冰箱。利用標準品母液稀釋配制并繪制標準曲線,濃度梯度為0.10,0.20,0.50,1.00,2.00,5.00和10.00 mg/L。
1.2.2.5 色譜條件
色譜柱:鈣離子交換柱(安捷倫2600 Hi-Plex Ca液相色譜柱8.0 μm,7.7 mm×300 mm)。
儀器條件:流動相:純水;檢測器:RI檢測器;柱溫:40℃;流速:0.4 mL/min;進樣量:10 μL。
1.3 數據處理
使用 GraphPad Prism 8.0軟件作圖,SPSS 20.0進行數據分析以及利用 Duncan法來比較均值。P≤0.05表示差異顯著,P≤0.01表示差異極顯著。
2 結果與分析
2.1 杏果實中蔗糖、葡萄糖和果糖、山梨糖醇含量的測定
研究表明,蔗糖的出峰時間為17.273 s、葡萄糖的出峰時間為20.081 s、果糖的出峰時間為25.927 s和山梨糖醇的出峰時間為34.798 s;蔗糖、葡萄糖、果糖和山梨糖醇相應的驗證參數,其中標曲中蔗糖的出峰時間為17.287 s、葡萄糖的出峰時間為20.095 s、果糖的出峰時間為25.981 s和山梨糖醇的出峰時間為34.769 s,校準曲線在范圍內線性回歸良好(R2=0.998 7~0.999 3)。建立的測定方法能夠同時定量測定果實中蔗糖、葡萄糖、果糖和山梨糖醇的含量。表1,圖1
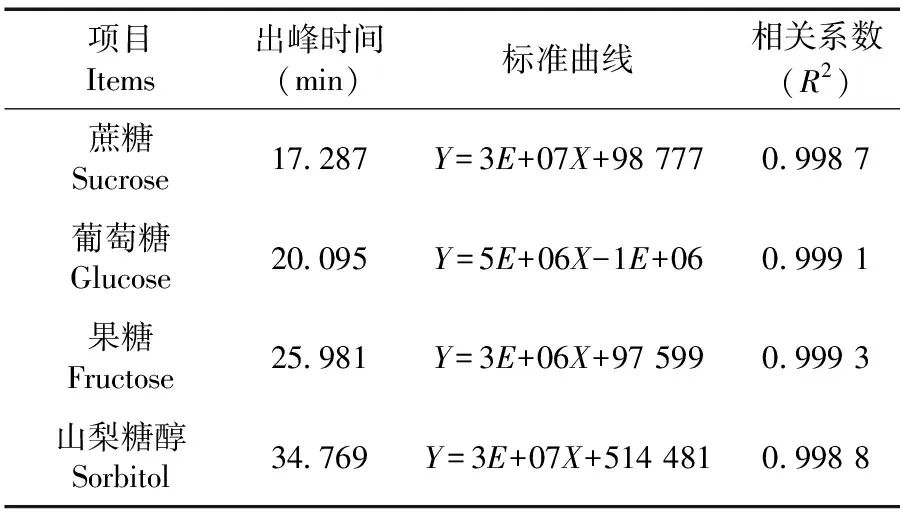
表1 HPLC法測定杏子中糖的驗證參數
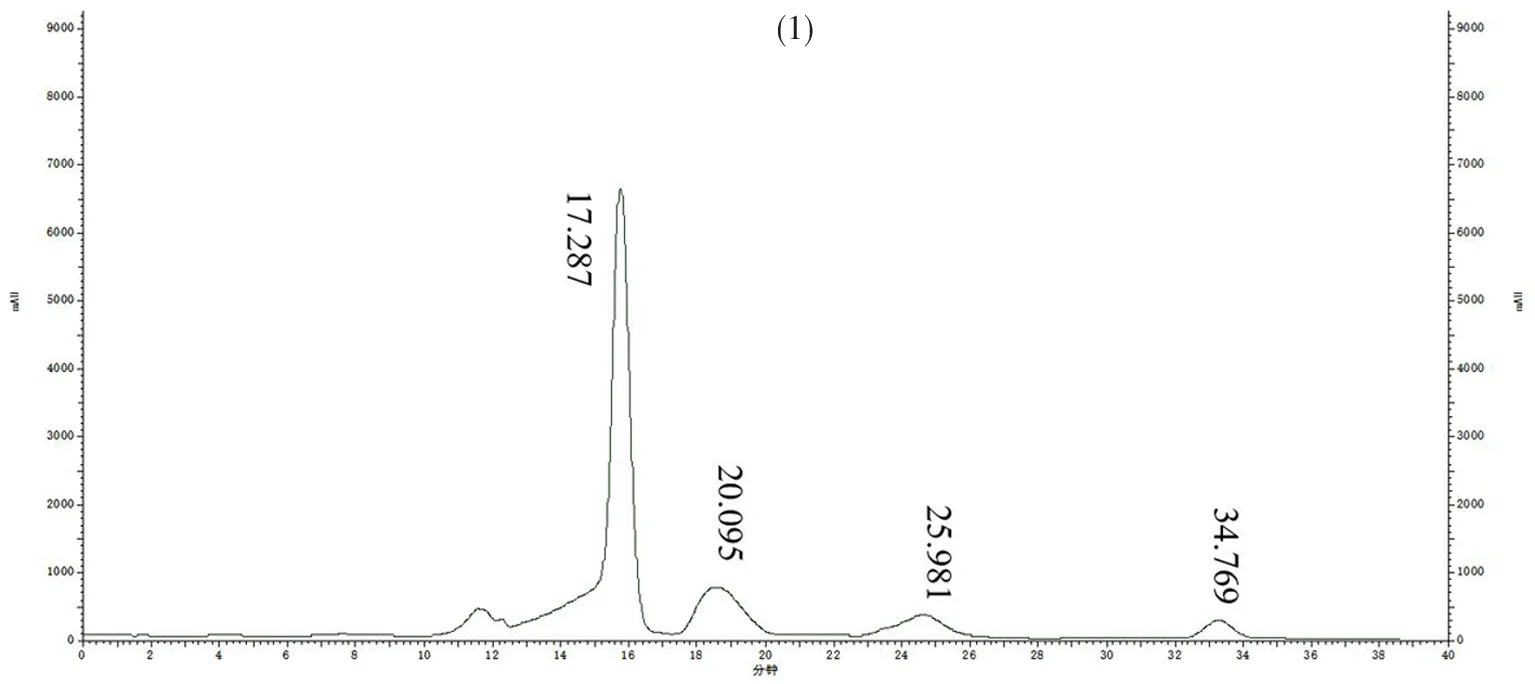
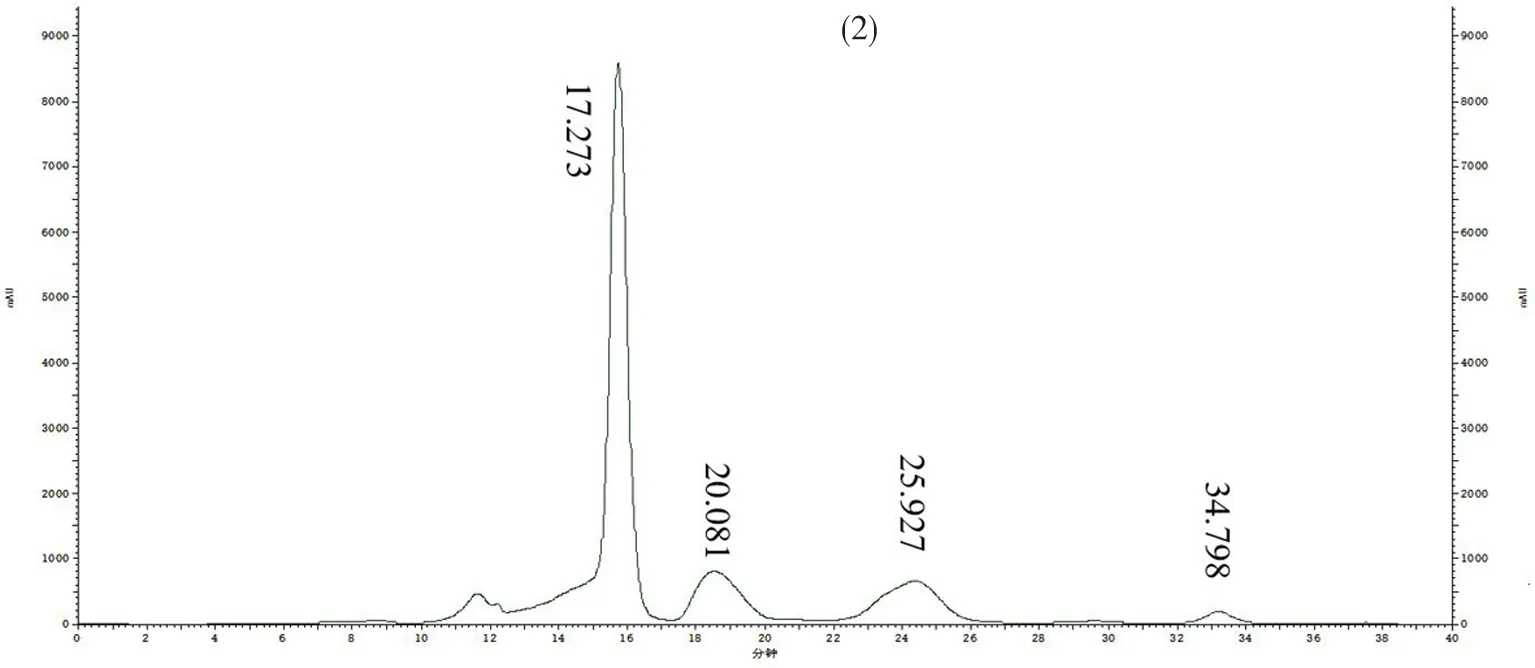
圖1 HPLC色譜圖-標準品(1)和樣品(2)
2.2 N2-2對小白杏葡萄糖、果糖、蔗糖、山梨糖醇含量的影響
研究表明,小白杏在貯藏過程中葡萄糖、果糖的含量逐漸升高。貯藏第0 d時葡萄糖和果糖的含量分別為(45.90±2.50) mg/g、(27.4±1.59) mg/g,貯藏至18 d時,N2-2處理組的葡萄糖和果糖含量分別為93.42、54.73 mg/g。在貯藏期間,N2-2處理組葡萄糖和果糖的含量始終高于CK組,N2-2處理能促進葡萄糖和果糖的生成。蔗糖含量呈現先上升后下降的趨勢,貯藏初期蔗糖含量高于其他糖類,貯藏第0 d時蔗糖的含量為(58.62±1.46) mg/g,貯藏至第9 d時,蔗糖含量達到最大,CK組與N2-2處理組的最大值分別為79.26、73.42 mg/g,之后蔗糖含量逐漸下降。山梨糖醇含量呈逐漸下降的趨勢,貯藏第0 d時山梨糖醇的含量為(36.02±1.25) mg/g,貯藏至第18 d時山梨糖醇的含量完全消失。N2-2對杏果實進行處理后,在貯藏期間可以減緩蔗糖的合成量并加速蔗糖和山梨糖醇的分解,促進葡萄糖和果糖的生成。圖2
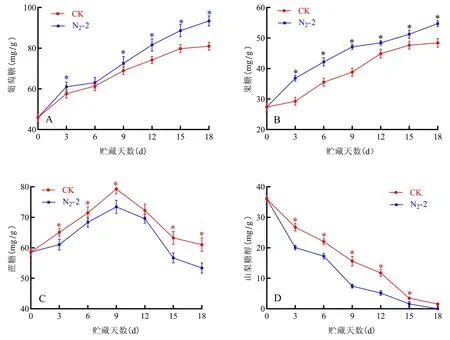
圖2 N2-2處理下小白杏糖組分變化
2.3 N2-2對小白杏還原糖含量的影響
研究表明,還原糖含量呈現先下降后上升的趨勢。在整個貯藏期間還原糖含量下降較緩慢,N2-2處理組還原糖含量始終高于CK組。貯藏至第6 d時,N2-2還原糖的含量是11.94%,CK組還原糖的含量是8.16%,其中N2-2處理組還原糖含量是CK組的1.32倍。在第12~18 d貯藏過程中,N2-2處理組中的還原糖含量呈上升趨勢。在第6~18 d,CK組和N2-2處理組的還原糖含量均呈上升趨勢,但CK組還原糖含量仍低于N2-2處理組。N2-2處理能有效的延緩小白杏中還原糖含量的降低,使還原糖含量維持在一個較高的水平,保持杏果實的品質。圖3
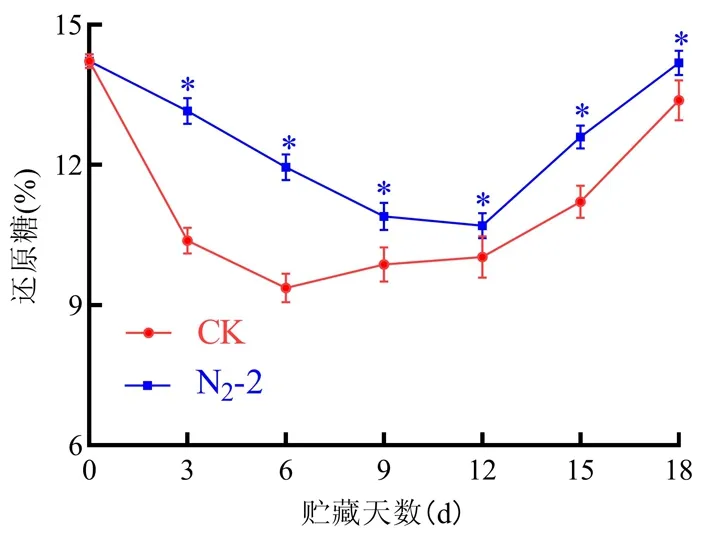
圖3 N2-2處理下小白杏還原
2.4 N2-2對小白杏TA含量的影響
研究表明,在貯藏0~18 d,N2-2處理組和CK處理組的杏果實中TA含量都呈現逐漸下降的變化趨勢,但N2-2處理組中TA含量始終高于CK組,在貯藏第15 d,N2-2處理組和CK組TA含量分別為1.29%、1.01%。N2-2處理能抑制小白杏果實的呼吸強度,減少營養成分的消耗,從而減少TA的消耗,延緩果實衰老。N2-2處理組TA在貯藏0-18 d顯著高于CK組(P<0.05),N2-2處理能有效減緩杏果實貯藏過程中TA含量的下降,較好的保持杏果實的風味。圖4
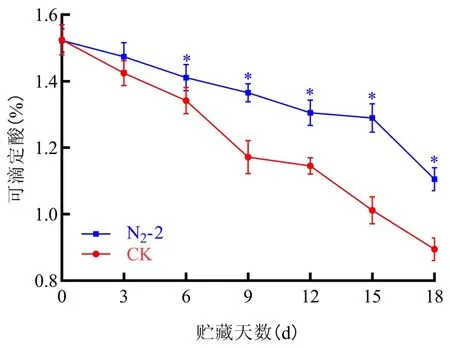
圖4 N2-2處理下小白杏TA含量變化
2.5 N2-2對小白杏糖組分相關酶活性的影響
研究表明,在整個貯藏期間,SPS、SS-Ⅰ、SS酶活性均呈現出先上升后下降的趨勢,其中N2-2處理組SPS、SS-Ⅰ酶活性顯著高于CK組。SPS活性在第9 d時達到最大值,CK組與N2-2處理組分別為371.73、457.14 U/g,其中N2-2處理組酶活性是CK組的1.31倍,貯藏至第18 d時,CK組與N2-2處理組SPS活性分別為194.35、283.39 U/g。SS-Ⅰ酶活性在第12 d時達到最大值,CK組與N2-2處理組最大值分別為220.41、290.85 U/g,其中N2-2處理組SS酶活性是CK組的1.32倍,貯藏至第18 d時,CK組與N2-2處理組SS-I活性分別為132.75、237.31 U/g。貯藏期間,N2-2處理組SS酶活性顯著低于CK組,在第9 d時SS酶活性達到最大值,CK組與N2-2處理組最大值分別為406.58、358.92 U/g,其中CK組SS酶活性是N2-2處理組的1.12倍,貯藏至第18d時,CK組與N2-2處理組SS活性分別為200.81、171.12 U/g。N2-2處理能顯著降低SS酶活性,抑制了杏果實蔗糖的合成,減緩杏果實中蔗糖含量的增加。NI、AI酶活性總體呈現出逐漸上升的趨勢,在第18 d時,NI、AI酶活性達到最大,CK組與N2-2處理組的NI活性最大值分別為182.80、202.18 U/g ,N2-2處理組是CK組的1.11倍。CK組與N2-2處理組的AI活性最大值分別為171.57、214.40 U/g,N2-2處理組是CK組的1.25倍。其中N2-2處理組顯著高于CK組(P<0.01),N2-2處理能顯著提高AI、NI酶活性,促進了葡萄糖和果糖的生成,提高了小白杏貯藏品質。圖5

圖5 N2-2處理下小白杏糖組分相關酶活性變化
3 討 論
葡萄糖、果糖、蔗糖、山梨糖醇是杏果實中的主要可溶性糖[16]。在杏果實發育過程中,杏果實內的葡萄糖、果糖、蔗糖、山梨糖醇、還原糖和可滴定酸的含量均發生明顯變化,杏果實后熟過程中,糖的積累方式會從葡萄糖轉向蔗糖。華北杏在貯藏過程中總糖變化趨勢與蔗糖變化趨勢一致,貯藏前期果糖和葡萄糖含量較高,后期蔗糖含量明顯下降[7],與試驗結果相一致。Geng等[17]對桃的研究表明,桃果實中總糖的含量與蔗糖成正比。山梨糖醇和蔗糖是植物光合作用的產物,在糖代謝過程中,蔗糖合成酶在蔗糖的合成中起到重要作用,蔗糖磷酸合成酶的活性與蔗糖含量的變化趨勢基本一致,蔗糖分解酶、蔗糖轉化酶催化蔗糖分解生成葡萄糖和果糖,且在貯藏期間這一過程不可逆[18]。
果實采后的糖代謝主要受蔗糖代謝相關酶活性的調控,蔗糖代謝相關酶的相互作用很大程度上決定了果實可溶性糖的組成與積累[19-20]。SPS、SS-Ⅰ、SS是調控蔗糖含量變化的3種酶,其酶活性能夠反映出貯藏期間杏果實內部的蔗糖含量變化。研究發現,SS酶活性與蔗糖的生成量呈正相關,其活性能直觀的反映蔗糖合成的能力,N2-2處理組的蔗糖含量低于對照組,而葡萄糖、果糖、還原糖和可滴定酸的含量高于CK組,這可能是N2-2處理抑制了SS酶的活性,減緩了蔗糖的生成量,使得N2-2處理組中蔗糖含量始終低于CK組。同時,N2-2處理能提高AI、NI、SPS酶活性,促進蔗糖的分解,提高果實中葡萄糖和果糖的含量。果實還原糖含量的增加還可能與可溶性酸性轉化酶密切相關,由于高活性的可溶性酸性轉化酶的存在,導致在果實整個果實發育過程中蔗糖含量維持在較低水平[21-22],在杏果實成熟階段,可溶性酸的代謝速率逐漸下降,可溶性酸的含量逐漸減少。山梨糖醇作為光合產物,對杏果實的生長,果實的品質和產量有密切關系[23-24]。杏果實山梨糖醇的含量在整個貯藏過程中逐漸降低,在貯藏至第18 d時,CK組中山梨糖醇的含量降到最低但未完全消失,N2-2處理組的杏果實中山梨糖醇完全消失。在整個貯藏過程中,N2-2處理組中山梨糖醇的含量始終低于CK組,且下降的速率大于CK組,N2-2處理能夠較大程度的促進山梨糖醇的分解,加速葡萄糖和果糖的生成,從而提高小白杏的貯藏品質及其商品價值。
研究只對小白杏中糖類物質含量及調控其代謝的相關酶活性進行研究驗證,后期還需對酸組分及相關酶進行分析,更進一步把握真空預冷結合N2熏蒸處理后小白杏果實中糖酸代謝規律。
4 結 論
杏果實中的可溶性糖類物質為葡萄糖、果糖、蔗糖和山梨糖醇,可溶性酸類物質為可滴定酸。貯藏前期蔗糖、山梨糖醇、還原糖和可滴定酸的含量逐漸減少,葡萄糖、果糖逐漸增加,貯藏結束時,N2-2處理組蔗糖比對照組低12.57%,還原糖和可滴定酸分別比對照組高5.60%和19.06%;N2-2處理組葡萄糖和果糖分別比對照組高13.32%和11.60%。同時,N2-2處理組顯著提高了蔗糖分解酶、中性轉化酶、酸性轉化酶活性,分別比對照組高23.89%、10.89%和13.15%。較高的酶活性促進了蔗糖和山梨糖醇的分解和轉化,提高了小白杏中葡萄糖和果糖的含量。

