γ-聚谷氨酸對(duì)大豆分離蛋白凝膠特性的影響
仵軍紅, 齊 蕾, 謝新華, 李 琴, 朱盈蕊, 朱鴻帥
(鄭州市食品藥品檢驗(yàn)所1,鄭州 450006)
(河南農(nóng)業(yè)大學(xué)食品科學(xué)技術(shù)學(xué)院2,鄭州 450002)
大豆分離蛋白具有凝膠、增稠等功能特性,但在食品工業(yè)中,單一蛋白凝膠強(qiáng)度往往較弱,在性質(zhì)上并不能充分滿足食品加工的需要。有研究利用大豆分離蛋白與大豆可溶膳食纖維結(jié)合,采用TG酶和鈣鹽交聯(lián)形成穩(wěn)定的蛋白凝膠[1];Molina Ortiz等[2]研究發(fā)現(xiàn)κ-卡拉膠可在較低蛋白濃度下加強(qiáng)蛋白分子之間的相互作用,促進(jìn)蛋白凝膠的形成,提高凝膠強(qiáng)度,且在低離子濃度條件下,形成了新型的凝膠網(wǎng)絡(luò)結(jié)構(gòu)。γ-聚谷氨酸(r-PGA)具有優(yōu)良的水溶性及持水性能,也具有增稠及穩(wěn)定作用,對(duì)無機(jī)鹽及糖類的活性均有一定固定作用,γ-PGA溶于水后會(huì)形成具有一定彈性的凝膠[3];Marjan等[4]研究發(fā)現(xiàn)利用γ-PGA帶有陰離子與殼聚糖帶有的陽離子結(jié)合,并添加葡萄糖、蔗糖、山梨醇和甘油作為穩(wěn)定劑形成穩(wěn)定凝膠;有學(xué)者采用γ-PGA和TGase復(fù)合使用可顯著提高雞肉肌原纖維蛋白凝膠的凝膠硬度、彈性和保水性[5];大豆分離蛋白和γ-聚谷氨酸為主要原料,通過乙二醇二縮水甘油醚交聯(lián)的方法制備了一種大豆分離蛋白和γ-聚谷氨酸復(fù)合止血膜[6]。為了解γ-PGA與大豆分離蛋白形成凝膠的特性,在中性條件下構(gòu)建γ-PGA-SPI復(fù)合凝膠體系,對(duì)不同復(fù)合比例下蛋白凝膠微觀結(jié)構(gòu)、持水性、質(zhì)構(gòu)特性以及流變特性進(jìn)行分析,為γ-PGA-SPI復(fù)合凝膠在食品中的應(yīng)用提供參考。
1 材料和方法
1.1 實(shí)驗(yàn)材料
大豆分離蛋白(蛋白質(zhì)質(zhì)量分?jǐn)?shù)為90%)、γ-聚谷氨酸(相對(duì)分子質(zhì)量為70萬)。
1.2 儀器與設(shè)備
5430R高速冷凍離心機(jī),A1激光共聚焦顯微鏡,TA-XY2i質(zhì)構(gòu)儀,DHR-2旋轉(zhuǎn)流變儀。
1.3 實(shí)驗(yàn)方法
1.3.1 γ-PGA-SPI-復(fù)合溶液的制備
分別稱取SPI和γ-PGA溶于蒸餾水中,在室溫下攪拌3 h,調(diào)節(jié)所有復(fù)合溶液的pH至7。選取的實(shí)驗(yàn)條件為蛋白質(zhì)量濃度為10、12 g/100 mL,復(fù)合比r=20、10、5。
1.3.2 γ-PGA-SPI復(fù)合凝膠的制備
參考文獻(xiàn)[7]中的方法并進(jìn)行適當(dāng)修改,將制得的溶液在90 ℃水浴條件下加熱1 h,使SPI充分變性,將加熱后的復(fù)合溶液迅速冷卻至室溫放置1 h,置于4 ℃冰箱中冷藏24 h后進(jìn)行指標(biāo)測定。
1.3.3 γ-PGA-SPI復(fù)合凝膠的微觀結(jié)構(gòu)測定
加入 30 μL 質(zhì)量濃度為0.2 g/100 mL 的羅丹明 B 熒光染料于 1 mL 的復(fù)合溶液中以標(biāo)記蛋白質(zhì),并使用漩渦振蕩器將樣品充分混勻。取 80 μL 混合后的樣品于單凹載玻片中,使用1.3.2 中的處理方式加熱載玻片形成凝膠,采用 4倍物鏡進(jìn)行觀察[8]。
1.3.4 γ-PGA-SPI-復(fù)合凝膠的持水性測定
稱取一定質(zhì)量的γ-PGA-SPI復(fù)合凝膠樣品于離心管中,以3 000 r/min的速度離心30 min,倒去上清液,并用濾紙將水分吸干,再次對(duì)離心管稱質(zhì)量。將未添加γ-PGA的樣品作為對(duì)照組,所有樣品進(jìn)行3次重復(fù)測定,通過公式計(jì)算凝膠的持水性[9]。
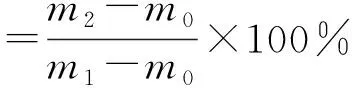
式中:m0為空離心管的質(zhì)量/g;m1為離心前離心管的質(zhì)量/g;m2為除去上清液后離心管的質(zhì)量/g。
1.3.5 γ-PGA-SPI復(fù)合凝膠的流變特性測定
稱取一定質(zhì)量的凝膠樣品,測定凝膠儲(chǔ)能模量(G′)和損耗模量(G″),選用40 mm的平行板,具體參數(shù)設(shè)置如下:通過在1 Hz的固定頻率下在0.01%0.01~100.00%的范圍內(nèi)進(jìn)行應(yīng)變掃描,選定恒定應(yīng)變幅度為0.5%,間隙1 000 μm,頻率為0.1~100.0 Hz,記錄γ-PGA-SPI復(fù)合凝膠的黏彈性隨頻率的變化[10]。
1.3.6 γ-PGA-SPI復(fù)合凝膠的質(zhì)構(gòu)特性測定
將樣品于室溫下平衡1 h,采用TPA對(duì)復(fù)合凝膠的質(zhì)構(gòu)特性進(jìn)行測定[11]。
1.3.7 數(shù)據(jù)分析
使用SPSS16.0對(duì)所得數(shù)據(jù)進(jìn)行統(tǒng)計(jì)分析,用Origin2018進(jìn)行繪圖。
2 結(jié)果與分析
2.1 復(fù)合比對(duì)γ-PGA-SPI復(fù)合凝膠微觀結(jié)構(gòu)的影響
由圖1可知,對(duì)照組的蛋白(圖1中灰色部分是蛋白相,黑色部分是非蛋白相)凝膠球狀空隙較大且分布不均勻,具有蛋白連續(xù)型的微觀結(jié)構(gòu),質(zhì)量分?jǐn)?shù)為12%的蛋白凝膠與質(zhì)量分?jǐn)?shù)為10%的蛋白凝膠相比,球狀空隙較小,可以較好地結(jié)合水分。當(dāng)SPI與γ-PGA復(fù)合比例為20時(shí),2組濃度下的蛋白凝膠與對(duì)照組相比球狀空隙均更為均一,隨著γ-PGA添加比例持續(xù)增大至復(fù)合比為10時(shí),凝膠具有較多數(shù)量尺寸較小且大小均一的球狀空隙,而當(dāng)復(fù)合比為5時(shí),復(fù)合凝膠具有明顯的顆粒狀和粗線狀的微觀結(jié)構(gòu),這種結(jié)構(gòu)較為粗糙,具有明顯的不規(guī)則空隙[12]。其原因可能是在pH 7的條件下,SPI與γ-PGA帶有相同的負(fù)電荷,體系中靜電斥力增大了SPI分子間的距離,使SPI分子間的作用力減弱,在加熱過程中γ-PGA中的多肽鏈隨機(jī)斷裂,暴露出谷氨酸殘基與蛋白質(zhì)分子發(fā)生較大程度的交聯(lián),形成緊密的凝膠網(wǎng)絡(luò)結(jié)構(gòu)[13];但當(dāng)γ-PGA添加過多時(shí),二者之間的過度交聯(lián)也會(huì)減弱凝膠的網(wǎng)絡(luò)結(jié)構(gòu),使凝膠結(jié)構(gòu)逐漸粗化[14]。
2.2 復(fù)合比對(duì)γ-PGA-SPI復(fù)合凝膠持水性的影響
由圖2可知,質(zhì)量分?jǐn)?shù)為12%的蛋白凝膠與質(zhì)量分?jǐn)?shù)為10%的蛋白凝膠相比具有更好的持水性,且復(fù)合凝膠在r=10時(shí)持水性達(dá)到最大,而當(dāng)復(fù)合比,減小到5時(shí),凝膠的持水性能下降,這是因?yàn)槟z的持水性能與其微觀結(jié)構(gòu)相關(guān),且凝膠中較高的蛋白含量可對(duì)水分子有更強(qiáng)的束縛作用[15]。SPI凝膠中球狀空隙較大且分布不均勻,清液易因外力而流出,添加較低濃度的γ-PGA可改善蛋白凝膠的這種微觀結(jié)構(gòu),形成眾多數(shù)量大小均一的球狀空隙,這使得大量水分子被包裹在空隙中,提高了凝膠的持水性能;而當(dāng)γ-PGA添加量持續(xù)增大至復(fù)合比為5時(shí),復(fù)合凝膠的結(jié)構(gòu)進(jìn)一步粗化,形成了具有不規(guī)則空隙的粗糙結(jié)構(gòu),且γ-PGA中的羧基會(huì)與SPI分子中的親水性基團(tuán)競爭性吸水,使蛋白分子結(jié)合水分子的能力減弱[16]。
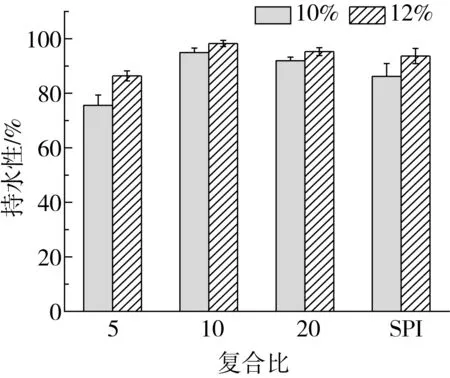
圖2 復(fù)合比對(duì)γ-PGA-SPI復(fù)合凝膠持水性的影響
2.3 復(fù)合比對(duì)γ-PGA-SPI復(fù)合凝膠流變學(xué)特性的影響
由圖3可知,所有樣品的G′和G″均隨頻率的增加而增大,且G′和G″彼此平行,G′始終比G″大,表明樣品具有典型的弱凝膠結(jié)構(gòu)[16]。質(zhì)量分?jǐn)?shù)為12%的蛋白凝膠具有更大的G′和G″且復(fù)合比為10的復(fù)合凝膠其黏彈性模量達(dá)到最大,γ-PGA的進(jìn)一步增加會(huì)降低其G′和G″。其原因可能是高蛋白濃度下
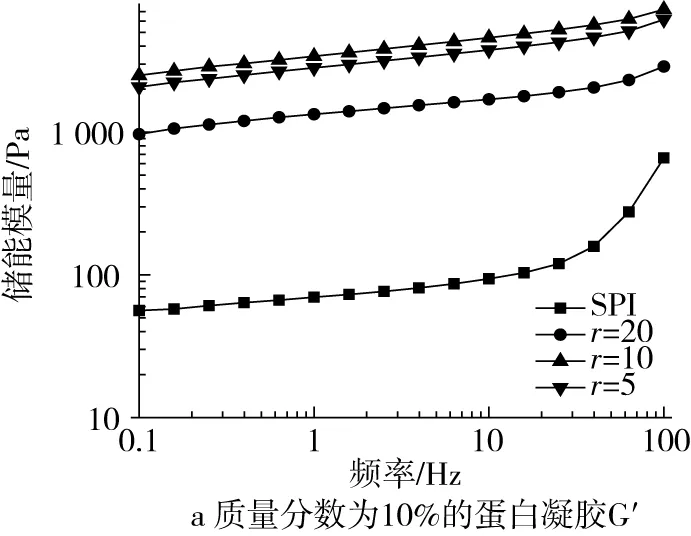
圖3 復(fù)合比對(duì)γ-PGA-SPI復(fù)合凝膠頻率掃描的影響
凝膠網(wǎng)絡(luò)結(jié)構(gòu)更強(qiáng),低濃度γ-PGA的添加對(duì)凝膠網(wǎng)絡(luò)結(jié)構(gòu)的形成具有協(xié)同作用,但較高濃度的γ-PGA不利于凝膠網(wǎng)絡(luò)結(jié)構(gòu)的形成[19]。
2.4 復(fù)合比對(duì)γ-PGA-SPI復(fù)合凝膠質(zhì)構(gòu)特性的影響
由表1可知,質(zhì)量分?jǐn)?shù)為12%的蛋白凝膠與質(zhì)量分?jǐn)?shù)為10%的蛋白凝膠相比具有更大的硬度值,且在這2組蛋白濃度下,SPI與γ-PGA復(fù)合比為10的復(fù)合凝膠均具有最大的硬度值,隨著γ-PGA的持續(xù)增加復(fù)合凝膠硬度值反而降低。這可能是因?yàn)橘|(zhì)量分?jǐn)?shù)為12%的蛋白凝膠中有較多的蛋白分子參與凝膠這一過程,使得凝膠體系強(qiáng)度較大,當(dāng)少量的γ-PGA添加到SPI中,γ-PGA與蛋白分子的交聯(lián)有助于增強(qiáng)凝膠的網(wǎng)絡(luò)結(jié)構(gòu),而較高濃度的γ-PGA會(huì)與蛋白分子過度交聯(lián)破壞凝膠網(wǎng)絡(luò)結(jié)構(gòu),使凝膠強(qiáng)度降低[17,18]。凝膠的彈性、內(nèi)聚性和膠黏性變化趨勢與其硬度數(shù)值相似,可見,在較高濃度蛋白和較低濃度γ-PGA的共同參與下,復(fù)合凝膠質(zhì)構(gòu)性質(zhì)較好。
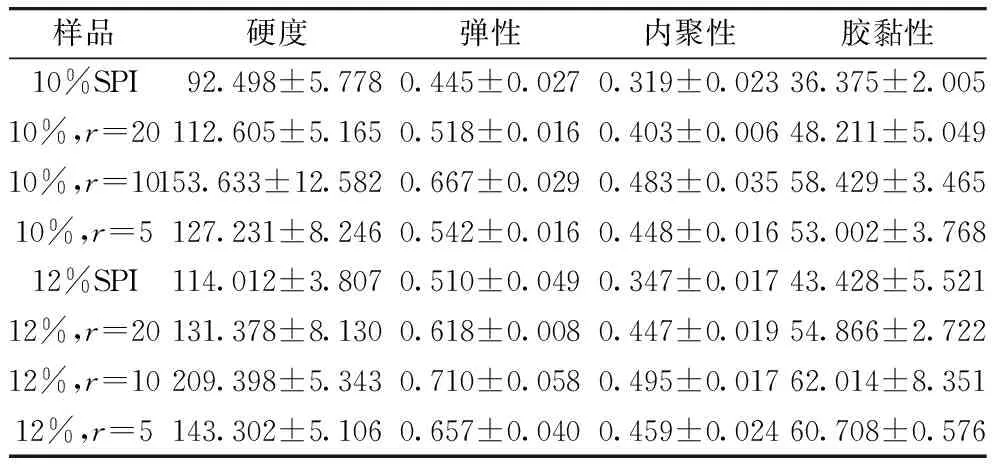
表1 復(fù)合比對(duì)γ-PGA-SPI復(fù)合凝膠質(zhì)構(gòu)特性的影響
3 結(jié)論
研究結(jié)果表明,在質(zhì)量分?jǐn)?shù)為12%的蛋白濃度下有更多的蛋白分子參與凝膠網(wǎng)絡(luò)結(jié)構(gòu)的形成,凝膠結(jié)構(gòu)更為致密,持水性較好,黏彈性較好。在復(fù)合凝膠體系中,當(dāng)SPI與γ-PGA復(fù)合比為10時(shí),形成的凝膠內(nèi)部有數(shù)量眾多、尺寸較小的球狀空隙,凝膠微觀結(jié)構(gòu)越致密均一,其持水性能越強(qiáng),質(zhì)構(gòu)特性和流變學(xué)特性也相應(yīng)提升。γ-PGA與大豆分離蛋白復(fù)合形成凝膠體系,可提高大豆分離蛋白凝膠的強(qiáng)度和持水性,為γ-PGA與大豆分離蛋白形成復(fù)合凝膠在食品中應(yīng)用提供參考。

