體外模擬胃部消化對白蕓豆α-淀粉酶抑制劑活性及結構的影響
姜彩霞, 鄭喜群,, 劉曉蘭, 王俊彤, 趙婉宏, 曾祥瑞
(黑龍江八一農墾大學國家雜糧工程技術中心1,大慶 163319)
(糧食副產物加工與利用教育部工程研究中心2,大慶 163319)
(黑龍江八一農墾大學食品學院3,大慶 163319)
(齊齊哈爾大學食品與生物工程學院4,齊齊哈爾 161006)
糖尿病是一種以高血糖為主要特征的慢性代謝紊亂性疾病[1],其中Ⅱ型糖尿病患者占比在90%以上[2],具有發病率高、并發癥復雜等特性,通常肥胖是糖尿病發展的一個常見驅動因素[3,4]。通過抑制α-淀粉酶的活性從而減少人體對葡萄糖的吸收被認為是Ⅱ型糖尿病治療的有效靶點之一,并具有廣泛的應用前景[5,6]。
白蕓豆(Phaseolusvulgaris) 是一種廣受歡迎的食物,其營養豐富[7]。研究發現白蕓豆含有較高活性的 α-淀粉酶抑制劑(α-AI),能夠有效抑制腸道內 α-淀粉酶活力,可以延遲和部分阻斷碳水化合物的吸收,從而降低血糖水平[8],并具有較高的生物安全性,對糖尿病和肥胖癥具有潛在的治療作用[9]。盡管 α-AI本質上是一種蛋白質,但其對人體內消化酶的水解作用具有高度抗性,如胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶等,說明α-AI可以有效抵抗多種消化酶的水解[10]。尹壽偉[11]研究發現蕓豆種子的主要儲存蛋白球蛋白因其具有獨特的空間結構,在非變性狀態下很難被消化,且清蛋白的蛋白消化率也較低。Rang等[12]研究結果表明白蕓豆種子中α-AI對風味蛋白酶和中性蛋白酶的水解具有高度抗性,同時在pH 3.6~6.0時 α-AI具有良好的溶解性和活性,因此基于酶水解原理提出α-AI制備新工藝。另外,大量研究結果也表明白蕓豆 α-AI具有較強的α-淀粉酶抑制活性和較高的穩定性,但目前對于 α-AI蛋白消化產物的理化性質及結構特征研究較少。本研究在體外模擬胃部消化條件下比較了不同消化時間對白蕓豆 α-AI的抑制活性、粒徑分布、zeta電位及其二級結構的影響,以探究白蕓豆 α-AI的消化特性和對 α-淀粉酶抑制活性的影響機制,為植物蛋白與功能性食品的開發提供技術支持。
1 材料與方法
1.1 材料與儀器
白蕓豆:白沙克,黑龍江墾區蕓豆基地;α-淀粉酶(來源于豬胰腺,50 U/mg)、胃蛋白酶:≥250 U/mg、Ellman試劑(純度99%)、β-巰基乙醇(純度≥99.0%);SDS(優級純)、考馬斯亮藍(R-250,生物染色劑)、標準蛋白Maker(色譜純)、Tris-Glycine緩沖液(色譜純),其他試劑均為分析純。
UV5紫外可見分光光度計,CL6R離心機,RNF-0460卷式膜多功能設備,SCIENTZ-10N真空冷凍干燥機,ZEN3700納米粒度電位儀,FTIR傅里葉變換紅外光譜儀。
1.2 方法
1.2.1 白蕓豆α-AI的制備
參照鐘穎穎等[13]的方法并略作修改。將白蕓豆冷水浸泡12 h,45 ℃烘干粉碎,過60 目篩,按1∶10(m/V)加入pH 6.0水溶液,于35 ℃浸提2.5 h,后5 000 r/min離心20 min取上清,緩慢加入硫酸銨,至其飽和度為70%,并不斷攪拌,鹽析12 h,在4 ℃ 10 000 r/min離心20 min棄上清,沉淀加水復溶,再分別經截留分子質量為50 ku和30 ku的超濾膜超濾處理,取分子質量為30~50 ku超濾液經冷凍干燥后備用,制得α-AI純度約為86%。
1.2.2 體外模擬胃部消化
以白蕓豆α-AI為原料,參照毛小雨等[14]的方法并略有改動。將白蕓豆 α-AI配制成質量濃度25 mg/mL的溶液,與人工胃液按體積比1∶1混合,將混合液的pH調至2.0后加入質量分數為3%的胃蛋白酶,于37 ℃水浴振蕩中反應。分別消化15、30、60、90、120 min。沸水浴10 min終止消化反應,調整溶液pH至7.0,4 ℃下10 000 r/min離心20 min,上清液和沉淀分別冷凍干燥,其中沉淀用于電泳測定。
1.2.3 SDS-PAGE電泳測定
參照文獻[15]并作適當修改。分離膠體積分數為12%,濃縮膠體積分數為5%。將1.2.2中沉淀凍干物溶于0.25 mol/L Tris-HCl緩沖溶液中,煮沸3 min,上樣量為10 μL;電壓值分別為80 V和120 V。膠片經考馬斯亮藍溶液(R-250)中染色1 h,后進行脫色處理。
1.2.4 抑制α-淀粉酶活性的測定
根據文獻[16]的方法,空白對照管中加1.0 mL PBS緩沖溶液(pH 6.9),空白管中加入0.5 mL α-淀粉酶(來源于豬胰腺,6 U/mL),樣品管中加入0.5 mL α-淀粉酶和0.5 mL 樣液(1.2.2中上清液凍干物2 mg/mL),樣品對照管中加入0.5 mL樣液,每管補足 PBS緩沖溶液至1.0 mL,于37 ℃水浴10 min,加入質量分數為1%的可溶性淀粉溶液,反應5 min后立即加入DNS試劑,沸水浴10 min。冷卻后于500 nm波長下測定吸光值。樣品中α-AI對來源于豬胰腺的α-淀粉酶抑制率按式(1)計算。
(1)
式中:A1、A2、A3和A4分別為500 nm下空白對照管、空白管、樣品管和樣品對照管的吸光值。
1.2.5 粒徑分布和Zeta電位測定
將1.2.2中上清液凍干物配制成1 mg/mL溶液,按照納米粒度電位儀操作說明進行粒徑分布和Zeta電位測定。
1.2.6 傅里葉變換紅外光譜測定
稱取1.2.2中上清液消化凍干粉2~3 mg,按1∶100(m/m)加入干燥溴化鉀研磨后壓片,采用傅里葉變換紅外光譜儀在400~4 000 cm-1內進行掃描。
1.2.7 巰基和二硫鍵含量測定
參照戴意強等[17]和Wen等[18]方法分別進行游離巰基和總巰基含量測定,二硫鍵含量公式見式(2)。
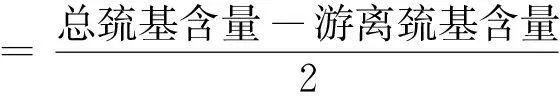
(2)
1.3 數據處理
所有數據均測量3次,以“平均值±標準誤差”表示。使用SPSS 20.0 軟件通過Duncan檢驗和 ANOVA分析數據,5% (P<0.05) 的概率水平被認為具有統計學意義,并利用Origin2017繪圖。
2 結果與分析
2.1 SDS-PAGE電泳分析
經體外模擬胃部消化產物的SDS-PAGE電泳如圖1所示,消化不同時間產物蛋白條帶位置相似,但相較于未經胃部消化的 α-AI亮度降低,說明 α-AI蛋白含量略降低,但隨著消化時間的延長條帶仍較清晰,表明 α-AI組分在該過程中并未完全水解。白蕓豆中 α-AI蛋白的主要亞基分子質量范圍在90~20 ku,其中,α-AI主要存在于清蛋白中,其分子質量為34 ku,與文獻報道接近[19]。α-AI蛋白經超濾處理后在31、27 ku處的亞基條帶可能是凝集素或小分子清蛋白。經胃部消化后 α-AI在31、27 ku處的亞基條帶則可能被水解為分子質量約為20 ku的多肽。
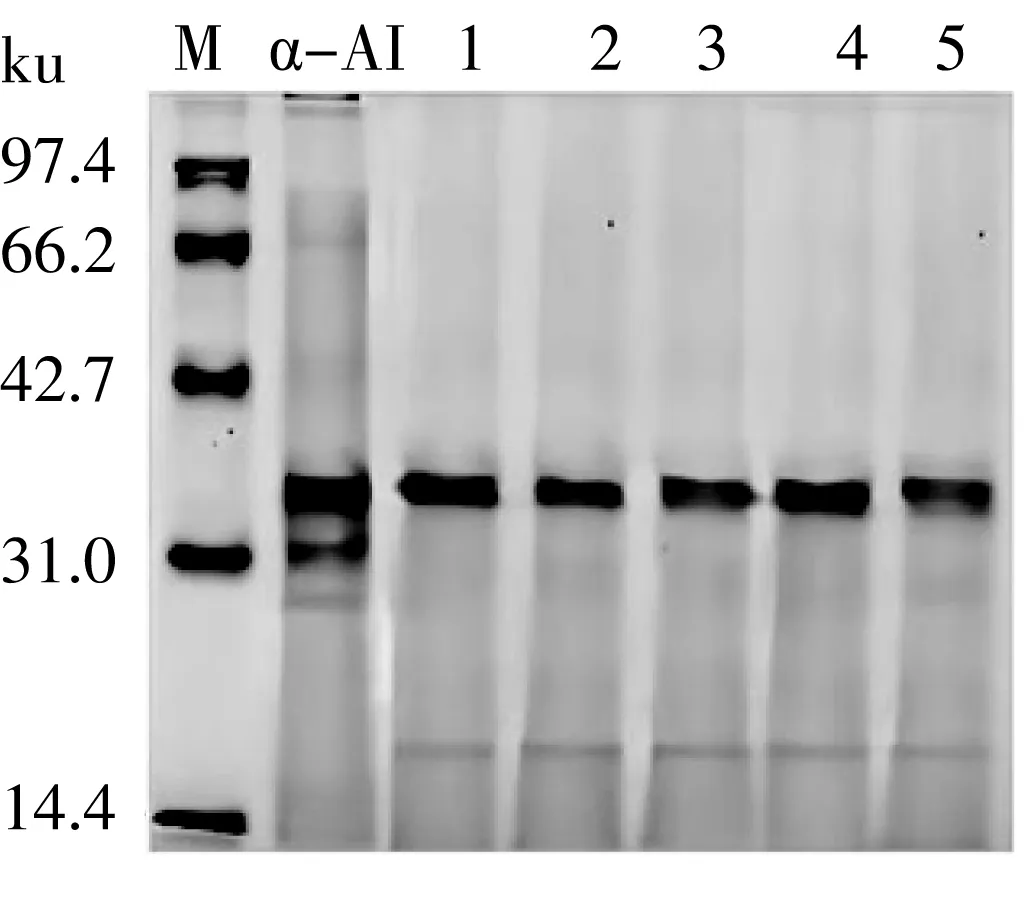
注:M為標準蛋白Marker;白蕓豆α-AI、1~5分別為模擬胃部消化不同時間(0、15、30、60、90、120 min)的消化產物。圖1 模擬胃消化不同時間白蕓豆α-AI的SDS-PAGE電泳圖
2.2 α-AI活性測定
如圖2所示,當體外模擬胃部消化時間大于90 min時產物對 α-淀粉酶的抑制活性顯著增加(P<0.05)。未經胃消化處理的 α-AI對 α-淀粉酶活性抑制率為(84.13±0.67)%,由于胃蛋白酶的酶解作用,消化初始階段 α-AI的抑制率略有降低,但消化60 min時 α-AI抑制率為(84.75±0.51)%,消化120 min時 α-AI抑制率為 α-AI初始抑制率的1.04倍,這可能是由于胃蛋白酶水解了 α-AI蛋白中芳香族氨基酸或酸性氨基酸的氨基所組成的肽鍵,形成的多肽對 α-淀粉酶具有良好的抑制作用[20],讓一峰等[21]研究也發現,α-AI在體內可以較好地發揮其抑制α-淀粉酶的活性。
2.3 α-AI粒徑分布
白蕓豆 α-AI經不同消化時間產物的粒徑分布如圖3所示,α-AI粒徑分布呈單一峰型,說明體系較穩定,α-AI與不同消化時間產物的中位徑(D50)基本都在120~170 nm之間。由于胃蛋白酶和消化液的共同作用蛋白質不斷被酶解,因此消化后產物較未經消化的 α-AI中位徑顯著降低(P<0.05),且隨著消化時間的延長消化產物的D50值也逐漸減小,從大到小依次為 α-AI(165.6 nm)、消化15 min(157.3 nm)、消化30 min(140.6 nm)、消化60 min(125.6 nm)、消化90 min(122.7 nm)和消化120 min(117.5 nm)。同時,經胃部消化后小部分蛋白分子粒徑增加,可能是由于消化作用導致蛋白質分子之間出現聚集現象,其中消化15 min產物的粒徑增加最為明顯,此時產物對α-淀粉酶抑制率也最低(見圖2),進一步說明 α-AI蛋白構象發生了改變。另外,經體外模擬胃部消化產物中出現強度較小的峰,結合SDS-PAGE分析,可能為 α-AI蛋白亞基(分子質量分別為31、27 ku)被水解后形成的多肽。
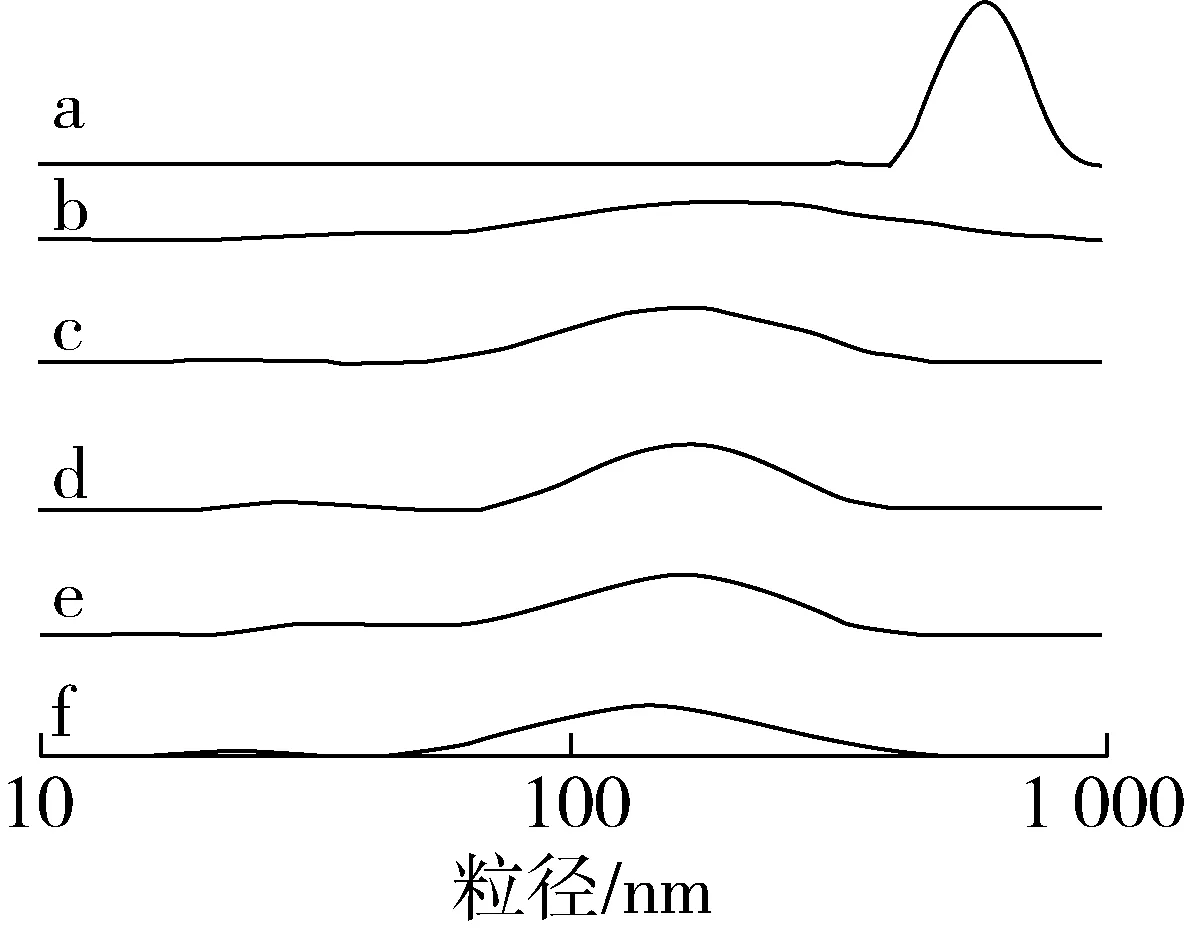
注:a~f分別為白蕓豆α-AI在不同時間(0、15、30、60、90和120 min)消化產物的粒徑分布圖。圖3 模擬胃部消化不同時間白蕓豆α-AI粒徑分布圖
2.4 Zeta電位分析
Zeta電位是反映蛋白溶液穩定性的重要指標之一,一般而言電位的絕對值與粒子之間的相互斥力呈正相關,當電位的絕對值變大時,蛋白的結構更加穩定[22]。白蕓豆 α-AI經不同時間消化產物的Zeta電位值見圖4。α-AI的Zeta電位絕對值為26.8 mV,經體外模擬胃部消化后產物Zeta電位的絕對值顯著降低(P<0.05),說明在胃蛋白酶和消化液的共同作用下蛋白的穩定性降低,當消化時間為30 min和60 min時樣品的Zeta電位絕對值最低,蛋白表面所帶同性電荷較少,由于靜電排斥作用的減少,蛋白質之間發生共價交聯機會增加,體系中蛋白質傾向于相互聚集[23],當消化時間大于90 min時樣品的Zeta電位絕對值顯著增加(P<0.05),此時蛋白表面同性電荷增多,同性電荷間的相互排斥使消化物的穩定性逐漸增強,蛋白分子間的相互聚集作用減弱,對 α-淀粉酶的抑制活性也顯著增加(見圖2),推測α-AI的Zeta電位變化可能與結構變化有關,進而影響其對α-淀粉酶的抑制活性。
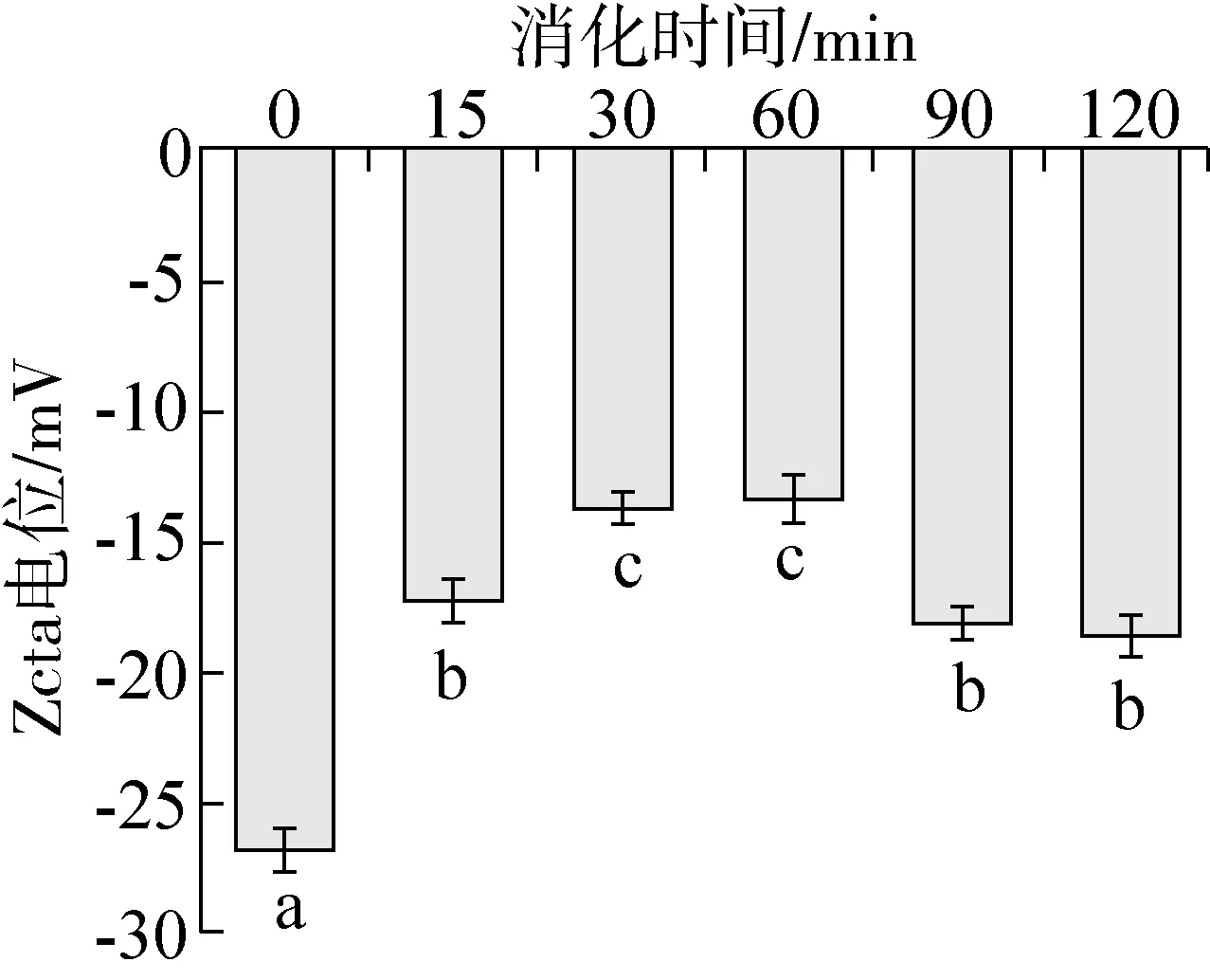
注:字母不同表示差異顯著(P<0.05)。圖4 模擬胃部消化不同時間白蕓豆α-AI的Zeta電位值
2.5 α-AI二級結構分析
傅里葉變換紅外光譜(FTIR)中,蛋白質的二級結構在1 600~1 700 cm-1波段與酰胺Ⅰ帶重合[24],一般情況下不同蛋白質之間存在明顯差異。α-AI經不同時間消化產物的FTIR譜圖經PeakFit軟件去卷積和曲線擬合后得到 α-AI及消化產物的酰胺Ⅰ帶圖譜,利用峰面積計算其二級結構組成。由表1可知,白蕓豆α-AI蛋白二級結構中β-轉角相對含量最多,無規則卷曲和β-折疊次之,與毛小雨等[14]、馮玉超等[25]研究的蕓豆蛋白二級結構中以 β-折疊為主存在明顯不同,說明白蕓豆α-AI蛋白與白蕓豆蛋白的二級結構存在一定的差異,2種蛋白的空間構效像不同。經胃蛋白酶和消化液體外模擬胃部消化反應不同時間,白蕓豆α-AI蛋白二級結構中α-螺旋、β-折疊、β-轉角和無規則卷曲的相對含量大部分均有顯著差異(P<0.05),模擬胃部消化初期,為提高消化產物的穩定性α-AI蛋白二級結構中α-螺旋相對含量有所增加,同時存在多肽鏈反轉180°形成β-轉角[26],消化產物二級結構中β-轉角相對含量增加,無規則卷曲相對含量降低。隨著消化時間的延長α-AI蛋白二級結構中α-螺旋、β-折疊相對含量降低,β-轉角和無規則卷曲相對含量增加。胃部消化使 α-AI蛋白二級結構中無規則卷曲首先展開,形成 α-螺旋和 β-折疊。當消化時間大于30 min時 α-AI蛋白二級結構中 β-折疊的減少以及無規則卷曲的增加都說明消化作用改變了部分蛋白的空間構象,導致蛋白質結構松散,在胃蛋白作用下形成的蛋白多肽更有利于對 α-淀粉酶的抑制作用。
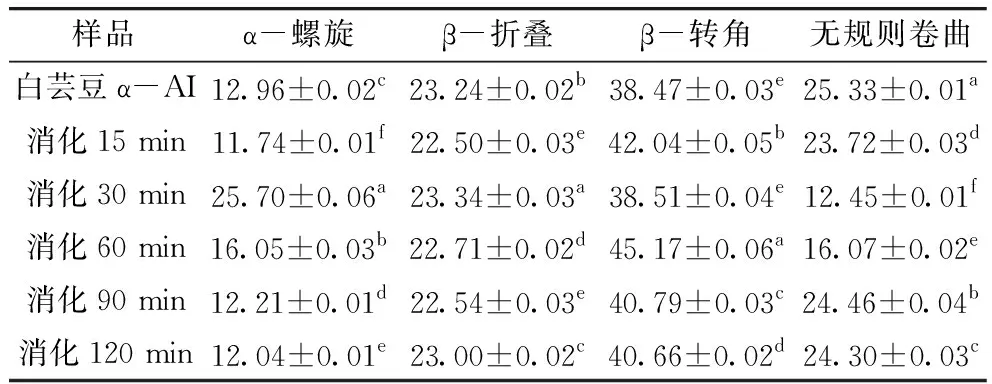
表1 模擬胃部消化不同時間白蕓豆α-AI的二級結構組成/%
2.6 α-AI中巰基和二硫鍵含量測定
巰基是蛋白質中最具活性的官能團,巰基發生氧化反應產生的二硫鍵可作為穩定蛋白質構象的一種重要的共價鍵,有助于維持蛋白質的三維空間結構[27]。α-AI蛋白在模擬胃部消化不同時間巰基(總巰基、游離巰基)和二硫鍵含量如圖5所示。由于胃蛋白酶及消化液的共同作用,反應初期 α-AI蛋白中巰基和二硫鍵含量顯著降低(P<0.05),但隨著消化時間延長,α-AI蛋白分子間的交互和聚集現象不斷加劇,部分巰基發生氧化形成二硫鍵,因此 α-AI蛋白中總巰基和二硫鍵含量略有升高,游離巰基含量無顯著變化。結果表明,α-AI蛋白經胃部消化后蛋白結構變得松散,但當消化時間大于60 min時消化產物的穩定性有所提升,仍可以較好地發揮其抑制 α-淀粉酶的活性。
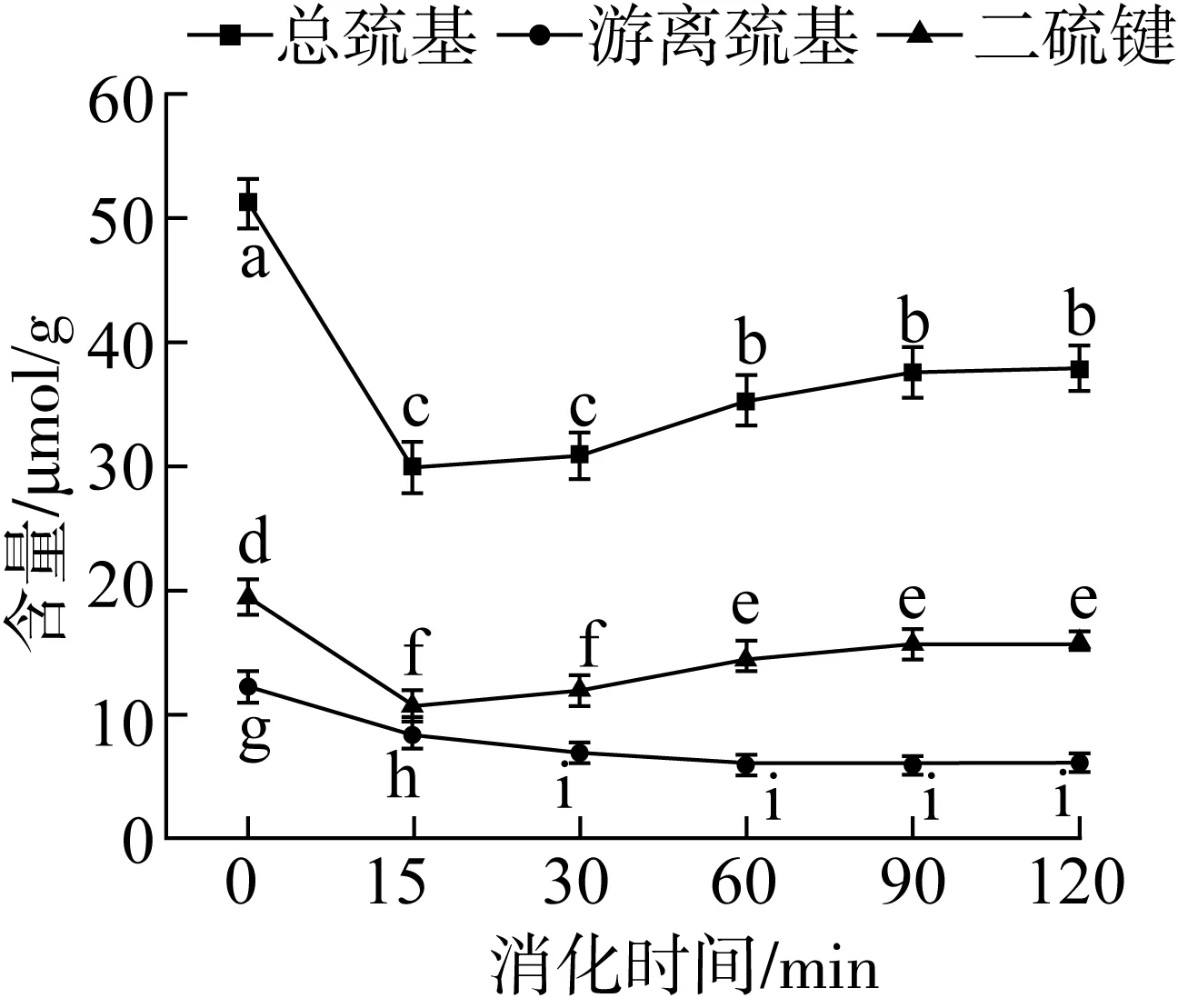
注:同一指標字母不同表示差異顯著(P<0.05)。圖5 模擬胃部消化不同時間白蕓豆α-AI巰基和二硫鍵含量
3 結論
白蕓豆α-AI主要以清蛋白的形式存在,經體外模擬胃部消化后α-AI蛋白可能存在部分亞基水解成多肽,對α-淀粉酶的抑制活性顯著增加。消化產物粒徑顯著降低,但其穩定性逐漸增強。α-AI蛋白消化產物二級結構中β-轉角相對含量增加,無規則卷曲相對含量降低,總巰基、游離巰基含量均顯著降低,二硫鍵含量顯著升高。另外,研究發現 α-AI的Zeta電位變化可能與其對α-淀粉酶的抑制活性有關。隨著現代生物技術的不斷發展,α-淀粉酶抑制劑的應用前景將更加廣闊,對其消化產物的性質分析具有十分重要的意義,并對進一步分析其在人體內的轉運吸收路徑提供一定的借鑒。

