COPD合并肺動脈高壓患者血清ROCK1、AgRP水平及臨床意義
王麗萍,溫春生,張俁,王恩光,周艷
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是臨床最常見的慢性氣道疾病,肺動脈高壓(pulmonary hypertension,PH)是COPD患者常見并發癥,也是導致患者死亡的重要原因[1-3]。早期識別COPD合并PH對病情控制至關重要。研究表明,炎性反應參與PH發生發展[4]。Rho關聯含卷曲螺旋蛋白激酶1(Rho associated coiled-coil containing protein kinase 1,ROCK1)是一種蛋白絲氨酸/蘇氨酸激酶,能通過調節多條信號通路促進炎性反應發生發展[5]。實驗報道,抑制ROCK1能減輕缺氧性PH大鼠肺動脈壓力和右心室肥厚[6]。刺鼠相關神經肽(agouti related neuropeptide,AgRP)是一種神經肽,能通過調節機體代謝穩態和能量平衡抑制炎性反應,蛋白質陣列鑒定發現,AgRP蛋白在COPD合并PH患者血清中低表達[7]。目前關于血清ROCK1、AgRP水平對COPD合并PH患者的臨床意義報道較少,本研究探討COPD合并PH患者血清ROCK1、AgRP水平與肺功能、炎性因子的關系及對COPD合并PH的評估價值,以期為改善COPD患者預后提供參考依據,報道如下。
1 資料與方法
1.1 臨床資料 選取2020年1月—2022年7月新疆醫科大學第五附屬醫院呼吸與危重癥科收治COPD患者150例為COPD組,男89例,女61例,年齡33~85(64.28±9.67)歲;體質量指數17.52~28.02(22.93±1.93)kg/m2;根據是否合并PH將COPD組分為PH亞組39例和非PH亞組111例。另選取同期醫院體檢健康志愿者60例為健康對照組,男35例,女25例,年齡27~81(62.85±9.77)歲,體質量指數18.17~27.13(22.74±2.01)kg/m2, 2組一般資料比較差異無統計學意義(P>0.05),具有可比性。本研究獲得醫院倫理委員會批準(KY2020031021),受試者及家屬知情同意并簽署知情同意書。
1.2 病例選擇標準 (1)納入標準:①符合《慢性阻塞性肺疾病基層診療指南(2018年)》[8]COPD診斷標準;②年齡≥18歲;③病例資料完整。(2)排除標準:①合并肺結核、支氣管哮喘等其他肺部疾病;②合并造血、免疫、精神系統損害、惡性腫瘤、嚴重心肝腎功能損害;③胸部、心臟、肺部手術史;④長期濫用藥物或有藥物依賴史;⑤其他疾病、血栓、手術等其他原因所致PH;⑥機械瓣膜、右心血栓、近期植入起搏器導線、嚴重心律失常、嚴重低血氧等右心導管檢查禁忌證[9]。
1.3 肺動脈高壓(PH)診斷標準 COPD患者入院后使用X射線多功能檢測儀(德國IBA,型號:MagicMax Universal)行右心導管檢查術,測量患者靜息時肺動脈平均壓,參考《中國肺高血壓診斷和治療指南2018》[10]將肺動脈平均壓≥25 mmHg(1 mmHg=0.133 kPa)診斷為PH。
1.4 觀測指標與方法
1.4.1 血清ROCK1、AgRP水平檢測:于患者入院次日晨和健康對照組體檢時采集空腹肘靜脈血3 ml,離心取上層血清備用,采用酶聯免疫吸附法(武漢益普生物科技有限公司,試劑盒貨號:MM15121H2、MM-1159H2MM-0181H1)檢測ROCK1、AgRP。
1.4.2 血清炎性因子水平檢測:上述血清采用酶聯免疫吸附法(武漢益普生物科技有限公司,試劑盒貨號:MM15121H2、MM-1159H2MM-0181H1、MM-0049H1、MM-1558H2、MM-0122H2)檢測白介素(interleukin,IL)-1β、IL-6、IL-8、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)水平。
1.4.3 肺功能檢查:所有研究對象入院后使用肺功能儀(北京麥邦光電儀器有限公司,型號:MAS-99)測量第1秒用力呼氣容積(forced expiratory volume in one second,FEV1)、用力肺活量(forced vital capacity,FVC)和使用支氣管舒張劑后FEV1占預計值百分比(FEV1%),并計算FEV1/FVC比值。
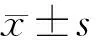
2 結 果
2.1 2組血清ROCK1、AgRP和肺功能指標比較 COPD組血清ROCK1水平高于健康對照組,AgRP水平和FEV1%、FEV1/FVC低于健康對照組(P<0.01),見表1。
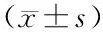
表1 健康對照組與COPD組血清ROCK1、AgRP和肺功能指標比較Tab.1 Comparison of serum ROCK1, AgRP, and lung function indicators between the healthy control group and the COPD group
2.2 2組血清炎性因子水平比較 COPD組血清IL-1β、IL-6、IL-8、TNF-α水平高于健康對照組(P<0.05),見表2。
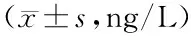
表2 健康對照組與COPD組血清炎性因子水平比較Tab.2 Comparison of serum inflammatory factor levels between healthy control group and COPD group
2.3 2亞組臨床資料比較 2亞組患者性別、年齡、體質量指數(BMI)、吸煙史、病史比較差異無統計學意義(P>0.05)。PH亞組血清ROCK1、IL-1β、IL-6、IL-8、TNF-α水平高于非PH亞組,AgRP水平和FEV1%、FEV1/FVC低于非PH亞組(P<0.01),見表3。

表3 非PH亞組與PH亞組臨床資料比較Tab.3 Comparison of clinical data between non-PH subgroups and PH subgroups
2.4 血清ROCK1、AgRP與肺功能指標和炎性因子的相關性 Pearson/Spearman相關性分析顯示,COPD合并PH患者血清ROCK1與FEV1%、FEV1/FVC呈負相關,與IL-1β、IL-6、IL-8、TNF-α呈正相關(P<0.01);AgRP與FEV1%、FEV1/FVC呈正相關,與IL-1β、IL-6、IL-8、TNF-α呈負相關(P<0.05),見表4。

表4 COPD合并PH患者血清ROCK1、AgRP與肺功能指標和炎性因子的相關性Tab.4 Correlation between serum ROCK1,AgRP,lung function indicators,and inflammatory factors in patients with COPD and PH
2.5 COPD合并PH的多因素Logistic回歸分析 以COPD合并PH為因變量(賦值:是為“1”,否為“0”),以上述結果中P<0.05項目為自變量進行多因素Logistic回歸分析,結果顯示,FEV1%高、FEV1/FVC高、AgRP高為COPD患者合并PH的獨立保護因素,IL-1β高、IL-6高、IL-8高、TNF-α高、ROCK1高為獨立危險因素(P<0.05),見表5。

表5 Logistic回歸分析COPD合并PH的危險因素Tab.5 Logistic regression analysis of risk factors for COPD combined with PH
2.6 血清ROCK1、AgRP水平預測COPD合并PH的價值 繪制血清ROCK1、AgRP水平預測COPD合并PH價值的ROC曲線,并計算曲線下面積(AUC),結果顯示,血清ROCK1、AgRP水平單獨與二項聯合預測COPD合并PH的AUC分別為0.777、0.769、0.853, 二項聯合的AUC高于單項預測(Z=2.410、2.598,P=0.016、0.009),見表6和圖1。

圖1 血清ROCK1、AgRP水平評估COPD合并PH的ROC曲線Fig.1 Receiver operating characteristic of COPD combined with PH evaluated by serum ROCK1 and AgRP levels

表6 血清ROCK1、AgRP水平預測COPD合并PH的價值Tab.6 Value of serum ROCK1 and AgRP levels in predicting COPD combined with PH
3 討 論
COPD是一種異質性肺部病變,以持續性、進行性加重的氣流受限和相應呼吸系統癥狀為主要特征。隨著病情進展,慢性缺氧可引起肺小動脈缺氧性收縮和內皮細胞功能障礙,通過增加肺血管阻力導致PH發生,持續PH可增加右心后負荷,進而引起慢性肺源性心臟病和右心衰竭,嚴重威脅患者生命安全[11]。目前臨床針對COPD合并PH尚無特異性治療方法,仍以治療COPD為主,常規血管擴張劑靶向藥物會進一步抑制低氧引起的肺血管收縮,加劇COPD患者低血氧癥狀,導致COPD合并PH患者預后較差[12]。因此還需探索COPD合并PH相關機制,對促進COPD合并PH早期識別和患者預后改善具有重要意義。
炎性反應是COPD發生發展的重要機制,在COPD發病前患者吸入有毒有害氣體或顆粒可激活炎性細胞,釋放炎性介質并作用于氣道和/或肺泡,引起氣道重塑和氣流受限導致COPD發生,COPD發病后持續炎性反應能損傷肺動脈內皮細胞引起肺血管重塑(肥大或增生使血管壁增厚),導致肺血管阻力增加而引起PH[13]。FEV1%、FEV1/FVC降低是COPD患者肺功能下降的重要指標,COPD合并PH后由于肺通氣功能進一步下降可導致FEV1%、FEV1/FVC進一步降低[4]。IL-1β、IL-6、IL-8、TNF-α等系統性炎性因子是COPD炎性標志物,合并PH的COPD患者因肺組織炎性反應加重可進一步升高IL-1β、IL-6、IL-8、TNF-α水平[14]。本研究結果顯示,COPD患者FEV1%、FEV1/FVC降低,血清IL-1β、IL-6、IL-8、TNF-α水平升高,而合并PH的患者在COPD基礎上進一步降低/升高,符合COPD合并PH患者病情變化。
Rho/ROCK信號通路是機體普遍存在的一條信號轉導通路,ROCK1是Rho最重要的下游靶效應分子,主要表達于肺、腎、肝、脾等器官,激活后能活化Rho/ROCK信號通路產生多種生物學效應[15]。目前研究表明ROCK1在炎性反應方面發揮重要作用,能激活Toll樣受體4、核因子κB等炎性信號通路促進炎性反應發生發展,抑制ROCK1可抑制炎性反應[16-17]。Liu等[18]實驗報道,抑制ROCK1信號傳導能減輕COPD小鼠和大鼠氣道阻塞與炎性反應。Penumatsa等[19]實驗報道,肺血管平滑肌上ROCK1高表達能促進肺血管平滑肌收縮和重塑。上述研究提示,ROCK1或可成為干預COPD合并PH的靶點。本研究結果顯示,COPD患者血清ROCK1水平升高,是COPD合并PH的獨立危險因子,這提示血清ROCK1水平升高參與COPD合并PH發生過程。分析其機制可能是ROCK1升高能激活炎性信號通路促進炎性反應,引起肺血管重塑,進而導致PH風險增加。肺動脈平滑肌細胞過度增殖和遷移是肺血管重塑的標志[4]。Zhao等[20]研究報道,ROCK1在缺氧誘導的肺動脈平滑肌中升高,能激活活化T細胞的核因子3促進炎性反應,進而促進肺動脈平滑肌細胞過度增殖和遷移。本研究結果也顯示,COPD合并PH患者血清ROCK1水平與FEV1%、FEV1/FVC呈負相關,與IL-1β、IL-6、IL-8、TNF-α呈正相關,說明血清ROCK1水平升高與COPD合并PH患者肺功能降低和炎性反應有關。
神經肽是存在于神經組織并參與神經系統功能的內源性活性物質,其作用廣泛且復雜,對機體多種生理功能調節具有重要作用,也能通過向中樞和外周神經、免疫系統發出信號,參與COPD發生發展[21]。AgRP又稱神經肽Y,最初研究發現其是由下丘腦AgRP神經元分泌的一種神經肽,能調節糖脂代謝、產熱、攝食等過程,是代謝穩態和能量平衡的調節中樞[22]。近年研究發現,AgRP還是一種免疫調節劑,能結合AgRP Y1/Y2受體抑制介導免疫炎性反應的各種信號通路,包括絲裂原活化蛋白激酶、環氧合酶-2、核因子-κB、Toll樣受體等,發揮抗炎作用[23]。Taniguchi等[24]研究報道,AgRP在COPD小鼠氣道上皮中表達減少,上調AgRP能減輕COPD小鼠氣道炎性反應和肺氣腫。本研究結果顯示,COPD患者血清AgRP水平降低,AgRP高是COPD合并PH的獨立保護因子,這提示血清AgRP水平降低參與COPD合并PH發生過程。分析其機制可能是AgRP升高能抑制炎性信號通路減輕炎性反應誘導的肺血管重塑,進而降低PH風險和提升肺功能。有實驗表明,AgRP能結合Y1受體抑制PH小鼠肺血管收縮和肺動脈平滑肌細胞增殖,減輕PH[25]。本研究結果也顯示,COPD合并PH患者血清AgRP水平與FEV1%、FEV1/FVC呈正相關,與IL-1β、IL-6、IL-8、TNF-α呈負相關,說明血清AgRP水平降低與COPD合并PH患者肺功能降低和炎性反應有關。
本研究ROC曲線分析顯示,血清ROCK1聯合AgRP評估PH的AUC為0.853,較血清ROCK1、AgRP水平單獨評估顯著增加,說明檢測血清ROCK1、AgRP水平可能有助于臨床早期發現COPD合并PH高風險患者,指導臨床及時干預和治療,改善患者預后。
綜上所述,血清ROCK1水平降低和AgRP水平升高與COPD合并PH獨立相關,可能通過炎性反應參與COPD合并PH發展,血清ROCK1聯合AgRP評估COPD合并PH的價值較高,可能成為COPD合并PH的輔助診斷指標。但本研究結果還需進一步證實。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
王麗萍:設計研究方案,實施研究過程,論文撰寫;溫春生:設計論文框架;張俁:進行文獻調研與整理;王恩光、周艷:參與文章撰寫

