AHP-熵權法結合Box-Behnken設計-響應面法優選黃精酒制工藝及其炮制前后藥效對比研究
石雙慧,王夢琳,魏曉彤,馬思媛,胡宇峰,張婧秋,王慧楠,陳夢雨,劉芊芊,王英姿
AHP-熵權法結合Box-Behnken設計-響應面法優選黃精酒制工藝及其炮制前后藥效對比研究
石雙慧,王夢琳,魏曉彤,馬思媛,胡宇峰,張婧秋,王慧楠,陳夢雨,劉芊芊,王英姿*
北京中醫藥大學中藥學院,北京 102488
優化酒黃精wine-processed的高壓蒸制工藝,確定最佳工藝參數,并對酒制前后刺激性、免疫調節及降血糖作用進行研究。以潤制時間、蒸制壓力、蒸制時間和燜制時間作為考察因素,以性狀、黃精多糖、薯蕷皂苷元、水浸出物、醇浸出物和5-羥甲基糠醛(5-hydroxymethylfurfural,5-HMF)作為考察指標,運用AHP-熵權法結合Box-Behnken設計-響應面法(Box Behnken design-response surface methodology,BBD-RSM)確定酒黃精炮制工藝條件參數。通過家兔眼刺激性實驗,評價黃精酒制前后的刺激性作用。通過ip環磷酰胺建立小鼠免疫抑制模型,比較黃精酒制前后對免疫調節作用的影響。通過飼喂高脂高糖飼料、ip鏈脲佐菌素建立糖尿病小鼠模型,比較黃精酒制前后對降血糖作用的影響。酒黃精炮制最佳工藝參數為潤制時間5 h、蒸制時間1 h、蒸制壓力0.06 MPa、燜制時間7 h。藥效實驗結果表明,生黃精具有刺激性,黃精酒制后對黏膜的刺激作用減弱,酒黃精提高小鼠免疫力和降血糖的作用均強于生黃精。優選出的酒黃精炮制工藝穩定、合理、可行,按照此工藝制備的酒黃精,可以降低其刺激性,增強免疫調節作用和降血糖作用,為黃精的炮制工藝研究和臨床用藥提供參考。
AHP-熵權法;Box-Behnken設計-響應面法;酒黃精;炮制工藝;刺激性;免疫調節;降血糖作用;薯蕷皂苷元;5-羥甲基糠醛
黃精為百合科黃精屬植物滇黃精Coll. et Hemsl.、黃精Red.或多花黃精Hua的干燥根莖,具有補氣養陰、健脾、潤肺、益腎的功效[1]。黃精生品直接服用刺人咽喉,酒制可去除其刺激性,增強補脾潤肺、益腎的功效[2-5]。《中國藥典》2020年版黃精項下收錄了酒黃精飲片,但對于其具體炮制參數描述均較為籠統,而且目前各地炮制標準對于酒黃精的炮制工藝不統一,影響臨床療效,因此,建立符合《中國藥典》規范及臨床要求的酒黃精飲片的炮制工藝非常必要。
現代研究表明,與常壓蒸制相比,酒黃精高壓蒸制不僅便于控制溫度、時間等影響因素,極大地縮短炮制時間,同時還可以減少活性成分的流失,增強療效[6-8]。多糖在黃精中含量最高,是《中國藥典》2020年版規定的評價黃精質量的重要指標,也是黃精發揮免疫調節作用最重要最主要的功能性成分。皂苷是黃精中另一主要藥效成分,目前,對皂苷類成分的研究主要集中于薯蕷皂苷元[9-12]。5-羥甲基糠醛(5-hydroxymethylfurfural,5-HMF)是黃精炮制過程中的副產物,既有藥理活性又有毒理性[13-16]。黃精炮制后的外觀性狀常作為傳統鑒別手段,浸出物體現了藥材整體含量水平。因此,本實驗對酒黃精的炮制工藝研究過程中,以湖南產多花黃精為研究對象,選擇性狀、黃精多糖、薯蕷皂苷元、水浸出物、醇浸出物和5-HMF為質量控制指標,首先采用單因素法優選酒黃精飲片炮制工藝,再采用層次分析法(analytic hierarchy process,AHP)-熵權法結合Box-Behnken設計-響應面法(Box-Behnken design-response surface method,BBD-RSM)優選多花黃精高壓蒸制工藝參數并進行驗證,同時對黃精酒制前后的刺激性、免疫調節作用和降血糖作用進行研究,為建立穩定可控的酒黃精飲片炮制工藝提供參考依據。
1 儀器與材料
1.1 儀器
BSI10S型萬分之一電子天平,賽多利斯科學儀器有限公司;YX-280D型數顯手提式滅菌器,容積18 L,合肥華泰醫療設備有限公司;QM-Q5-Y30DW型電蒸鍋,長沙市全民電器有限公司;DHG-9030A型電熱恒溫鼓風干燥箱,北京北方利輝實驗儀器設備有限公司;KH7200DB型數控超聲波清洗機,昆山禾創超聲儀器有限公司;UltiMate 3000型高效液相色譜儀,美國賽默飛世爾科技有限公司;756PC型紫外-可見分光光度計,舜宇恒平科學儀器有限公司;HW.SY21-KP6型智能恒溫水浴鍋,北京市長風儀器儀表公司;ZN-02型粉碎機,北京興時利和科技發展有限公司;A015型多功能酶標儀,Molecular Devices;XN-1000V[B1]型血液系統分析儀,德國賽多利斯(北京)儀器有限公司;ACCU-CHEK型血糖儀,德國Roche公司;AU680型自動生化分析儀,美國Beckman Coulter公司。
1.2 材料
黃精藥材,批號2020042401,購于新邵南陌生物科技有限公司,經北京中醫藥大學劉春生教授鑒定,植物基原為百合科黃精屬植物多花黃精Hua的干燥根莖,驗證試驗3批藥材批號分別為2020042402、2020042403、2020042404。黃酒,批號20180812,酒精度≥15.5% vol,購自會稽山紹興酒股份有限公司。
對照品薯蕷皂苷元(批號C10J9Q52616,HPLC測定質量分數≥98%)、無水葡萄糖(批號S22J12H137237,質量分數≥98%)、5-HMF(批號Z25N8B49010,HPLC測定質量分數≥98%)及試劑環磷酰胺(批號X13J11Y115691)、鹽酸左旋咪唑(批號Y23M9C56327)、印度墨水(批號L17S11G124902)、鏈脲佐菌素(批號S17049)、二甲雙胍(批號B15A11D121557)、檸檬酸-檸檬酸鈉緩沖液(批號S30GR162949),均購自上海源葉生物科技有限公司,質量分數均≥98%。氯化鈉注射液,批號2007091901,購自石家莊四藥有限公司。無水碳酸鈉(批號20191019)、鹽酸(批號20190426),均分析純,購自北京化工廠。乙腈(批號164793)、甲醇(批號165503),均為色譜級,購自美國賽默飛世爾科技公司。
1.3 動物
健康雄性新西蘭兔6只,體質量2.0~2.5 kg,由中國食品藥品檢定研究院提供,動物許可證號SYXK(京)2017-0005,適應性飼養3 d后進行試驗。SPF級健康BALB/c系小鼠,雌雄各半,體質量(20±2)g,購自斯貝福北京動物科技有限公司,動物許可證號SYXK(京)2020-0033,適應性喂養7 d后開始實驗。SPF級健康雄性C57BL/6系小鼠,體質量(20±2)g,購自斯貝福北京動物科技有限公司,動物許可證號SYXK(京)2020-0033。本研究通過北京中醫藥大學實驗動物倫理委員會的批準,批準號BUCM-4-2022092704-3106。
2 方法與結果
2.1 酒黃精炮制工藝
取100 g黃精原藥材,加20 g黃酒拌勻(黃酒用量按照《中國藥典》2020年版[1]黃精項下酒黃精飲片,“每100 kg黃精,用黃酒20 kg”),潤制一定時間,置于高壓滅菌器中在一定蒸制壓力下蒸制一定時間后,常壓燜制一定時間,稍晾,切厚片(2~4 mm),60 ℃鼓風干燥,即得酒黃精飲片。
2.2 黃精多糖含量測定
依據《中國藥典》2020年版一部黃精項下黃精多糖測定方法進行測定[1]。
2.2.1 對照品溶液的制備 精密稱取無水葡萄糖對照品適量,加水溶解,配制成質量濃度為0.33 mg/mL的對照品溶液。
2.2.2 供試品溶液的制備 精密稱取黃精不同炮制品細粉0.25 g,置圓底燒瓶中,加80%乙醇150 mL,置水浴中加熱回流1 h,趁熱濾過,殘渣用80%熱乙醇洗滌3次,每次10 mL,將殘渣及濾紙置燒瓶中,加水150 mL,置沸水浴中加熱回流1 h,趁熱濾過,殘渣及燒瓶用熱水洗滌4次,每次10 mL,合并濾液與洗液,放冷,轉移至250 mL量瓶中,加水至刻度,搖勻,即得供試品溶液。
2.2.3 線性關系考察 精密量取對照品溶液0.1、0.2、0.3、0.4、0.5、0.6 mL,分別置10 mL具塞刻度試管中,各加水至2.0 mL,搖勻,在冰水浴中緩緩滴加0.2%蒽酮-硫酸溶液至刻度,混勻,放冷后置水浴中保溫10 min,取出,立即置冰水浴中冷卻10 min,取出,以相應試劑為空白,測定待測溶液的吸光度()值。以值為縱坐標(),質量濃度為橫坐標(),繪制標準曲線,進行線性回歸,得到無水葡萄糖對照品線性回歸方程為=0.007 5+0.045 7,2=0.999 5。結果表明,無水葡萄糖在16.50~99.20 μg/mL與值呈良好的線性關系。
2.2.4 樣品測定 精密稱取黃精不同炮制品粉末,按照“2.2.2”項下方法制備供試品溶液,精密量取1 mL,置10 mL具塞干燥試管中,按照“2.2.3”項下方法測定值,根據標準曲線計算供試品溶液中多糖含量。
2.3 薯蕷皂苷元的含量測定[17-21]
2.3.1 對照品溶液的制備 精密稱取薯蕷皂苷元對照品適量,加甲醇溶解,配制成質量濃度為0.41 mg/mL的對照品溶液。
2.3.2 供試品溶液的制備 精密稱取過4號篩的黃精不同炮制品粉末2 g,置于錐形瓶中,加50 mL無水乙醇,稱定質量,水浴回流提取4 h,放置室溫后再次稱定質量,用無水乙醇補足減失的質量,搖勻,濾過。取續濾液20 mL,旋干,殘渣加3 mol/L的鹽酸溶液80 mL,沸水浴水解4 h,冷卻后分別用20、10、10 mL石油醚萃取3次,合并萃取液,加20 mL水洗滌2次,減壓濃縮后留取殘渣,加甲醇溶解定容至1 mL量瓶中,用0.45 μm微孔濾膜濾過,即得供試品溶液。
2.3.3 色譜條件 色譜柱為GL Science Incnsil ODS-3 C18(250 mm×4.6 mm,5 μm);流動相為乙腈-水(94∶6);檢測波長203 nm;體積流量1 mL/min;柱溫25 ℃;進樣量10 μL。對照品和樣品的色譜圖見圖1。
2.3.4 線性關系考察 取“2.3.1”項下薯蕷皂苷元對照品,稀釋成不同質量濃度梯度的系列對照品溶液,按照“2.3.3”項下色譜條件進行測定,以峰面積積分值為縱坐標(),質量濃度為橫坐標(),繪制標準曲線,進行線性回歸,得薯蕷皂苷元線性回歸方程為=3.738 4+23.256 0,2=0.999 3,結果表明薯蕷皂苷元在1.71~16.80 μg/mL與峰面積積分值線性關系良好。
2.3.5 精密度考察 取“2.3.1”項下薯蕷皂苷元對照品溶液,按照“2.3.3”項下色譜條件連續進樣6次,測定峰面積,計算其RSD值為0.75%,表明儀器精密度良好。
2.3.6 重復性考察 精密稱定BBD-RSM試驗第19號酒黃精樣品粉末6份,按“2.3.2”項下方法制備供試品溶液,按照“2.3.3”項下色譜條件測定峰面積,計算薯蕷皂苷元質量分數的RSD值為2.10%,重復性良好。
2.3.7 穩定性考察 精密稱定BBD-RSM試驗第19號酒黃精樣品粉末,按“2.3.2”項下方法制備供試品溶液,按照“2.3.3”項下色譜條件分別在制備后0、2、4、6、8、10、12 h進樣,測定峰面積,計算其RSD值為1.81%,表明供試品溶液在12 h內具備良好的穩定性。
2.3.8 加樣回收率考察 取已測知薯蕷皂苷元含量的BBD-RSM試驗第19號酒黃精樣品粉末,精密稱定,共6份,根據樣品中薯蕷皂苷元的含量,按1∶1的比例加入薯蕷皂苷元對照品,按“2.3.2”項下方法操作,制備6份供試品溶液,按“2.3.3”項下色譜條件測定,計算加樣回收率,結果平均加樣回收率為98.45%,RSD值為2.42%,表明該方法加樣回收率符合規定。
2.3.9 樣品測定 精密稱取黃精不同炮制品粉末,按照“2.3.2”項下方法制備供試品溶液,按照“2.3.3”項下色譜條件測定各樣品中薯蕷皂苷元的含量。
2.4 5-HMF的含量測定[22-24]
2.4.1 對照品溶液的制備 精密稱取5-HMF對照品適量,用50%甲醇溶解并稀釋,制得質量濃度為0.40 mg/mL的對照品溶液。
2.4.2 供試品溶液的制備 精密稱取過3號篩的黃精不同炮制品粉末1 g,置具塞錐形瓶中,加入50%甲醇25 mL,在100 W、50 kHz的超聲條件下提取25 min,取出放涼,用50%甲醇補足減失的質量,濾過,取續濾液,過0.22 μm微孔濾膜,即得。
2.4.3 色譜條件 色譜柱為Agilent Extend-C18(250 mm×4.6 mm,5 μm);流動相為甲醇-水(10∶90);檢測波長285 nm;體積流量1 mL/min;柱溫30 ℃;進樣量10 μL。色譜圖見圖2。
2.4.4 線性關系考察 精密吸取“2.4.1”項下對照品溶液,稀釋成不同質量濃度梯度的系列對照品溶液,按照“2.4.3”項下色譜條件分別測定峰面積,以峰面積積分值為縱坐標(),質量濃度為橫坐標(),繪制標準曲線,進行線性回歸,所得線性回歸方程為=1 220.68-1.50,2=0.999 4,結果表明5-HMF在0.02~0.40 mg/mL內進樣量與峰面積呈良好的線性關系。
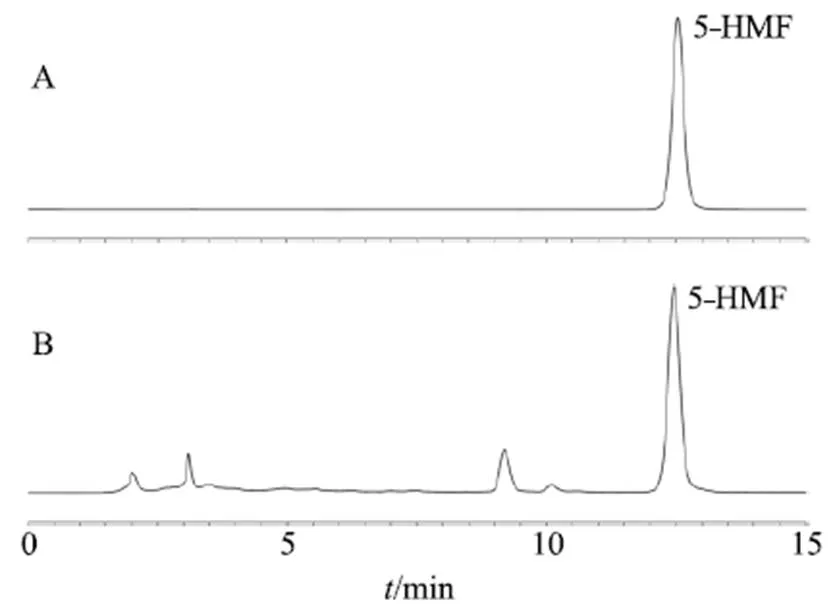
圖2 5-HMF對照品(A)及酒黃精樣品(BBD-RSM試驗第19號, B)的HPLC圖
2.4.5 精密度考察 取“2.4.1”項下的5-HMF對照品溶液,按照“2.4.3”項下色譜條件操作,連續進樣6次,測定5-HMF峰面積,計算得其RSD值為1.63%,結果表明儀器精密度良好。
2.4.6 重復性考察 精密稱定BBD-RSM試驗第19號酒黃精樣品粉末6份,按“2.4.2”項下方法制備供試品溶液,按照“2.4.3”項下色譜條件測定峰面積,計算得5-HMF質量分數的RSD值為1.61%,色譜條件重復性良好。
2.4.7 穩定性考察 精密稱定BBD-RSM試驗第19號酒黃精樣品粉末,按“2.4.2”項下方法制備供試品溶液,按照“2.4.3”項下色譜條件分別在制備后0、2、4、6、8、10、12 h進樣,測定峰面積,計算其RSD值為1.65%,表明供試品溶液在12 h內穩定性良好。
2.4.8 加樣回收率考察 取已測知5-HMF含量的BBD-RSM試驗第19號酒黃精樣品,精密稱定,共6份,根據樣品中5-HMF的含量,按1∶1的比例加入5-HMF對照品,按“2.4.2”項下方法操作,制備6份供試品溶液,按“2.4.3”項下色譜條件測定,計算得5-HMF的平均加樣回收率為98.770%,RSD值為1.82%,方法加樣回收率良好。
2.4.9 樣品測定 精密稱取黃精不同炮制品粉末,按照“2.4.2”項下方法制備供試品溶液,按照“2.4.3”項下色譜條件測定各樣品中5-HMF的含量。
2.5 浸出物的含量測定
參照《中國藥典》2020年版[1]浸出物測定法(通則2201)中的熱浸法,測定水溶性浸出物及醇溶性浸出物含量。
2.6 酒黃精炮制工藝的單因素試驗
酒制法是黃精的傳統炮制方法,也是現行藥典中規定的炮制方法。《中國藥典》2020年版收載的酒黃精炮制方法為“每100 kg黃精,用黃酒20 kg,照酒燉法或酒蒸法燉透或蒸透,稍晾,切厚片,干燥”[1],但具體參數缺乏量化指標。研究發現,潤制時間、蒸制壓力、蒸制時間、燜制時間等因素均對酒黃精的質量產生一定影響[5-7,25]。因此,本實驗選擇潤制時間、蒸制壓力、蒸制時間、燜制時間作為酒黃精炮制工藝的考察因素,以酒黃精性狀以及黃精多糖、薯蕷皂苷元、水溶性浸出物、醇溶性浸出物和5-HMF含量作為評價指標,進行單因素考察研究。
2.6.1 不同潤制時間考察 稱取黃精原藥材4份,每份100 g,在20%的加黃酒量下分別潤制3、4、5、6 h,置于高壓蒸汽滅菌鍋中,在0.04 MPa壓力下,蒸制2 h,燜制8 h。按照《中國藥典》2020年版酒黃精飲片性狀項下規定:“表面棕褐色至黑色,有光澤,中心棕色至淺褐色,可見筋脈小點,質較柔軟。味甜,微有酒香氣”[1],進行性狀鑒別,并依次測定黃精多糖、薯蕷皂苷元、水浸出物、醇浸出物和5-HMF含量,結果見表1。潤制時間為4 h時,酒黃精飲片性狀與《中國藥典》2020年版描述一致,黃精多糖、薯蕷皂苷元含量最高,因此,在進行后續BBD-RSM設計時,選擇4 h作為潤制時間的中心點。

表1 不同潤制時間對酒黃精性狀和評價指標含量的影響(, n = 3)
2.6.2 不同蒸制壓力考察 稱取黃精原藥材4份,每份100 g,在20%的加黃酒量下潤制4 h,置于高壓蒸汽滅菌鍋中,分別在0.02、0.04、0.06、0.08 MPa壓力下,蒸制2 h,燜制8 h,進行性狀鑒別,并依次測定黃精多糖、薯蕷皂苷元、水浸出物、醇浸出物和5-HMF含量,結果見表2。蒸制壓力為0.04 MPa時,酒黃精飲片性狀與《中國藥典》2020年版描述一致,黃精多糖最高,薯蕷皂苷元、醇浸出物和水浸出物較高。因此,在進行后續BBD-RSM設計時,選擇0.04 MPa作為蒸制壓力的中心點。
2.6.3 不同蒸制時間考察 稱取黃精原藥材4份,每份100 g,在20%的加黃酒量下潤制4 h,置于高壓蒸汽滅菌鍋中,在0.04 MPa壓力下,分別蒸制1、2、3、4 h,燜制8 h,進行性狀鑒別,并依次測定黃精多糖、薯蕷皂苷元、水浸出物、醇浸出物和5-HMF含量,結果見表3。蒸制時間為2 h時,酒黃精飲片性狀與《中國藥典》2020年版描述一致,薯蕷皂苷元、水浸出物最高,黃精多糖、醇浸出物較高。因此,選擇2 h為后續BBD-RSM設計中蒸制時間的中心點。
2.6.4 燜制時間考察 稱取黃精原藥材4份,每份100 g,在20%的加黃酒量下潤制4 h,置于高壓蒸汽滅菌鍋中,在0.04 MPa壓力下,蒸制2 h,分別燜制7、8、9、10 h,進行性狀鑒別,并依次測定黃精多糖、薯蕷皂苷元、水浸出物、醇浸出物和5-HMF含量,結果見表4。結果表明,燜制時間為8 h時,酒黃精飲片性狀與《中國藥典》2020年版描述一致,黃精多糖、醇浸出物含量最高,水浸出物和薯蕷皂苷元較高。因此,選擇8 h為后續BBD-RSM設計中燜制時間的中心點。

表2 不同蒸制壓力對酒黃精性狀和評價指標含量的影響(, n = 3)

表3 不同蒸制時間對酒黃精性狀和評價指標含量的影響(, n = 3)
2.7 基于AHP-熵權法結合BBD-RSM法優化酒黃精炮制工藝
2.7.1 AHP法計算各評價指標的權重系數[26-27]本實驗以黃精多糖、醇溶性浸出物、水溶性浸出物、5-HMF、薯蕷皂苷元含量為評價指標,根據影響酒黃精指標間的相互關系及重要程度,確定各指標先后順序:黃精多糖>醇浸出物=水浸出物>5-HMF>薯蕷皂苷元。采用1-9標度法構成評價指標兩兩比較的優先矩陣,并計算各指標權重系數(W1),結果見表5。
2.7.2 AHP-熵權法計算復合權重[26,28-29]根據熵權法公式計算權重系數(W2),醇浸出物、水浸出物、黃精多糖、薯蕷皂苷元、5-HMF的權重系數W2分別為0.131 7、0.152 4、0.175 0、0.374 9、0.166 0。根據公式計算復合權重W,醇浸出物、水浸出物、黃精多糖、薯蕷皂苷元、5-HMF的復合權重W依次為0.156 3、0.181 0、0.415 7、0.148 4、0.098 6。

表4 不同燜制時間對酒黃精性狀和評價指標含量的影響(, n = 3)
表5 指標成對比較的判斷優先矩陣
Table 5 Decision matrix of paired comparison on indexes
權重指標醇浸出物水浸出物黃精多糖薯蕷皂苷元5-HMFWj1 醇浸出物111/2320.21 水浸出物111/2320.21 黃精多糖221640.41 薯蕷皂苷元1/31/31/612/30.07 5-HMF1/21/21/43/210.10
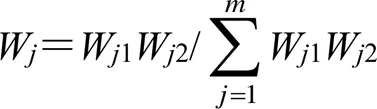
2.7.3 綜合評分計算[26,30-31]按公式計算酒黃精各指標成分的綜合評分。
X為各指標含量,Xmax為各指標含量最大值
2.7.4 BBD-RSM試驗設計及結果 根據單因素試驗考察結果,選擇潤制時間(1)、蒸制時間(2)、蒸制壓力(3)和燜制時間(4)4個因素為自變量,以黃精多糖、薯蕷皂苷元、水浸出物、醇浸出物和5-HMF含量綜合評分為因變量,采用4因素3水平的BBD-RSM設計方法,考察各因素對酒黃精炮制工藝的影響。每個因素設置高、中、低3個水平,分別記作?1、0、+1,利用Design-Expert 11軟件進行多元回歸擬合,BBD-RSM因素水平、試驗設計及結果見表6。
表6 BBD-RSM因素水平、試驗設計及結果
Table 6 Level of factors, test design and results of BBD-RSM
序號X1/hX2/hX3/MPaX4/h醇浸出物/%水浸出物/%黃精多糖/(mg?g?1)薯蕷皂苷元/(μg?g?1)5-HMF/(mg?g?1)綜合評分 15 (+1)2 (0)0.04 (0)9 (+1)62.3961.7226.2518.601.0355.18 24 (0)3 (+1)0.04 (0)7 (?1)70.3067.9518.7718.301.4156.09 33 (?1)1 (?1)0.04 (0)8 (0)67.5066.4938.539.780.5057.37 45 (+1)3 (+1)0.04 (0)8 (0)68.3966.4842.7510.130.3358.78 54 (0)2 (0)0.02 (?1)9 (+1)62.3758.5947.5116.140.3760.76 64 (0)1 (?1)0.04 (0)9 (+1)59.2157.1650.8416.050.4161.61 74 (0)2 (0)0.06 (+1)9 (+1)62.0360.1746.8015.680.5261.63 85 (+1)2 (0)0.02 (?1)8 (0)53.4755.5751.8915.121.0661.93 94 (0)3 (+1)0.06 (+1)8 (0)55.9254.1653.2414.720.8761.94 104 (0)1 (?1)0.02 (?1)8 (0)67.6663.2747.1213.630.4062.00 113 (?1)2 (0)0.04 (0)7 (?1)62.0561.4136.8216.442.4763.22 125 (+1)2 (0)0.06 (+1)8 (0)59.6060.6549.6217.090.6363.22 133 (?1)2 (0)0.04 (0)9 (+1)44.7449.2163.2115.081.1163.74 145 (+1)2 (0)0.04 (0)7 (?1)60.9859.7048.1715.421.6665.01 154 (0)2 (0)0.02 (?1)7 (?1)64.0063.0760.2810.690.3965.82 163 (?1)2 (0)0.06 (+1)8 (0)59.4866.3865.149.410.3267.06 174 (0)3 (+1)0.04 (0)9 (+1)66.8469.0050.2524.690.6571.26 184 (0)2 (0)0.06 (+1)7 (?1)65.6463.2370.788.671.0172.05 194 (0)2 (0)0.04 (0)8 (0)56.5058.3061.4619.402.0172.82 205 (+1)1 (?1)0.04 (0)8 (0)63.3660.9060.7321.601.0272.88 213 (?1)3 (+1)0.04 (0)8 (0)56.1858.7061.2019.592.0273.27 223 (?1)2 (0)0.02 (?1)8 (0)56.0858.2861.2020.522.0073.57 234 (0)2 (0)0.04 (0)8 (0)67.5765.4955.9228.890.1573.72 244 (0)1 (?1)0.06 (+1)8 (0)55.5560.8460.8420.612.0774.19 254 (0)3 (+1)0.02 (?1)8 (0)56.0859.2861.0921.592.0474.41 264 (0)1 (?1)0.04 (0)7 (?1)65.4966.1372.4116.650.5076.02 274 (0)2 (0)0.04 (0)8 (0)59.2956.8865.2415.053.1276.31 284 (0)2 (0)0.04 (0)8 (0)66.7566.1075.7510.231.0976.40 294 (0)2 (0)0.04 (0)8 (0)64.9163.1288.4921.491.1386.68
2.7.5 模型擬合 采用Design Expert 11軟件對比各模型擬合參數,建立醇浸出物、水浸出物、黃精多糖、薯蕷皂苷元和5-HMF的綜合評分()對潤制時間(1)、蒸制時間(2)、蒸制壓力(3)和燜制時間(4)的二次回歸模型方程:=77.19-1.771-0.692+0.133-2.004-7.5012+1.9513-2.5914-6.1723+7.3924-1.3434-7.2312-4.1622-4.3132-7.5942,二項式擬合方程的2=0.852 1,=0.001 2<0.01,失擬項=0.902 2>0.05,表明二次多項式回歸模型擬合度較高,可靠性較強。因此,選用該模型對酒黃精炮制工藝進行預測和分析具有一定的合理性和可行性。該回歸模型中12、23、24、12、42項的<0.01,表明因素1與因素4對綜合評分的線性效應具有統計學意義,因素2與因素1、3、4之間均有顯著的交互作用。結果見表7。
2.7.6 最佳工藝條件的預測 采用Design-Expert 11軟件,根據擬合方程預測酒黃精炮制工藝的最佳條件,同時繪制1、2、3、4對綜合評分的響應面圖,具體見圖3。以綜合評分最大值為優化目標,預測的最優炮制工藝為潤制時間4.68 h、蒸制時間1 h、蒸制壓力0.06 MPa、燜制時間7.18 h,根據試驗結果結合生產實際,確定酒黃精最佳炮制工藝為潤制時間5 h、蒸制時間1 h、蒸制壓力0.06 MPa、燜制時間7 h。
表7 二次多項式方程模型方差分析
Table 7 Variance analysis of quadratic polynomial equation model
方差來源平方和自由度均方F值P值顯著性方差來源平方和自由度均方F值P值顯著性 回歸模型1 378.781498.495.760.00極顯著X3X47.1717.170.420.53 X137.60137.602.200.16 X12339.281339.2819.850.00 X25.7715.770.340.57 X22112.091112.096.560.02 X30.2210.220.010.91 X32120.581120.587.050.02 X448.07148.072.810.12 X42373.321373.3221.840.00 X1X2224.981224.9813.160.00 剩余239.291417.09 X1X315.21115.210.890.36 失擬項116.571011.660.380.90不顯著 X1X426.77126.771.570.23 誤差122.72430.68 X2X3152.161152.168.900.01 總和1 618.1028 X2X4218.631218.6312.790.00

圖3 各因素交互作用的三維響應面圖
2.7.7 驗證試驗 根據優選出的酒黃精最佳炮制工藝,每100克黃精原藥材,加20 g黃酒拌勻,潤制5 h,置于高壓滅菌器中在0.06 MPa蒸制壓力下蒸制1 h后,常壓燜制7 h,稍晾,切厚片(2~4 mm),60 ℃鼓風干燥,炮制3批酒黃精飲片,測定醇浸出物、水浸出物、黃精多糖、薯蕷皂苷元和5-HMF的含量,實驗結果見表8,可知,3批酒黃精飲片的綜合評分分別為82.00、82.91、83.76,平均綜合評分為82.89,RSD=1.06%,預測值為82.73,即綜合評分實際值與預測值的偏差控制在±3%以內,說明酒黃精炮制工藝進行響應面優化具有一定的穩定性和可靠性,能制備出品質優良、質量穩定可控的酒黃精飲片。
2.8 黃精酒制前后刺激性比較
2.8.1 供試藥物制備方法 取生黃精飲片適量,加10倍體積的蒸餾水回流提取3次,每次1 h,趁熱濾過,將濾液合并濃縮至1.0 g/mL,給藥前用蒸餾水稀釋到所需質量濃度,即得生黃精提取液,于4 ℃保存備用。取最佳炮制工藝制備的酒黃精飲片適量,按上述方法制備即得酒黃精提取液。
表8 驗證試驗結果
Table 8 Validation of experimental results
序號醇浸出物/%水浸出物/%黃精多糖/(mg?g?1)薯蕷皂苷元/(μg?g?1)5-HMF/(mg?g?1)綜合評分預測值偏差/%RSD/% 162.6061.6080.5623.670.3182.0082.73?0.891.06 263.5063.7580.7722.930.3882.91 0.21 364.0261.3280.2122.750.6583.76 1.24
2.8.2 分組與給藥 取雄性新西蘭兔6只,適應性飼養3 d后,給藥前檢查家兔雙眼角膜、虹膜及結膜的情況,如有病變者剔除不用。分別取“2.8.1”項下生黃精和酒黃精提取液的稀釋液(0.5 g/mL)0.1 mL,采用自身對照法,將提取液滴入一側兔眼結膜囊內,作用時間10 s,2 min后立即取生理鹽水沖洗,另一側兔眼滴加等量生理鹽水作為對照,觀察記錄兔眼角膜、虹膜、結膜等局部反應及恢復情況,按照Draize評分標準判斷生黃精和酒黃精提取液對兔眼的刺激[32-33]。
2.8.3 結果 生黃精提取液和酒黃精提取液對兔眼的刺激強度評分結果見圖4,結果表明,與空白對照組相比,生黃精組對兔眼的刺激性作用較明顯,主要表現為血管充血,虹膜和角膜部位均出現炎癥、水腫現象。酒黃精組均未見明顯結膜充血、結膜水腫、虹膜損害和角膜損害等現象,各組均未見其他毒性反應。

圖4 家兔眼刺激性實驗結果
2.9 黃精酒制前后對免疫調節作用影響研究
2.9.1 供試藥物制備方法 提取液的制備同“2.8.1”項下方法。
2.9.2 動物分組及給藥處理方法 取BALB/c系小鼠,適應性喂養1周后,隨機分為空白對照組、模型對照組、陽性對照組和生黃精低、中、高劑量組及酒黃精低、中、高劑量組,每組6只。按照小鼠與成人體表面積換算方法進行劑量換算[34-35],設置生黃精和酒黃精低、中、高3個劑量組,劑量分別為2.5、5.0、10.0 g/kg。除空白組注射生理鹽水外,其余組均ip 80 mg/kg環磷酰胺3 d,建立小鼠免疫抑制模型。造模完成后,空白組和模型組ig生理鹽水,陽性藥組ig劑量40 mg/kg的鹽酸左旋咪唑,給藥組按照不同的劑量ig,每日1次,連續20 d。
2.9.3 臟器指數測定[36-37]將各組小鼠處死并解剖,取出脾臟和胸腺,用生理鹽水清洗并用濾紙將表面血跡吸干,準確稱定質量,分別計算脾臟指數和胸腺指數。
脾臟指數=脾臟質量/體質量
胸腺指數=胸腺質量/體質量
黃精酒制前后對免疫抑制小鼠胸腺指數、脾臟指數的影響見表9。與空白對照組比較,模型對照組小鼠胸腺指數、脾臟指數均顯著降低(<0.01),結合模型對照組小鼠的行為表現及相關形態,說明實驗已成功構建小鼠免疫抑制模型。與模型對照組比較,陽性對照組小鼠的脾臟指數、胸腺指數明顯升高(<0.01)。不同劑量的生黃精、酒黃精組的胸腺指數呈劑量相關性升高,其中酒黃精中、高劑量組還能顯著升高胸腺和脾臟指數(<0.01)。同時,酒黃精低、中劑量組與生黃精低、中劑量組相比,脾臟指數具有顯著性差異(<0.05)。綜上所述,生黃精組和酒黃精組均可提高小鼠的胸腺指數和脾臟指數,且提高效果隨著給藥濃度的增加而增強,同等給藥劑量,酒黃精組小鼠的胸腺指數、脾臟指數均高于生黃精組,提示酒黃精可明顯提高動物免疫器官功能水平,且效果優于生黃精。

表9 小鼠免疫臟器指數(, n = 6)
與空白對照組比較:**<0.01;與模型對照組比較:#<0.05##<0.01;與生黃精同等給藥劑量組比較:▲<0.05▲▲<0.01,下表同
**< 0.01control group;#< 0.05##< 0.01model group;▲< 0.05▲▲< 0.01equal dosage group of, same as below tables
2.9.4 外周血細胞測定[38-39]眼眶取血,精密移取20 μL,用血液分析儀測定全血紅細胞(RBC)、白細胞(WBC)、血紅蛋白(HGB)和血小板(PLT)值。黃精酒制前后對免疫抑制小鼠外周血細胞的影響見表10。與空白對照組比較,模型對照組小鼠WBC、RBC、HGB和PLT均顯著降低(<0.01)。與模型對照組比較,陽性對照組WBC、RBC、HGB和PLT顯著升高(<0.01);生黃精低劑量組小鼠WBC、RBC顯著升高(<0.01);生黃精中劑量組WBC、RBC、PLT顯著升高(<0.01);生黃精高劑量組WBC、RBC、HGB和PLT均顯著升高(<0.01、0.05);酒黃精低劑量組WBC、RBC和HGB顯著升高(<0.05、0.01);酒黃精中、高劑量組WBC、RBC、HGB和PLT均顯著升高(<0.01、0.05)。同時,酒黃精低、中、高劑量組與生黃精低、中、高劑量組相比較WBC、HGB有顯著性差異(<0.05)。以上結論提示酒黃精可明顯增加免疫抑制模型小鼠的外周血細胞,且效果優于生黃精。
2.9.5 碳廓清試驗 于最后一次給藥1 h后,將印度墨汁(按1∶3體積比加生理鹽水稀釋)注入小鼠尾靜脈[40],分別于注射后2 min和10 min,用采血毛細管從眼內眥靜脈叢取20 μL血樣加入配制好的2 mL 0.1% Na2CO3溶液中。選擇Na2CO3溶液作為空白對照,用酶標儀在600 nm處檢測值[41]。不同時間點取樣測定值記作1、2,處死小鼠,解剖取出肝臟和脾臟并稱定質量,按公式計算碳廓清指數()和吞噬指數()[42]。

表10 小鼠外周血白細胞、紅細胞、血紅蛋白和血小板計數(, n = 6)
=(lg1-lg2)/(2-1)
=體質量/(肝質量+脾質量)×1/3
黃精酒制前后對免疫抑制小鼠碳粒廓清功能的影響見表11。與空白對照組比較,模型對照組小鼠和均顯著降低(<0.01)。與模型對照組比較,陽性對照組小鼠和均顯著升高(<0.05、0.01)。生黃精低、中劑量組均顯著升高(<0.05、0.01),高劑量組和均顯著升高(<0.01);酒黃精不同劑量組均能使和顯著升高(<0.01)。同時,酒黃精低、中、高劑量組與生黃精低、中、高劑量組相比較,、有顯著性差異(<0.01)。綜上所述,與模型對照組比較,不同劑量的生黃精組和酒黃精組小鼠的、均有升高,其中酒黃精可明顯提高免疫抑制小鼠的碳粒廓清功能,且效果優于生黃精。

表11 小鼠碳K和α(, n = 6)
2.10 黃精酒制前后對降血糖作用影響研究
2.10.1 供試藥物制備方法 提取液的制備同“2.8.1”項下方法。
2.10.2 動物分組及給藥處理方法 C57BL/6系小鼠適應性喂養7 d后,將小鼠分為空白對照組和造模組,空白對照組飲食正常,造模組飼喂高脂高糖飼料,連續給藥30 d,禁食12 h后,造模組ip 70 mg/kg劑量1%鏈脲佐菌素(溶于pH 4.4,0.1 mmol/L檸檬酸-檸檬酸鈉緩沖液,現配現用),72 h后,斷尾取血測定空腹血糖≥11.1 mmol/L視為造模成功小鼠,將造模成功的小鼠隨機分為模型對照組、陽性對照組和生黃精低、中、高劑量組及酒黃精低、中、高劑量組。空白對照組和模型對照組均ig生理鹽水,陽性藥組按200 mg/kg劑量ig二甲雙胍,生黃精和酒黃精低、中、高劑量組按照不同的劑量ig,每日1次,連續30 d。
2.10.3 小鼠血糖測定 給藥結束后,小鼠采用剪尾的方式取血,利用血糖測定儀進行測定,將測定試紙插入儀器中,試紙自然吸入血樣,穩定后讀取數值。黃精酒制前后對糖尿病小鼠血糖的影響見表12。與空白對照組比較,經過高脂飼料聯合STZ誘導后,模型對照組小鼠的血糖水平顯著上升(<0.01);與模型對照組比較,陽性對照組、生黃精和酒黃精不同劑量組的血糖水平表現出降低趨勢(<0.01、0.05)。
2.10.4 血脂水平測定[43]眼眶取血,靜置待分層后,離心取血清,采用自動生化分析儀測定總膽固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、高密度脂蛋白膽固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白膽固醇(low- density lipoprotein cholesterol,LDL-C)的含量。

表12 糖尿病小鼠空腹血糖(, n = 6)
黃精酒制前后對糖尿病小鼠血脂的影響見表13。與空白對照組比較,模型對照組小鼠TC、LDL-C和TG含量均顯著升高(<0.01),HDL-C含量顯著降低(<0.01),說明已成功構建小鼠糖尿病模型。與模型對照組比較,陽性對照組小鼠TC、LDL-C、TG含量顯著降低,具有統計學意義(<0.01),HDL-C顯著升高(<0.01);同等5 g/(kg?d)給藥劑量,ig生黃精和酒黃精提取液的小鼠TC含量顯著降低(<0.05、0.01);同等10 g/(kg?d)給藥劑量,生黃精組小鼠TC、TG含量顯著降低(<0.05、0.01),酒黃精組小鼠TC、LDL-C和TG含量顯著降低(<0.01、0.05),HDL-C含量顯著升高(<0.05)。同時,與生黃精高劑量組相比,酒黃精高劑量組小鼠TC、LDL-C和TG含量均有統計學意義(<0.05)。綜上所述,不同給藥劑量的生黃精、酒黃精提取液均可降低小鼠TC、LDL-C和TG含量,增加HDL-C含量,生黃精和酒黃精提取液對2型糖尿病小鼠血脂均有一定的改善作用,酒黃精對血脂改善作用優于生黃精。

表13 糖尿病小鼠血脂(, n = 6)
2.10.5 小鼠臟器指數的測定[44-45]將各組小鼠處死并解剖,取出脾臟、肝臟和腎臟,用生理鹽水清洗并用濾紙將表面血跡吸干,準確稱定質量,按照公式計算臟器指數。
肝臟指數=肝臟質量/體質量
腎臟指數=腎臟質量/體質量
黃精酒制前后對糖尿病小鼠臟器指數的影響見表14。與空白對照組比較,模型對照組小鼠肝臟指數、腎臟指數和脾臟指數均顯著升高(<0.01),說明糖尿病小鼠出現肝臟腫大,腎臟損傷、水腫,脾臟體積增大等現象。與模型對照組比較,陽性對照組的臟器指數均顯著降低(<0.01);生黃精高劑量組肝臟指數、脾臟指數顯著降低(<0.05);酒黃精中劑量組能顯著降低肝臟指數、腎臟指數和脾臟指數(<0.05、0.01),高劑量組腎臟指數、脾臟指數顯著降低(<0.01)。
給藥劑量為5 g/(kg?d),酒黃精與生黃精肝臟指數、脾臟指數、腎臟指數有顯著性差異(<0.05);給藥劑量為10 g/(kg?d),黃精酒制前后脾臟指數和腎臟指數有顯著性差異(<0.05),肝臟指數無顯著性差異。綜上所述,生黃精和酒黃精對臟器指數均有一定的調節作用,酒黃精對胸腺、腎臟和脾臟損傷的抑制作用優于生黃精組。

表14 糖尿病小鼠臟器指數(, n = 6)
3 討論
本實驗采用AHP-熵權法結合BBD-RSM優化酒黃精炮制工藝參數,可同時兼具決策人的主觀判斷和待評價各項指標的客觀信息[46],提高了數據的合理性和工藝參數的科學性,可以比較準確地從藥效物質的角度更加公正地評價酒黃精工藝的相關參數。驗證實驗結果表明,在潤制時間5 h、蒸制時間1 h、蒸制壓力0.06 MPa、悶潤時間7 h的工藝條件下,酒黃精的指標成分黃精多糖、薯蕷皂苷元、醇浸出物、水浸出物、5-HMF的平均綜合評分為82.89,與模型理論預測值基本一致,表明該模型準確性高,制備的酒黃精飲片質量穩定,能夠較合理地應用于酒黃精炮制工藝的優化,本研究優化的酒黃精炮制工藝只是小試結果,最終的生產工藝仍需要進行中試放大試驗進行驗證。
黃精生品刺人咽喉,炮制后刺激性減弱,同時能夠增強補脾潤肺、益腎的作用。在炮制減毒方面,本研究利用兔眼刺激性試驗比較了黃精酒制前后刺激性作用,結果表明,生黃精具有刺激性,酒制后刺激性減弱。有文獻認為黏液質是黃精刺激性成分,炮制后黏液質被大量破壞,從而減輕對咽喉的刺激性[47-48];也有報道炮制后正己醛、莰烯等揮發性成分含量減少,可能是黃精的刺激性成分[49],但以上均是推測,缺少實驗數據證實。胡菊[14]利用家兔眼刺激性和皮膚刺激性實驗篩選出黃精刺激性成分認為可能為黃精針晶,其實驗所用的黃精生品由滇黃精鮮品60 ℃干燥制得,但由于黃精傳統加工方法為“黃精鮮品-去雜-洗凈-蒸煮-干燥-黃精生品”[50-52],蒸煮后再干燥的黃精生品是否具有刺激性有待深入研究。
在炮制增效方面,本研究采用ip環磷酰胺建立小鼠免疫抑制模型,運用高糖高脂飼料聯合小劑量鏈脲佐菌素構建2型糖尿病小鼠模型,比較黃精酒制前后免疫調節和降血糖作用,實驗結果表明,黃精酒制后可以增強免疫調節和降血糖作用。目前,黃精的藥效物質基礎研究多集中于黃精多糖,《中國藥典》2020年版[1]也以多糖作為黃精的質量評價指標。由于黃精在炮制過程中發生了美拉德反應,以及多糖發生了水解反應,炮制后多糖含量降低,寡糖和單糖含量升高[53],并產生了5-HMF,因此僅以多糖作為質量控制指標并不能完全反映黃精炮制前后的藥效差異。寡糖作為糖類研究的重要組成部分,本課題組前期研究發現黃精酒制后多糖含量降低,寡糖含量升高,楊云等[54]研究發現黃精寡糖具有促進小鼠非特異性免疫的作用,可增強小鼠體液免疫功能,因此有必要對黃精炮制前后寡糖的成分變化和藥效進行深入研究,為進一步闡明黃精炮制增效的科學內涵提供研究基礎。
利益沖突 所有作者均聲明不存在利益沖突
[1] 中國藥典 [S]. 一部. 2020: 319-320.
[2] 李晶晶, 王洪軍, 孟德玉, 等. 黃精炮制的歷史沿革研究 [J]. 湖北農業科學, 2020, 59(S1): 171-173.
[3] 戴萬生, 趙聲蘭, 朱智蕓, 等. 不同輔料蒸制對滇黃精化學成分含量的影響 [J]. 云南中醫中藥雜志, 2015, 36(7): 70-72.
[4] 郭信東, 袁小鳳, 楊昌貴, 等. 黃精酒制后活性成分的變化研究 [J]. 時珍國醫國藥, 2022, 33(6): 1366-1368.
[5] 劉艷艷, 蔣琳, 楊婷宇, 等. 酒黃精現代研究進展 [J]. 廣東藥科大學學報, 2022, 38(4): 130-134.
[6] 宋藝君, 郭濤, 馬存德, 等. 響應面法優化制黃精高壓蒸制工藝研究 [J]. 世界科學技術—中醫藥現代化, 2018, 20(7): 1261-1267.
[7] 張婕, 金傳山, 吳德玲, 等. 正交試驗法優選黃精加壓酒蒸工藝研究 [J]. 安徽中醫藥大學學報, 2014, 33(1): 72-74.
[8] 王永祿, 王麗瑤, 朱欣佚, 等. 常壓蒸制和高壓蒸制對酒黃精化學成分的影響研究 [J]. 中國生化藥物雜志, 2014, 34(8): 173-175.
[9] 姜程曦, 張鐵軍, 陳常青, 等. 黃精的研究進展及其質量標志物的預測分析 [J]. 中草藥, 2017, 48(1): 1-16.
[10] 陳詩麗, 閔可, 楊蓉, 等. 解吸附電暈束電離質譜法快速測定黃精中的薯蕷皂苷元 [J]. 湖南師范大學自然科學學報, 2022, 45(5): 136-143.
[11] 王帥, 王麗麗, 房娟娟, 等. 滇黃精酒制過程中顏色與5種成分含量變化的相關性分析 [J]. 中國實驗方劑學雜志, 2022, 28(21): 156-162.
[12] 鐘凌云, 周燁, 龔千鋒. 炮制對黃精薯蕷皂苷元影響的研究 [J]. 中華中醫藥學刊, 2009, 27(3): 538-540.
[13] 東寶花, 蔣云秀, 強夢琴, 等. 黃精炮制沿革及現代研究進展 [J]. 中華中醫藥學刊, 2022, 40(11): 213-217.
[14] 胡菊. 九蒸九曬黃精炮制“緩性增效”原理及產品開發研究 [D]. 成都: 成都中醫藥大學, 2021.
[15] 李瑞. 黃精產地加工—炮制一體化研究[D]. 長沙: 湖南中醫藥大學, 2020.
[16] 宋藝君, 郭濤, 周曉程. 不同產地黃精經不同方法炮制后多糖、5-羥甲基糠醛的含量變化 [J]. 中國藥房, 2017, 28(16): 2256-2258.
[17] 焦劼, 陳黎明, 孫瑞澤, 等. 不同產地黃精主要化學成分比較及主成分分析 [J]. 中藥材, 2016, 39(3): 519-522.
[18] 孫婷婷, 張紅, 李曄, 等. 陜西產黃精不同炮制品中薯蕷皂苷元含量分析 [J]. 中國藥師, 2017, 20(1): 158-160.
[19] 李帆. 九華黃精遺傳多樣性及HPLC特征圖譜研究 [D].溫州: 溫州大學, 2021.
[20] 馮治國, 趙祺, 朱強, 等. 基于熵權法和灰色關聯分析法評價安徽省不同產地黃精藥材質量 [J]. 中草藥, 2021, 52(12): 3689-3695.
[21] 劉紹歡, 洪迪清, 王世清. 黔產栽培黃精的薯蕷皂苷元含量測定 [J]. 中國民族民間醫藥, 2010, 19(5): 44-45.
[22] 馬佳麗, 蔣殷盈, 蔣福升, 等. 九蒸九制多花黃精炮制過程變化研究 [J]. 浙江中醫藥大學學報, 2020, 44(5): 480-485.
[23] 殷海霞, 鄔秋萍, 平欲暉, 等. HPLC法同時測定黃精中5-羥基麥芽酚、5-羥甲基糠醛和黃精堿A的含量 [J]. 中國藥師, 2018, 21(9): 1683-1686.
[24] 王蕾, 張語凡, 王鑫, 等. 生川烏片炮制過程中5-HMF含量隨炮制時間的變化規律研究 [J]. 中醫藥信息, 2017, 34(3): 17-20.
[25] 劉露梅, 王能, 陳丹, 等. 基于黃精降血糖功效的酒黃精炮制工藝優選 [J]. 時珍國醫國藥, 2021, 32(8): 1915-1918.
[26] 楊婷, 黃瑩瑩, 方楊冰, 等. 基于AHP-熵權法結合正交試驗設計優選嶺南特色飲片制枳殼的發酵工藝及發酵前后成分對比研究 [J]. 中草藥, 2022, 53(20): 6443-6450.
[27] 李娟, 李保安, 方晗, 等. 基于AHP-熵權法的發明專利價值評估: 以豐田開放專利為例 [J]. 情報雜志, 2020, 39(5): 59-63.
[28] 胡兆流, 陳秋谷, 王佛長, 等. 基于信息熵理論權重分析的正交設計法優選參黛愈瘍灌腸液水提工藝 [J]. 現代藥物與臨床, 2020, 35(3): 442-446.
[29] 王夢珂, 王夢偉, 李蒙恩, 等. 基于AHP-熵權法的白附子有效成分與顏色值的相關性研究 [J]. 中華中醫藥學刊, 2022, 40(12): 125-131.
[30] 賈德強, 賀成柱, 丁立利. AHP-熵權法結合Box-Behnken響應面法優化當歸微波真空干燥工藝研究 [J]. 中國農機化學報, 2023, 44(2): 60-68.
[31] 王夢偉, 王夢珂, 李蒙恩, 等. 基于AHP-熵權法的天南星飲片顏色與有效成分相關性研究 [J]. 時珍國醫國藥, 2022, 33(11): 2648-2652.
[32] 楊穎. 漢防己堿納米乳滴眼液的制備及其在兔眼的藥代動力學研究 [D]. 鄭州: 鄭州大學, 2021.
[33] 何文, 盧朝薇. 伏立康唑磺丁基醚-β-環糊精包合物對兔眼刺激性考察研究 [J]. 中國藥師, 2019, 22(11): 2035-2037.
[34] 唐穎. 七種免疫增強劑及其復方對豬圓環病毒2型基因工程疫苗的免疫增強作用研究 [D]. 揚州: 揚州大學, 2017.
[35] 胡佳莉. 紅曲黃精發酵工藝及免疫調節和降血脂作用研究 [D]. 廣州:廣東藥科大學, 2020.
[36] 譚輝. 紫山藥花青素的提取及口服液的研制 [D]. 成都: 西南交通大學, 2018.
[37] 李澤, 潘登, 沈建利, 等. 黃精多糖對免疫抑制小鼠免疫功能影響的實驗研究 [J]. 藥物生物技術, 2013, 20(3): 241-244.
[38] 龍婷婷. 基于TLR4-MAPK/NF-κB信號通路探討黃精多糖免疫調節抗腫瘤作用機制研究 [D]. 重慶: 重慶醫科大學, 2018.
[39] 劉娜. 黃精多糖的分離、鑒定及免疫調節功效研究 [D]. 濟南: 山東大學, 2017.
[40] 方選, 李昇剛, 扆雪濤, 等. 卡馬西平對小鼠免疫功能的影響 [J]. 中國藥師, 2011, 14(5): 648-650.
[41] 涂曉慧. 2,4-D降解菌的篩選、鑒定及其降解特性研究 [D].合肥: 安徽農業大學, 2015.
[42] 劉懷永. 沙棘籽油軟膠囊功效成分分析及增強免疫功能研究 [D]. 福州: 福建醫科大學, 2014.
[43] 韓笑, 匡宇, 張舜杰, 等. 黃精、桑葉和玉竹配伍的降血糖藥效學研究 [J]. 中藥與臨床, 2018, 9(3): 26-29.
[44] 王藝. 黃精、滇黃精多糖的結構表征與降血糖活性分析 [D]. 西安: 陜西師范大學, 2019.
[45] 王韶君. 山茱萸炮制前后對2型糖尿病小鼠的降血糖作用及機制研究 [D]. 西安:陜西師范大學, 2016.
[46] 王繼龍, 魏舒暢, 劉永琦, 等. 基于G1-熵權法和正交設計優選黃芪百合顆粒的提取純化工藝 [J]. 中草藥, 2018, 49(3): 596-603.
[47] 秦宇雯, 張麗萍, 趙祺, 等. 九蒸九曬黃精炮制工藝的研究進展 [J]. 中草藥, 2020, 51(21): 5631-5637.
[48] 鐘凌云, 龔千鋒, 張的鳳, 等. 黃精炮制研究現狀分析 [J]. 中藥材, 2007, 30(12): 1618-1621.
[49] 王進, 岳永德, 湯鋒, 等. 氣質聯用法對黃精炮制前后揮發性成分的分析 [J]. 中國中藥雜志, 2011, 36(16): 2187-2191.
[50] 錢紅月, 董琦, 肖移生. 江西省黃精加工與炮制的現狀與分析 [J]. 中國民族民間醫藥, 2022, 31(20): 116-118.
[51] 易方, 劉會. 黃精“產地加工-炮制一體化”的藥材及飲片質量研究 [J]. 湖南中醫雜志, 2021, 37(6): 173-177.
[52] 趙君, 孫樂明, 章啟東. 黃精產地加工與炮制一體化初步研究 [J]. 亞太傳統醫藥, 2020, 16(9): 61-63.
[53] Fan B L, Wei G L, Gan X F,.Study on the varied content ofpolysaccharides in the processing of steaming and shining for nine times based on HPLC-MS/MS and chemometrics [J]., 2020, 159: 105352.
[54] 楊云, 王爽, 馮云霞, 等. 黃精中小分子糖對小鼠免疫功能的影響 [J]. 中國組織工程研究與臨床康復, 2009, 13(18): 3447-3450.
Optimization of processing technology of wine-processedby combination of Box-Behnken design-response surface method and AHP-entropy weight method and comparison of efficacy before and after processing
SHI Shuang-hui, WANG Meng-lin, WEI Xiao-tong, MA Si-yuan, HU Yu-feng, ZHANG Jing-qiu, WANG Hui- nan, CHEN Meng-yu, LIU Qian-qian, WANG Ying-zi
School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 102488, China
To optimize the high-pressure steaming process of wine-processed Huangjing (, PR) (wpPR) and determine the best process parameters, and to study the irritation, immune regulation and hypoglycemic effect before and after wine processing.Taking the moistening time, steaming pressure, steaming time and stewing time as investigation factors and characteristics, polysaccharide, diosgenin, water extract, alcohol extract and 5-hydroxymethylfurfural (5-HMF) as investigation indexes, the AHP-entropy weight method combined with the Box-Behnken design-response surface method (BBD-RSM) were used to determine the processing parameters of wpPR. The irritating effect of PR before and after processing was evaluated by rabbit eye irritation test. The immunosuppressive model of mice was established by intraperitoneal injection of cyclophosphamide, and compared the effects of PR before and after processing on immune regulation. The model of diabetes mice was established by feeding high fat and high sugar diet and intraperitoneal injection of streptozotocin, and the effect of PR before and after processing on hypoglycemic effect was compared.The best processing parameters of wpPR was moistening time of 5 h, steaming time of 1 h, steaming pressure of 0.06 MPa and stewing time of 7 h. The results of the pharmacodynamic experiment showed that raw PR was irritant, the irritation of wpPR on mucous membrane is weakened. The effects of wpPR on improving immunity and lowering blood sugar in mice were stronger than raw PR.The comprehensive score of wpPR pieces was higher, the process of wpPR was stable, reasonable and feasible. wpPR prepared by this process can reduce irritation, enhance immune function and hypoglycemic effect, which provided a reference for the processing technology research and clinical medication of PR.
AHP-entropy weight method; Box-Behnken design-response surface methodology; wine-processed; processing technology; irritation; immunomodulatory; hypoglycemic effect; diosgenin; 5-hydroxymethylfurfural
R283.6
A
0253 - 2670(2023)14 - 4467 - 14
10.7501/j.issn.0253-2670.2023.14.007
2023-01-03
國家重點研發計劃(2018YFC1707000)
石雙慧(1999—),女,碩士研究生,研究方向為中藥制劑新技術與中藥炮制原理研究。E-mail: a18801377903@163.com
王英姿(1975—),女,教授,博士生導師,博士,研究方向為中藥制劑新技術與中藥炮制原理研究。E-mail: wangyzi@sina.com
[責任編輯 鄭禮勝]

