外周血NLRP3 mRNA、NF-κB、PCT水平與COPD患者肺功能及肺動脈高壓的關系*
張育泉, 程義局, 杜娟, 李瑞雪, 潘琳, 楊文婷, 吳瀟, 盧琴, 李向魁
(1.貴州醫科大學附屬醫院 呼吸與危重癥醫學科, 貴州 貴陽 550004; 2.貴陽市公共衛生救治中心 呼吸與危重癥醫學科, 貴州 貴陽 550004; 3.貴州醫科大學 研究生院, 貴州 貴陽 550004)
慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)是呼吸與危重癥科較常見的疾病之一[1-2],是一種以氣流受限逐漸加重為特征、并且氣流受限不能逆轉的慢性疾病[3-5]。COPD在老年人群中多見,受涼感冒后加重,發病后主要表現為明顯的喘息、間斷地咳嗽及多咳白色泡沫痰等癥狀,常伴隨有口唇紫紺、一定程度的呼吸困難[6-7]。目前在臨床上對于COPD疾病的檢測主要為肺功能及肺部CT,然而這兩種評估方式對COPD氣管插管病人不方便[7]。現有研究表明,炎癥因子NOD樣受體熱蛋白結構域相關蛋白3信使RNA(NOD-like receptor protein 3 mRNA,NLRP3 mRNA)、核因子激活的B細胞的κ-輕鏈增強(nuclear factor-kappaB,NF-κB)、降鈣素原(procalcitonin,PCT)與COPD相關[8-9],但尚未表明它們與COPD肺功能及肺動脈高壓的關系。因此本研究擬探討 COPD患者NLRP3 mRNA、NF-κB及PCT表達與肺功能及肺動脈高壓的關系,現將結果匯報如下。
1 對象與方法
1.1 研究對象
選擇2020年5月—2021年5月COPD穩定期患者和COPD急性加重期(acute exacerbation of COPD,AECOPD)未合并肺動脈高壓患者,要求符合COPD相關診斷標準[10]且依據胸部CT、臨床表現及肺功能檢查確診為COPD和AECOPD,近2個月內未使用過糖皮質激素、非甾體抗炎藥治療,患者均自愿參加;排除腫瘤、肺結核合并細菌感染、支氣管擴張并感染、急性支氣管哮喘發作、肺間質性疾病等呼吸道疾病,排除合并嚴重皮膚感染、腎臟病、心力衰竭。共納入COPD穩定期患者47例和AECOPD未合并肺動脈高壓患者47例,分別作為COPD 穩定期組和AECOPD未合并肺動脈高壓組,COPD穩定期組中男25例、女22例,年齡47~75歲、平均(55.2±6.41)歲;AECOPD未合并肺動脈高壓組中男25例、女22例,年齡47~83歲、平均(56±6.5)歲。選擇同期體檢健康人群為對照組,要求肺功能無異常,既往無腎、肝、心、肺疾病,納入對照組受檢者47例,男23例、女24例,年齡46 ~78 歲、平均(54.8±5.32)歲;選擇同期呼吸危重癥科住院的AECOPD合并肺動脈高壓患者作為AECOPD合并肺動脈高壓組(n=47),要求肺動脈高壓為平均肺動脈壓(mean pulmonary arterial pressure,mPAP)≥20 mmHg[11],其中男23例、女24例,年齡48~76歲、平均(55.26±5.2)歲。本研究取得患者的知情同意并獲醫院倫理委員會批準(2022倫審第498號)。
1.2 實驗方法
1.2.1酶聯免疫吸附法檢測患者血清NF-κB、PCT表達 抽取4組受檢者清晨空腹靜脈血11 mL抗凝,2 ℃冷凍離心機(美國Beckman)中1 220 r/min離心7 min,吸管吸取上層血漿裝于經紫外照射的塑料管中,-82 ℃冰箱保存;采用酶聯免疫吸附法檢測各組受檢者血漿NF-κB和PCT,CMax Plus 酶標儀(上海美谷分子儀器有限公司)測光密度(optical density,OD)值,并進行比較。
1.2.2測外周血淋巴細胞NLRP3 mRNA 采集4組受檢者清晨外周靜脈血7 mL抗凝后儲存于-80 ℃冰箱,使用磷酸鹽緩沖液(phosphate buffered saline,PBS)稀釋加人外周血淋巴細胞分離液(北京索萊寶科技有限公司)7 mL,2 000 r/min離心23 min,吸取白膜層;PBS沖洗,1 000 r/min離心11 min,棄上清液,重復2次;加 Trizol 試劑(上海生工公司)1 mL反復吹打混勻,加三氯甲烷、異丙醇等分離出mRNA;紫外分光光度(Biorad)測定儀加RNA 1 μL測量濃度與純度;取 RNA 3.1~5.2 μL按TaKaRa生產的cDNA逆轉錄試劑盒加入各成分;逆轉錄反應條件為37 ℃ 14 min、85 ℃ 6 s 、4 ℃ 32 min,前向引物為AGGGATGAGAGTGTTGTGTGAAACG,反向引物為GCTTCTGGTTGCTGCTGAGGAC;根據2×SYBR Green qPCR Master Mix(武漢賽維爾生物科技有限公司)加含互補DNA的反應體系20 μL,設立4個復孔,反應條件為95 ℃ 30 s預變性(1 個循環),95 ℃ 15 s、60 ℃ 30 s(共41 個循環);反應1.5 h,生成單峰溶解曲線和擴增曲線,由 2-ΔΔCt表示NLRP3 mRNA 表達的高低。
1.2.3肺功能檢測 對照組、 COPD穩定期患者和AECOPD未合并肺動脈高壓患者吸入沙丁胺醇,采用肺功能儀檢測肺功能,記錄第一秒用力呼氣容積(forced expiratory volume in the first second,FEV1)、用力肺活量(forced vital capacity,FVC)、FEV1占用力肺活量的百分比(FEV1/FVC)、FEV1占預計值的百分比(FEV1%pred)指標。
1.2.4心臟功能檢查 采用超聲心動儀(荷蘭飛利浦公司)測量AECOPD未合并肺動脈高壓和AECOPD合并肺動脈高壓組患者的肺動脈壓、右心房徑及右心室徑,其中肺動脈高壓的規定標準為平均肺動脈壓(pulmonary arterial systolic pressure,mPASP)≥20 mmHg[11]。由心臟超聲室的同1名副主任醫師使用相同的心動超聲儀完成。
1.3 統計學分析
2 結果
2.1 一般資料
對照組、COPD穩定組、AECOPD未合并肺動脈高壓組及AECOPD合并肺動脈高壓組受檢者的年齡、性別比較,差異無統計學意義(P>0.05)。見表1。
2.2 血清NLRP3 mRNA、NF-κB、PCT水平及肺功能指標
對照組健康人群NLRP3 mRNA、PCT、NF-κB 表達水平較COPD穩定期組患者減少(P<0.05),COPD穩定期組患者NLRP3 mRNA、PCT、NF-κB 表達水平均較AECOPD未合并肺動脈高壓組減少(P<0.05);對照組健康人群FEV1%pred、FEV1/FVC較COPD穩定期組患者高(P<0.05),COPD穩定期組患者FEV1%pred、FEV1/FVC較AECOPD未合并肺動脈高壓組高(P<0.05)。見表2。
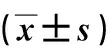
表2 對照組、COPD穩定組及AECOPD未合并肺動脈高壓組受檢者血漿炎癥指標和肺功能指標Tab.2 Inflammatory indexes and lung function in the control group, stable COPD group, and AECOPD group without pulmonary
2.3 AECOPD患者血漿炎癥指標與心臟超聲指標
AECOPD合并肺動脈高壓組患者血漿炎癥指標PCT、NF-κB、NLRP3 mRNA和心臟超聲指標右心房內徑、右心室內徑、mPAP水平均高于AECOPD未合并肺動脈高壓組,差異有統計學意義(P<0.05)。見表3。
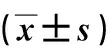
表3 AECOPD未合并肺動脈高壓組與AECOPD合并肺動脈高壓組患者血漿炎癥和心臟超聲指標Tab.3 Comparison of inflammatory indexes and cardiac ultrasound indexes between AECOPD group and AECOPD group with pulmonary
2.4 對照組、COPD穩定組及AECOPD未合并肺動脈高壓組受檢者NLRP3mRNA、NF-KB、PCT與肺功能指標的相關性
相關性分析結果表明,對照組、COPD穩定組及AECOPD未合并肺動脈高壓組受檢者NLRP3 mRNA、NF-κB、PCT與肺功能FEV1%pred、FEV1/FVC指標呈負相關性(P<0.05)。見表4。

表4 對照組、COPD穩定組及AECOPD未合并肺動脈高壓組受檢者NLRP3 mRNA、NF-κB、PCT與肺功能指標的相關性Tab.4 Correlation between NLRP3 mRNA, NF-κB, PCT, and pulmonary function indexes in the control group, stable COPD group and AECOPD without pulmonary hypertension group
2.5 AECOPD患者NLRP3 mRNA、NF-κB、PCT與肺動脈高壓、右心房內徑、右心室內徑的相關性
相關性分析結果表明,NLRP3 mRNA、NF-κB、PCT與肺動脈高壓、右心房內徑、右心室內徑指標均呈正相關(P<0.05)。見表5。

表5 AECOPD患者NLRP3 mRNA、NF-κB、PCT與肺動脈高壓、右心房內徑、右心室內徑的相關性Tab.5 Correlation of NLRP3 mRNA, NF-κB, PCT with pulmonary hypertension, right atrial diameter, and right ventricular diameter of patients with AECOPD
3 討論
COPD 是發生于成人的氣流受限不完全可逆的疾病,且與吸煙相關[3]。COPD 病情呈進行性加重,目前研究證實可能與基因的結構密切相關[4]。COPD患者由于肺功能明顯受損導致呼吸不通暢,晚期嚴重影響生活質量,少數病人需長期吸氧[3]。如果單憑肺功能檢查來估計AECOPD疾病變化是非常困難的,因此需研究新診斷指標。PCT由大約110個氨基酸組成,由甲狀腺濾泡旁細胞合成,在細菌感染時明顯增高,其水平可能與細胞因子有關[12-13];PCT是監控肺組織發生炎性反應的標記物之一,根據其檢測值的不同,能夠判斷肺部炎性反應的大概程度[9,14]。NF-κB是一種在調控細胞因子表達的炎癥網絡中起關鍵作用的轉錄因子,參與低氧、紫外線輻射等炎癥反應的發生。有研究表明,在脂多糖誘導炎癥因子的小鼠試驗中,霧化吸入新型磷酸二酯酶CHF6001干粉通過抑制NF-κB的活化來抑制白三烯B4(leukotriene B4,LTB4)的產生[15];紫花牡荊素可通過抑制NF-κB信號通路來減輕COPD大鼠氣道炎癥[16];COPD患者活檢組織及炎癥細胞中NF-B表達水平明顯增加[17]。NF-κB可以介導多種炎癥反應,激活白細胞介素-8(interleukin 8,IL-8),IL-8可招募中性粒細胞等[18-19]。有研究表明,小鼠體內miR-149-3p可下調整合無翼信號(wingless/integrated,Wnt1)、β-連環蛋白(β-catenin)的表達來抑制Wnt 信號通路傳導[18];使用miR-149-3p抑制劑通過Wnt信號途徑增加腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、IL-6、NF-κB、表面蛋白A(sufactant protein A,SP-A)及 表面蛋白D(sufactant protein,SP-D)的表達,促進小鼠炎癥反應的發生[18];COPD患者分泌的環氧合酶-2(cyclooxygenase-2,COX-2)、IL-1β、TNF-α及NF-κB mRNA表達較正常人高,COPD患者體內NF-κB與炎癥因子COX-2、IL-1β、TNF-α相關[8]。NLRP3炎性小體是細胞內多種蛋白構成的固有免疫傳感器,包括NLRP3、前體含半胱氨酸的天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase1,Caspase-1)等[20-21]。NLRP3誘導gasdermin(GSDMD)蛋白的裂解,GSDMD可促使細胞膜的破裂,導致細胞蛋白釋放,最終引起炎癥反應的產生[22-23];NLRP3可調控 Caspase-1、白細胞介素和其他細胞因子的活化,最終調控相關炎癥反應[22-23];Nachmias等[24]研究顯示,暴露在吸煙環境的A-549細胞分泌的單核細胞趨化蛋白-1(monocyte chemotactic protein 1,MCP-1)、IL-8、NLRP3較未暴露吸煙多,暴露在吸煙環境的COPD模型中以脂多糖處理A-549 細胞分泌MCP-1、IL-8、NLRP3較脂多糖處理A-549 細胞多;Wang等[25]研究提示在骨髓細胞上表達的觸發受體(triggering receptor expressed on myeloid cells 1,TREM1)通過炎性小體介導焦亡來加重COPD;也有研究表明,尼古丁誘導支氣管上皮細胞焦亡,與COPD進展有關[20]。本研究中,受檢者血清PCT、NLRP3 mRNA及NF-κB水平表現為AECOPD未合并肺動脈高壓組>COPD穩定期組>對照組,AECOPD未合并肺動脈高壓組患者NLRP3 mRNA、PCT、NF-κB、右心房內徑、右心室內徑及PASP表達水平較 AECOPD合并肺動脈高壓組減少,PCT、NLRP3 mRNA、NF-Bκ與肺功能FEV1%pred、FEV1/FVC呈負相關,與肺動脈高壓、右心房內徑、右心室內徑 3個指標呈正相關。
綜上所述,COPD患者PCT、NLRP3 mRNA、NF-κB與肺功能FEV1%pred、FEV1/FVC呈負相關;AECOPD患者PCT、NLRP3 mRNA、NF-κB與肺動脈高壓、右心房內徑、右心室內徑 3個指標均呈正相關。因此可將NLRP3mRNA、NF-κB、PCT三者聯合檢測評估AECOPD 患者病情變化值得臨床科研人員進一步探討。

