陸地棉磷高效基因GhMYB4的克隆與表達分析
耿翡翡,孟超敏,卿桂霞,周佳敏,張富厚,劉逢舉
(1.河南科技大學農學院/洛陽市作物遺傳改良與種質創新重點實驗室,河南洛陽 471000;2.中國農業科學院棉花研究所/棉花生物學國家重點實驗室,河南安陽 455000)
0 引 言
【研究意義】磷是許多分子中的關鍵成分,如ATP,核酸,蛋白質和磷脂等[1]。磷參與植物能量代謝,光合作用和呼吸[2]。雖然土壤中的總磷含量很高,但磷是植物生長的限制因素之一,因其在許多自然和農業生態系統中被土壤成分迅速固定[3]。土壤中的磷主要以兩種形式存在,即無機磷酸鹽(Pi,主要是H2PO4-和HPO42-)和有機磷酸鹽,但植物獲得的大部分磷以無機磷酸鹽的形式吸收[4-5]。為應對土壤磷酸鹽可用性低的狀況,植物已經進化出許多生理生化方面的改變來優化磷從土壤中的獲取以及植物體內的磷活化,使植物能夠有效地適應低磷環境[6-7]。發掘及利用磷誘導的相關基因對提高作物耐低磷能力具有重要意義[8]。【前人研究進展】MYB家族成員在植物的發育過程和抗逆反應中起著核心作用。MYB蛋白參與許多生理和生化過程,包括調節代謝,控制細胞發育和細胞周期,參與響應各種生物和非生物脅迫,激素合成和信號轉導[9]。在植物中,MYB轉錄因子家族包含4種[10],其中R2R3型MYB基因代表了MYB結構域轉錄因子的主要類型,具有兩個重復序列(R)[11-12],且此類基因能夠調節植物中的多種發育和脅迫反應[13-15]。在擬南芥中,MYB30已被證明可以調節多種脅迫反應[16],包括通過信號通路調節植物在氧化和高溫脅迫下的反應[17]。在擬南芥,番茄和水稻中,其他MYB轉錄因子,包括AtMYB68,LeAN2以及OsMYB55,已被發現參與高溫、干旱脅迫[18]。小麥MYB80的表達已被證明與轉基因擬南芥的耐熱性有關[19]。在水稻中,OsMYB1過表達導致對熱和鹽度脅迫的耐受性增加[20]。【本研究切入點】培育耐低磷高效棉花品種對提高棉花新品種選育有重要意義,有助于提高棉花效益[21]。需研究陸地棉磷高效基因GhMYB4的克隆與表達分析。【擬解決的關鍵問題】以陸地棉新陸早19號為材料,克隆GhMYB4基因,采用生物信息學工具研究其編碼蛋白理化性質,分析其表達特性,為研究棉花GhMYB4基因的生物學功能及培育磷高效利用的棉花新品種提供基因資源。
1 材料與方法
1.1 材 料
采用前期研究篩選出的磷高效棉花品種新陸早19號為材料,在河南科技大學農學院(34°59′ N,112°42′ E)進行大田種植,選取長勢一致的新陸早19號植株采集根、莖、葉、花組織,用于分析GhMYB4基因在陸地棉新陸早19號植株4個不同組織中的表達情況。
1.2 方 法
1.2.1 引物設計
在NCBI網站的EST數據庫中檢索差異表達基因序列得到該基因的相似序列,將所得相似性序列(覆蓋率>50%,相似度>90%)使用DNASTAR的Seqman進行拼接得到重疊群,將所得序列繼續檢索與拼接直至沒有新的相似序列出現,所得即為結果序列conting,利用ORFfinder在線平臺查找開放閱讀框,進行目標基因GhMYB4的克隆與分析。
根據ORFfinder在線平臺查找的開放閱讀框,使用Primer 5.0軟件設計引物,由生工生物工程有限公司合成。表1

表1 所用引物信息
1.2.2 基因組DNA的克隆
1.2.2.1 基因組DNA的提取
取液氮速凍整株新陸早19號植株后在研缽中迅速研磨成粉末轉移至離心管,利用CTAB法提取陸地棉新陸早19號的基因組DNA,向其中添加200 μL的TE緩沖液溶解后置于-20℃下保存備用。
1.2.2.2 基因克隆與測序
以新陸早19的基因組DNA為模板設計如下PCR擴增反應體系(20 μL),冰上操作:2X M5 HiPer plusTaqHiFi PCR mix (with blue dye) 10 μL,Sense primer(10 μM) 0.5 μL,Anti-sense primer(10 μM) 0.5 μL,Template DNA 0.5 μL,Nuclease-free ddH2O 8.5 μL。反應程序為95℃ 3 min;94℃ 25 s,56℃ 25 s,72℃ 40 s,32個循環;72℃ 5 min;-4℃低溫保存。120 V,25 min,1%瓊脂糖凝膠電泳檢測。將目的DNA片段進行膠回收純化后連接pTOPO-T載體,體系(10 μL):M5 HiPer pTOPO-TA Vector 1 μL,10×Enhancer 1 μL,純化后的PCR產物3 μL,滅菌水5 μL。取5 μL連接產物轉化50 μL大腸桿菌DH5ɑ感受態細胞,將菌液涂布在含AMP的LB固體培養基上,37℃培養過夜。隨機挑取單菌落,擴大培養4 h。以所得菌液作模板進行菌液PCR反應,體系(20 μL):2× M5 HiPer plusTaqHiFi PCR mix (with blue dye) 10 μL,M13F 0.5 μL,M13R 0.5 μL,Template DNA 0.5 μL,Nuclease-free ddH2O 8.5 μL。反應程序同上,檢測符合后送至生工生物工程有限公司測序。
1.2.3 cDNA的克隆
1.2.3.1 總RNA的提取及cDNA的合成
取液氮速凍整株新陸早19號植株后在研缽中迅速充分研磨成粉末,后續步驟依照所用試劑盒說明書進行,150 V,15 min,1%瓊脂糖凝膠電泳檢測。詳細步驟參考試劑盒說明書完成cDNA的合成,-20℃保存備用。
1.2.3.2 基因克隆與測序
以新陸早19號的cDNA為模板設計如下PCR擴增反應體系(20 μL),冰上操作:2× M5 HiPer plusTaqHiFi PCR mix (with blue dye) 10 μL,Sense primer(10μM) 0.5 μL,Anti-sense primer(10 μM) 0.5 μL,cDNA 1 μL,Nuclease-free ddH2O 8 μL。PCR反應程序為:95℃ 3 min;94℃ 25 s,56℃ 25 s,72℃ 35 s,35個循環;72℃ 5 min;-4℃低溫保存。120 V,25 min,1%瓊脂糖凝膠電泳檢測。將目的DNA片段進行膠回收純化后連接pTOPO-T載體,體系(5 μL):M5 HiPer pTOPO-TA Vector 0.5 μL,10×Enhancer 0.5 μL,純化后的PCR產物1.8 μL,滅菌水2.2 μL。取5 μL連接產物轉化50 μL大腸桿菌DH5ɑ感受態細胞,培養后隨機挑取單菌落擴大培養后進行菌液PCR反應,電泳檢測符合后送至生工生物工程有限公司進行測序。
1.2.4 生物信息學
使用在線平臺及軟件對基因進行生物信息學分析,預測分析基因的結構、性質等。
1.2.5 半定量RT-PCR
利用半定量RT-PCR技術,分析GhMYB4基因在根、莖、葉、花4個不同組織中的表達狀況。以新陸早19號各組織的cDNA為模板,GhActin作內參基因。設計PCR擴增反應體系(20 μL),冰上操作:2×M5 HiPer plusTaqHiFi PCR mix (with blue dye) 10 μL,GhMYB4-F(10 μM) 0.5 μL,GhMYB4-R(10 μM) 0.5 μL,cDNA 1 μL,Nuclease-free ddH2O 8 μL。PCR反應程序為95℃ 3 min;94℃ 25 s,60℃ 25 s,72℃ 10 s,35個循環;72℃ 5 min;-4℃低溫保存。120 V,25 min,1%瓊脂糖凝膠電泳檢測。表1
1.2.6 熒光定量PCR
采用實時熒光定量PCR技術檢測基因在根、莖、葉、花不同的4個組織中的表達情況。以陸地棉新陸早19號植株的4個不同組織的cDNA為模板,GhActin作為內參基因,進行定量分析。采用SYBR?Green ProTaqHS預混型qPCR試劑盒進行熒光定量,使用的熒光定量PCR儀器型號是CFX96,數據分析采用2-ΔΔcT法。表1
2 結果與分析
2.1 低磷脅迫差異表達序列延伸
研究表明,共檢索發現并下載了16條相似序列,利用DNASTAR將所得序列全部進行拼接,得到了一個新的conting重疊群,序列長度為1 052 bp。
2.2 GhMYB4基因的克隆
研究表明,克隆得到GhMYB4基因的CDS,其條帶符合目的條帶大小。通過無縫克隆連接到pTOPO-T載體上,挑選陽性克隆測序。獲得DNA序列1 000 bp左右與conting序列的一致性較高,為97.08%。獲得cDNA序列800 bp左右與congting序列比對一致性為99.88%。開放閱讀框為長度為774 bp,共編碼257個氨基酸。圖1

注:M:Marker 2000;1:DNA的PCR擴增片段;2:cDNA的PCR擴增片段
2.3 GhMYB4基因結構
研究表明,該基因編碼序列包含5′與3′非編碼序列,僅含有1個內含子,2個外顯子。圖2

圖2. GhMYB4基因結構
2.4 生物信息學
2.4.1 基因編碼蛋白的理化性質
研究表明,該基因共編碼了257個氨基酸,該基因所編碼蛋白的分子式是C1262H2005N375O382S13,脂肪族氨基酸指數是72.92,分子量是28 959.86D等電點為8.87,屬于堿性蛋白。其中亮氨酸的含量占比最大,為10.1%,共26個。在該蛋白中帶負電荷的氨基酸有31個,另外有38個帶正電荷。氨基酸組分會直接影響蛋白的親疏水性,總親水性平均系數為-0.689,不穩定系數是42.19,屬親水性不穩定蛋白。此蛋白中精氨酸(Arg)親水性最強,親水指數為-4.500,異亮氨酸(Ile)疏水性最強,親水指數為+4.500 0。
2.4.2 基因編碼蛋白的保守結構域
研究表明,此基因編碼蛋白匹配所屬的超家族是PLN03091,該家族被歸類為可能包括多個結構域的模型。該基因屬于MYB基因家族,利用SMART分析GhMYB4在13-63、66-114氨基酸處存在兩個SANT結構域,GhMYB4基因可能屬于R2R3-MYB亞族。該基因與其他物種的MYB4氨基酸序列同源性較高,物種間MYB蛋白氨基酸長度基本一致,同源性達71.19%,2個SANT結構域所在的氨基酸幾乎完全一致。圖3

圖3 GhMYB4與其他物種MYB家族同源蛋白的多序列比對
2.4.3 基因編碼蛋白的二級結構預測
研究表明,在NPS@:SOPMA secondary structure prediction網站預測該蛋白二級結構,其中占比最大的無規則卷曲占58.37%,包含150個氨基酸,其次是α-螺旋占比為32.68%,包含84個氨基酸;此蛋白還含有少部分延伸鏈(Extended strand)和β-轉角(Beta turn),其中β-轉角占比為4.67%,有12個氨基酸,延伸鏈有11個氨基酸,占比為4.28%。此蛋白的二級結構由α-螺旋和無規則卷曲占據主體地位所組成,各結構在各個區間分布較為均勻,由于無規則卷曲占比較多,預測其結構比較復雜。
2.4.4 基因編碼蛋白的三級結構預測
研究表明,QMEAN值為0.79,GMQE值為0.33,預測其含有轉錄因子WER,與R2R3-MYB轉錄因子識別靶基因的結構類似。蛋白的三級結構與二級結構分析結果一致,均以α螺旋和無規則卷曲為主體。圖4
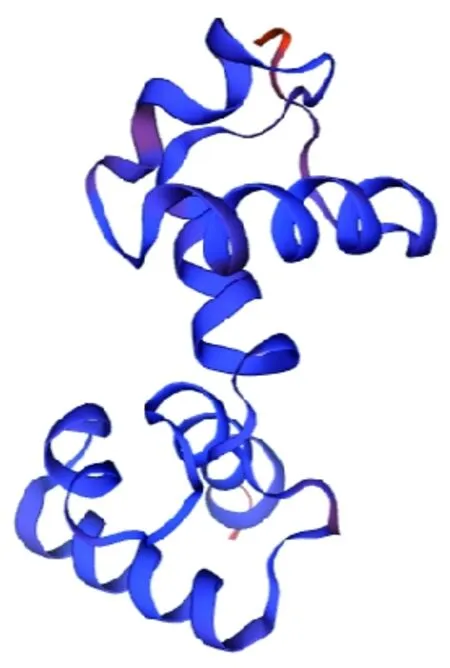
圖4 GhMYB4蛋白的三級結構預測
2.4.5 基因編碼蛋白跨膜結構與信號肽
研究表明,該基因所編碼蛋白不含有跨膜結構域,屬于非跨膜蛋白,并未形成跨膜螺旋區。此基因編碼蛋白有信號肽的概率是0.001 1,其他的可能性高達0.998 9。257位氨基酸中并未出現典型的信號肽趨勢,即該蛋白不存在信號肽。
2.4.6 基因編碼蛋白的亞細胞定位
基因編碼蛋白的亞細胞研究表明,預測定位在細胞核(Nucleus)。該蛋白是一個核蛋白,直接位于細胞核發揮作用。
2.4.7 基因蛋白互作網絡預測
研究表明,獲得的基因編碼蛋白能夠預測到蛋白質的相互作用網絡,預測該基因可能是通過多個蛋白互作調控。
2.4.8 N-糖基化與磷酸化位點
研究表明,N-糖基化對蛋白穩定及功用均會產生及其重要的影響作用。獲得的基因編碼序列位于該蛋白質69~72、233~236位點處存在2個潛在的N-糖基化位點。磷酸化位點與蛋白的功能、結構都有很大的關系,此蛋白中占比最大的是絲氨酸和蘇氨酸磷酸化位點,而酪氨酸占比較少。
2.4.9 基因編碼蛋白序列系統進化樹
研究表明,在NCBI數據庫利用BLASTp檢索氨基酸序列的同源序列,下載了另外13條不同物種的蛋白序列,木槿(Hibiscussyriacus)、可可樹(Theobromacacao)、榴蓮(Duriozibethinues)、桃樹(Prunuspersica)、蘋果樹(Malusdomestica)、月季(Rosachinensis)、擬南芥(Arabidopsisthaliana)、冬瓜(Benincasahispida)、黃瓜(Cucumissativus)、枇杷(Rhaphiolepisbibas)、梅花(Prunusmume)、芝麻(Sesamumindicum)、核桃(Juglansregia)。棉花蛋白序列與木槿、可可樹、榴蓮的親緣關系最近,與其余物種的親緣關系較遠,不在一個大支上。圖5

圖5 GhMYB4基因系統進化樹
2.5 半定量RT-PCR
研究表明,GhMYB4基因高表達于根,微量表達于花,中量表達于莖和葉。圖6

注:M:Marker 2000
2.6 基因相對表達量
研究表明,棉花磷高效基因在根、莖、葉和花4個組織中都有一定量的表達;但GhMYB4基因在新陸早19號植株的不同組織中的表達情況各不相同,其中在新陸早19號的根系中的相對表達量最高,其次是葉,而在花組織的表達相對較少,莖中的表達量略高于花,根中的表達量約為花中表達量的2倍。圖7

圖7 GhMYB4在棉花不同組織中的相對表達
3 討 論
磷影響植物的生物調節(如能量代謝、信號轉導和酶調節)和生理過程(如花青素積累和向根際釋放有機酸)。為了在缺磷條件下維持細胞內磷穩態,植物主要是通過從土壤中獲取磷、磷從根到芽的轉移以及植物體內部磷的再活化來實現的[22]。盡管許多研究報告了磷相關的轉錄因子,但在磷脅迫中直接調節磷酸轉運蛋白的幾種轉錄因子的功能與分子調控機制仍未在棉花中得到表征[23]。MYB蛋白包括一大家族的植物轉錄因子,其成員在植物生物過程中執行多種功能。尚未在棉花中對該基因家族進行全基因組鑒定。第一個植物MYB基因是從玉米中分離出來的,其編碼參與花青素生物合成的c-MYB樣轉錄因子,隨后在許多植物中鑒定出越來越多的植物R2R3-MYB基因成員[24]。研究表明,R2R3-MYB家族基因除了參與各種生理活動外,還在植物對非生物脅迫的反應中起重要作用[25]。
4 結 論
所得基因序列與擬南芥中的MYB家族中的MYB4基因同源性較高,從陸地棉新陸早19號中克隆得到了一個MYB4類似基因,并將其命名為GhMYB4,該基因屬于MYB超家族成員。該基因的結構相對較為簡單,僅有一個內含子,GhMYB4蛋白相對分子質量(Molecular weight)是28 959.86D,理論等電點(Theoretical pI)為8.87,是堿性蛋白,具備不穩定性與親水性。此蛋白的二級結構由α-螺旋和無規則卷曲占據主體地位所組成,通過同源建模可知該基因三級結構預測其含有轉錄因子WER。該基因編碼蛋白不存在信號肽和跨膜結構域。該蛋白存在2個潛在的N-糖基化位點和多個磷酸化位點。亞細胞定位結果顯示該基因編碼蛋白在細胞核中,預測其能夠通過蛋白質的相互作用參與調控。該基因在棉花根中的表達量是最大的,在花中表達相對較小,中量表達于莖和葉,GhMYB4基因在根系發揮作用,在棉花的磷高效利用信號調控過程中具有重要作用。

