小麥株高相關基因TaGAMyb-B在水稻中的功能研究
劉 娟,馮玉梅,韓 冰 ,邢燕平,李淑芬,楊 燕
(1.內蒙古農業大學 生命科學學院 植物生物技術功能實驗室,內蒙古 呼和浩特 010010;2.內蒙古自治區農牧業科學院,內蒙古 呼和浩特 010031)
小麥(TriticumaestivumL.)屬于禾本科(Poaceae)小麥族(Triticeae dumort)小麥屬(TriticumL.)。作為世界三大糧食作物之一,全球有近35%的人口以小麥為主食,據預測,到2050年,全世界人口將達到97億,人類對小麥的需求將會持續不斷地增加[1-2],隨著農業生產的快速發展,農作物的產量雖有了顯著提高,但由于生產條件改變所引起的倒伏問題也頻繁發生,因此,培育抗倒伏品種成為作物高產育種的主要目標之一。在小麥育種工作中,小麥品種、環境因素和栽培措施都會使小麥發生倒伏現象,小麥自身品種因素作為主要因素,主要包括株高、節間長度、莖壁厚度、節間重量以及節間中纖維素和木質素含量等[3]。株高的建成直接影響到小麥的抗倒伏性,研究發現,小麥株高與倒伏呈顯著正相關,在沒有倒伏的前提下,小麥株高與產量呈正相關[4-5]。株高的降低增加了植株的抗倒伏性,并使更多的營養物質轉移到發育的籽粒中[6]。目前,通過控制株高來優化小麥株型,增強其倒伏性已經成為小麥高產育種的重點工作。
小麥株高屬于微效多基因控制的復雜數量性狀,在其建成過程中會受Rht-1、Rht-2、Rht8、GAMyb、GA20ox和GA3ox等遺傳因素[7-8]以及環境因素的影響[9]。GAMyb基因是從大麥糊粉層細胞的cDNA文庫中分離發現[10],屬于GAs誘導的R2R3型MYB類轉錄因子[11],在GA信號轉導途徑中起正向調控作用[12],具有促進種子萌發、花粉萌發及莖稈伸長等功能[13-15]。在小麥中,TaGAMyb基因定位于3AL3-0.42-0.78、3BL3-0.63-1.00和3DL3-0.81-1.00染色體上,Haseneyer等[16]在42份小麥的A、B和D染色體上分別鑒定出1,7,3種單倍型,由此可以看出,不同基因型小麥材料中TaGAMyb-A是完全保守的,而TaGAMyb-B和TaGAMyb-D存在多個等位變異,TaGAMyb-B的等位變異更加豐富。劉進英等[17]在不同休眠特性的小麥材料中克隆了TaGAMyb基因在3A、3B和3D染色體上的全長,發現TaGAMyb-B基因在小麥中存在2種等位基因,將其分別命名為TaGAMyb-Ba(GenBank:KU589288)和TaGAMyb-Bb(GenBank:KU589289),與TaGAMyb-Ba序列相比,TaGAMyb-Bb在第一內含子存在84 bp的插入序列。劉夢等[18]利用93份春小麥自然群體研究發現,TaGAMyb-Ba和TaGAMyb-Bb2種等位基因型材料與春小麥株高顯著相關。本研究將利用農桿菌介導轉化技術進一步明確小麥TaGAMyb-B第一內含子區的84 bp差異序列在水稻中的功能。
1 材料和方法
1.1 試驗材料
水稻遺傳轉化受體:粳稻日本晴。
1.2 試驗引物
根據內蒙古農業大學生命科學學院植物生物技術功能實驗室在GenBank中注冊的TaGAMyb-Ba和TaGAMyb-Bb的序列,設計特異性引物擴增TaGAMyb-Ba和TaGAMyb-Bb(第一內含子存在84 bp的插入序列)的基因組序列。所用引物均由北京六合華大基因科技有限公司合成(www.bgi-write.com),序列信息見表1。
1.3 試驗方法
1.3.1 水稻轉基因植株的獲得 將構建好的植物融合表達載體(pCAMBIA1390-Ubi-TaGAMyb-Ba/b-GFP)和空載體(pCAMBIA1390-Ubi-GFP)經酶切和PCR雙重鑒定正確后轉化農桿菌EHA105感受態細胞,利用農桿菌侵染技術侵染日本晴種子的愈傷組織,經篩選、繼代培養、鑒定獲得陽性再生苗[19],繼續培育,獲得T1種子。上述轉基因水稻材料種植于安徽省農業科學院崗集基地。
隨機選取T1各轉基因型水稻和對照組共21個株系,每個株系隨機選取8~10粒種子進行萌發,培育到三葉期時,剪取每個株系的單株幼嫩葉片,提取基因組DNA,PCR鑒定陽性株系。接著,分別選取各轉基因型水稻T1陽性株系進行小苗的培育(28 ℃,白天光照16 h/晚上光照8 h),待長至三葉期時,剪取幼苗葉片再進行陽性單株的鑒定,將陽性單株移栽繼續進行水培,每個株系至少20個單株,培養獲得T2種子。上述轉基因水稻材料種植于河南省濮陽市試驗田。
酶切反應體系為:質粒DNA 7 μL,內切酶KpnⅠ和PmlⅠ/BamHⅠ各1 μL,10×K Buffer 1 μL,BSA 2 μL,加RNase Free ddH2O至20 μL。
PCR反應體系為:模板DNA 1 μL,2× EasyTaq PCR SuperMix 6.2 μL,引物0.15 μL(濃度:0.025 nmol/μL),加滅菌雙蒸水至15 μL。PCR反應程序為:95 ℃預變性5 min;94 ℃變性30 s,退火溫度見表1,時間為30 s,72 ℃延伸30 s,35個循環;72 ℃延伸10 min,4 ℃保存。用1%的瓊脂糖凝膠電泳檢測,Gold View核酸染料染色,緩沖體系為1×TAE溶液,100 V電壓下電泳15 min,在凝膠成像儀下觀察并照相。
1.3.2 轉基因后代的鑒定與分析
1.3.2.1 T1轉基因植株的PCR鑒定 以相同轉化條件下轉化空載體的轉基因材料作為對照組,以排除報告基因或其他非目標基因的表達對目標基因轉錄及植株表型的影響[20]。剪取轉基因水稻的幼嫩葉片,用新型植物基因組DNA提取試劑盒提取基因組DNA,用表達載體特異性引物對JDF/R(該引物橫跨載體和目的基因設計)部分目的基因和部分載體序列進行PCR擴增,以檢測轉基因后代中的PCR陽性株系。
1.3.2.2 轉錄本表達分析 提取轉基因水稻總RNA并反轉錄為cDNA。以水稻Q-OsActinF/R作為內參,并以轉基因水稻種子、根、莖以及葉的cDNA(稀釋20倍)為模板,每個樣品進行3次技術重復,3次生物學重復。分析結果采用2-ΔΔCt計算[21]。具體步驟見Feng等[22]的方法。
1.3.3 脅迫處理 選取飽滿的T2轉基因水稻種子,經無水乙醇浸泡消毒后,進行幼苗培育(28 ℃,白天光照16 h/晚上光照8 h),待生長至14 d,采用澆灌的方式分別進行以下脅迫處理。激素脅迫:在培養皿中加入100 mL 0.2 mg/L的GA3;鹽脅迫:在培養皿中加入100 mL 150 mmol/L的NaCl;干旱脅迫:在培養皿中加入100 mL 300 mmol/L的甘露醇。分別于處理前(0 h)和處理后2,6,12,24,48 h取樣、液氮速凍,-80 ℃保存備用,每個試驗重復3次。
1.3.4 T2轉基因水稻表型鑒定 收獲T2轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻,每株系選取10棵單株進行株高,穗長,第一、二、三莖長及莖粗,百粒質量,穗粒質量和分蘗等表型鑒定和分析。
1.3.5 轉基因水稻第二節間石蠟切片制作與分析 分別選取轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻的T2成熟種子進行培養(28 ℃,白天光照16 h/晚上光照8 h)。待幼苗發芽并生長至14 d剪取單株第二莖節,用于制作轉基因水稻第二節間石蠟切片,制作方法參照毛曉霞[23]的方法。
2 結果與分析
2.1 重組載體的鑒定
將構建好的重組載體TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP經過酶切鑒定(圖1)與PCR鑒定均得到預期大小的目的片段(圖2),同時測序結果也進一步表明表達載體TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP構建成功。
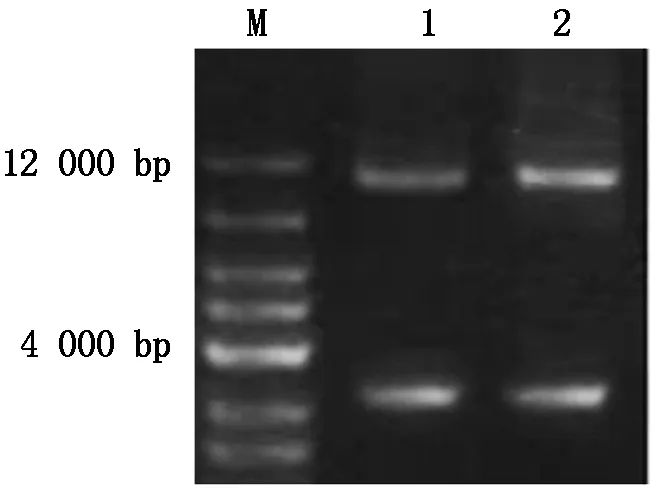
M.DL10000 bp DNA Marker;1.Ubi-TaGAMyb-Bb-GFP;2.Ubi-TaGAMyb-Ba-GFP.
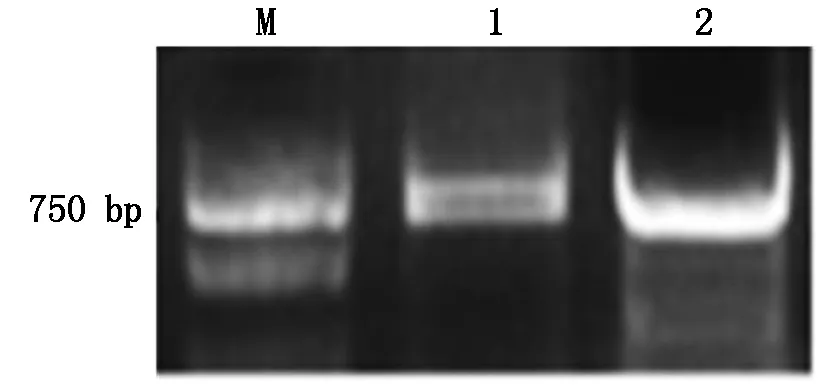
M.DL1000 bp DNA Marker;1.TaGAMyb-Bb(764 bp);2.TaGAMyb-Ba(659 bp).
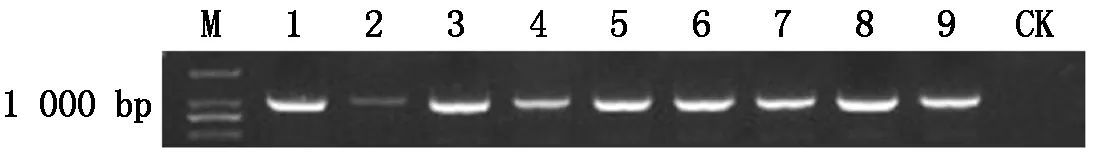
M.DL2000 bp DNA Marker;1—9.部分轉基因水稻陽性單株;CK.轉基因水稻陰性單株(沒有該檢測基因)。 M.DL2000 bp DNA Marker;1—9.Some positive individuals of transgenic rice; CK.Negative individuals of transgenic rice(no gene for this test).
2.2 轉基因水稻的鑒定
2.2.1 轉基因水稻T1的PCR鑒定 用特異性引物JDF/R對轉基因水稻T1各株系單株進行PCR陽性檢測(圖 3),在檢測的20個轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻株系中,共檢測到19個陽性單株,轉基因效率為95%。
2.2.2 轉基因水稻不同組織器官中TaGAMyb-B轉錄本的表達分析 對轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻株系T2種子以及生長30 d幼苗的根、莖、葉進行RT-qPCR分析,結果表明,在轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻被檢測的各組織中,TaGAMyb-B的轉錄本均有表達,且在各組織中轉錄本表達水平的趨勢為莖>根>種子>葉(圖4)。
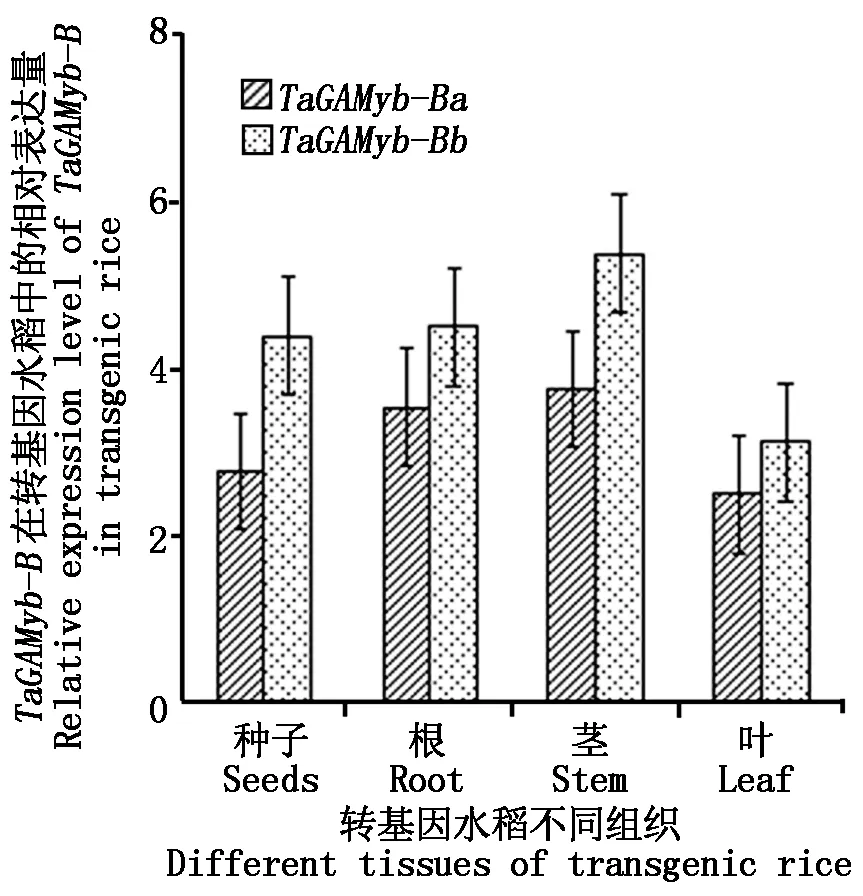
圖4 轉基因水稻中TaGAMyb-B基因的相對表達量Fig.4 The relative expression levels of TaGAMyb-B in transgenic rice
2.2.3 轉基因水稻在不同脅迫處理下TaGAMyb-B轉錄本表達變化 小麥株高由多個節間構成,基部節間的健壯程度與小麥抗倒伏性相關程度為:第二節間>第一節間>第三節間[24]。為進一步研究轉基因水稻在應對不同非生物脅迫處理時TaGAMyb-B基因轉錄本的表達變化,對轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻T2的第二莖節分別用NaCl(150 mmol/L)、甘露醇(300 mmol/L)和GA(0.2 mg/L)處理2,6,12,24,48 h,以處理前0 h作為對照。RT-qPCR分析結果顯示(圖5):在NaCl(150 mmol/L)脅迫處理不同時間的第二莖節材料TaGAMyb-B在各處理時期的表達量總是TaGAMyb-Bb-GFP大于TaGAMyb-Ba-GFP;并且轉錄本表達量的變化趨勢在處理6 h之前,轉TaGAMyb-Ba-GFP材料幾乎沒有變化,而轉TaGAMyb-Bb-GFP基因型材料TaGAMyb-B轉錄本的表達量降到了最低值;從NaCl處理6 h之后,TaGAMyb-B轉錄本的表達量在2種轉基因類型材料中均是先升高后降低的趨勢,且在處理24 h時再次達到峰值。
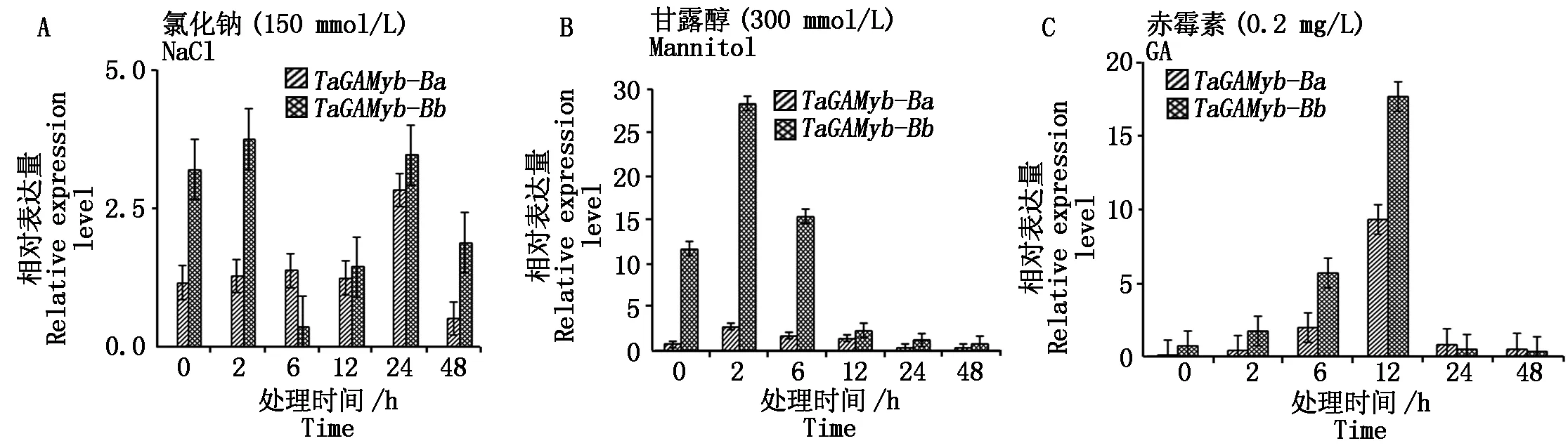
圖5 不同脅迫處理下轉基因水稻中TaGAMyb-B基因的表達變化Fig.5 Expression changes of TaGAMyb-B in transgenic rice with during different stress treatments
在甘露醇(300 mmol/L)脅迫處理不同時間的第二莖節材料,TaGAMyb-B在各處理時期的表達量總是TaGAMyb-Bb-GFP大于TaGAMyb-Ba-GFP。而且轉錄本表達量的變化趨勢均為先迅速升高后緩慢降低,并且在2種轉基因材料中,均是在處理2 h時TaGAMyb-B轉錄本的表達量達到峰值,其中在干旱處理2,6 h時,TaGAMyb-B轉錄本的表達量是對照組的1.32~2.40倍。
在GA(0.2 mg/L)脅迫處理不同時間的第二莖節材料,TaGAMyb-B在各處理時期的表達量總是TaGAMyb-Bb-GFP大于TaGAMyb-Ba-GFP。TaGAMyb-B在2種轉基因材料TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP中的表達量先逐漸升高后又迅速降低;在GA處理12 h,TaGAMyb-B的表達量分別是對照的9.34,17.61倍;在處理2~12 h過程中,第二莖節中TaGAMyb-B的表達量為TaGAMyb-Bb-GFP大于TaGAMyb-Ba-GFP;處理24~48 h的過程中,第二莖節中TaGAMyb-B的表達量為TaGAMyb-Ba-GFP大于TaGAMyb-Bb-GFP。
以上非生物脅迫處理的試驗結果表明,轉基因水稻中TaGAMyb-B表達量會受到NaCl、甘露醇及GA誘導脅迫的影響;TaGAMyb-B在各處理各時期的表達量總是TaGAMyb-Bb-GFP大于TaGAMyb-Ba-GFP;且相較于轉TaGAMyb-Ba-GFP基因型水稻,轉TaGAMyb-Bb-GFP基因型水稻在應對外界非生物脅迫處理時TaGAMyb-B轉錄本的表達量波動范圍更大。
2.2.4 轉基因水稻T2表型觀察 對T2各轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻成熟期表型進行觀察統計表明,轉TaGAMyb-Ba-GFP、TaGAMyb-Bb-GFP和轉空載體對照基因型的表型統計分析如下:平均分蘗數分別為8.27,6.33和4.10(TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP與對照相比差異顯著,P=0.00和P=0.006),且轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻二者之間的分蘗數也呈顯著差異(P=0.015);穗長分別為16.42,14.40,15.40 cm,且轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻間的穗長呈顯著差異(P=0.007);第一莖粗分別為3.48,2.97,3.18 mm,第二莖粗分別為3.04,2.50,3.00 mm,第三莖粗分別為2.53,2.14,2.44 mm,且轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻二者之間的第一莖粗、第二莖粗、第三莖粗均呈顯著差異(P=0.003,P=0.00和P=0.00);第一莖節長分別為1.70,2.00,1.63 cm,第二莖節長為5.97,6.43,5.60 cm,第三莖長為10.90,11.89,10.30 cm(圖6)。以上結果表明,轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因顯著影響了轉基因水稻的莖粗、分蘗數和穗長。
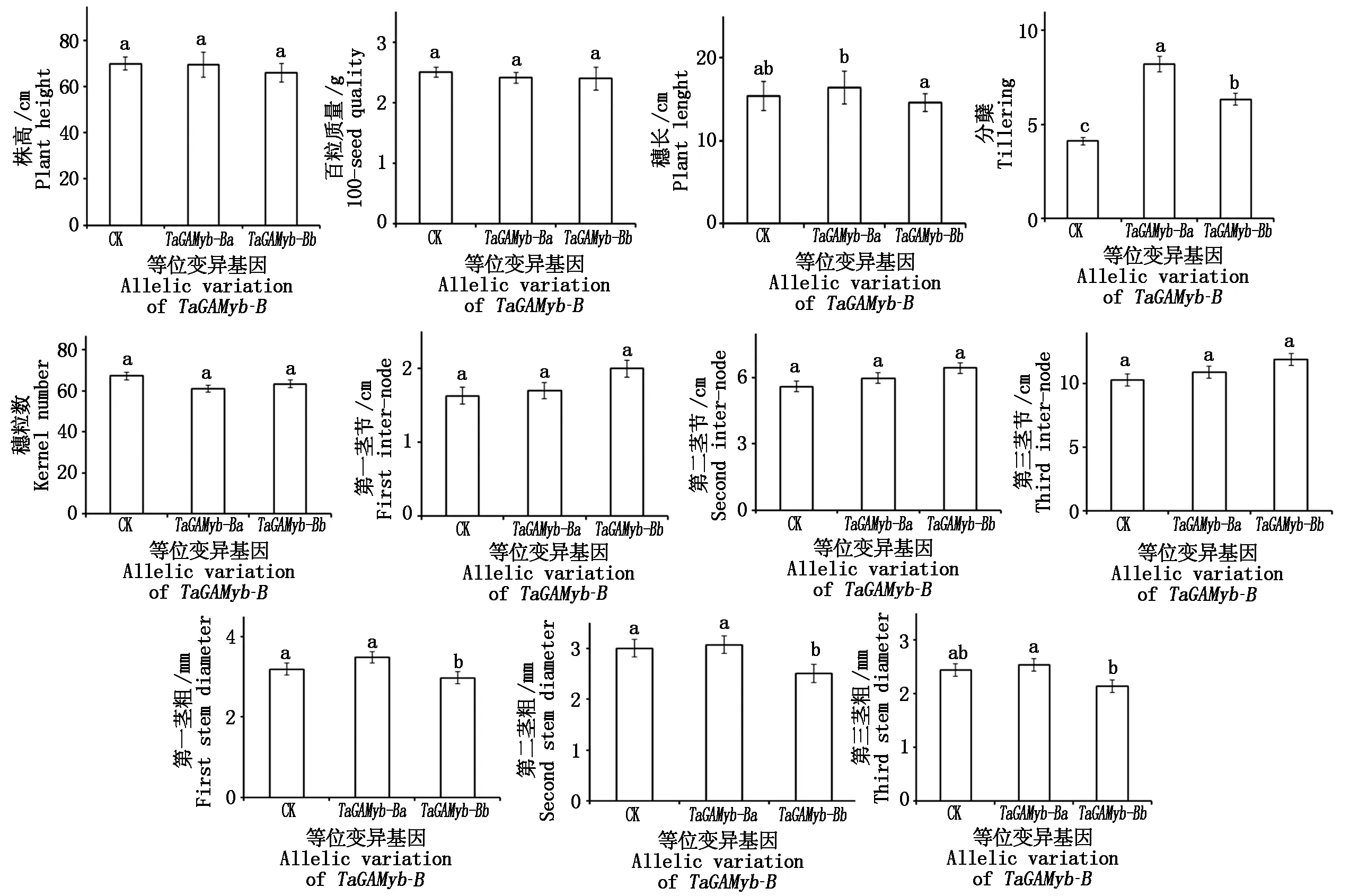
不同小寫字母表示差異顯著,P<0.05。圖8同。Different lowercase letters indicate significant different,P<0.05.The same as Fig.8.
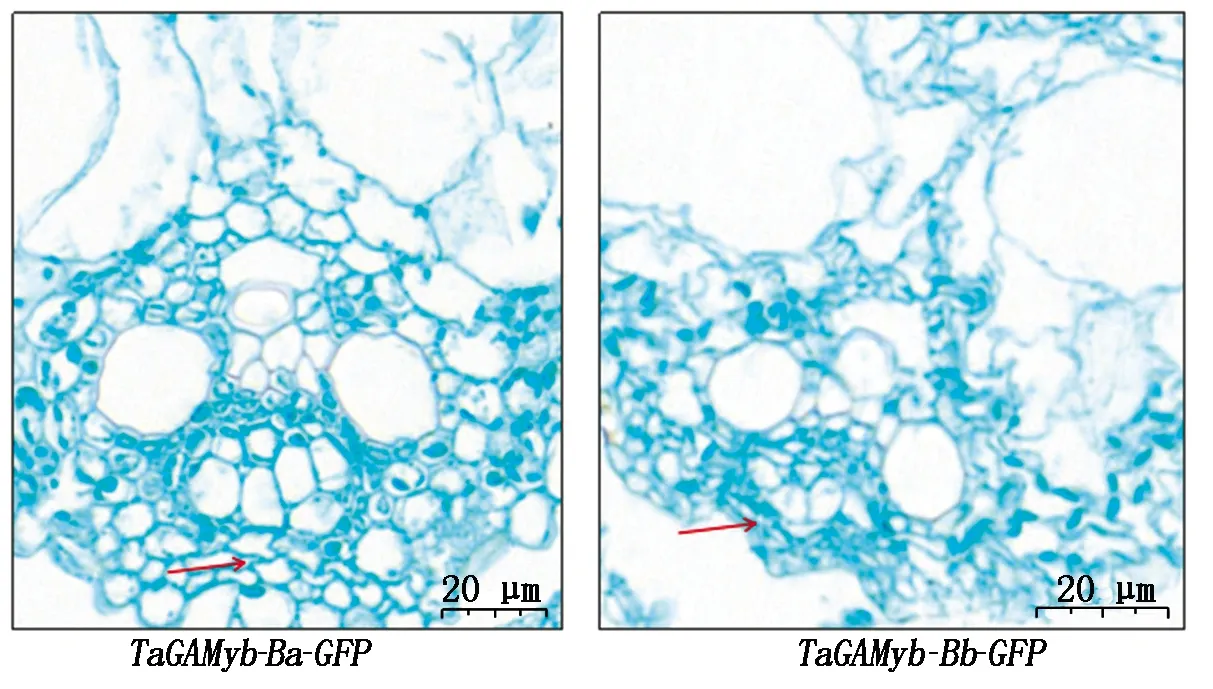
圖7 轉基因水稻第二節間橫切面Fig.7 Transverse sections of second stem section in transgenic rice
2.2.5 轉基因水稻T2第二莖節厚壁細胞觀察 馬躍芳等[25]研究發現,水稻抗倒伏品種具有矮而強度大的莖稈以及短而結實的第二節間,水稻的莖稈由節間組成,節間由表皮、厚壁組織、維管束以及薄壁組織等組成,其中,厚壁組織對莖支持起關鍵作用。本研究通過T2表型鑒定發現:轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻的莖長和莖粗存在顯著差異。進一步對2種轉基因材料莖節制作了組織切片,通過對切片的觀察和測量發現:轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻橫切面厚壁組織平均厚度分別為10.26,6.89 μm(圖 7),二者呈顯著差異(P=0.025)(圖8);統計轉基因水稻莖節縱切面連續分布的30個完整厚壁細胞的長度,結果顯示,轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻的厚壁細胞的平均長度分別為23.1 ,40.6 μm(圖9),二者呈極顯著差異(P=0.00)(圖10)。以上研究結果進一步說明,TaGAMyb-B中84 bp的差異顯著影響了厚壁組織細胞的寬度和厚壁細胞的長度,進而影響了水稻的莖粗和莖長。
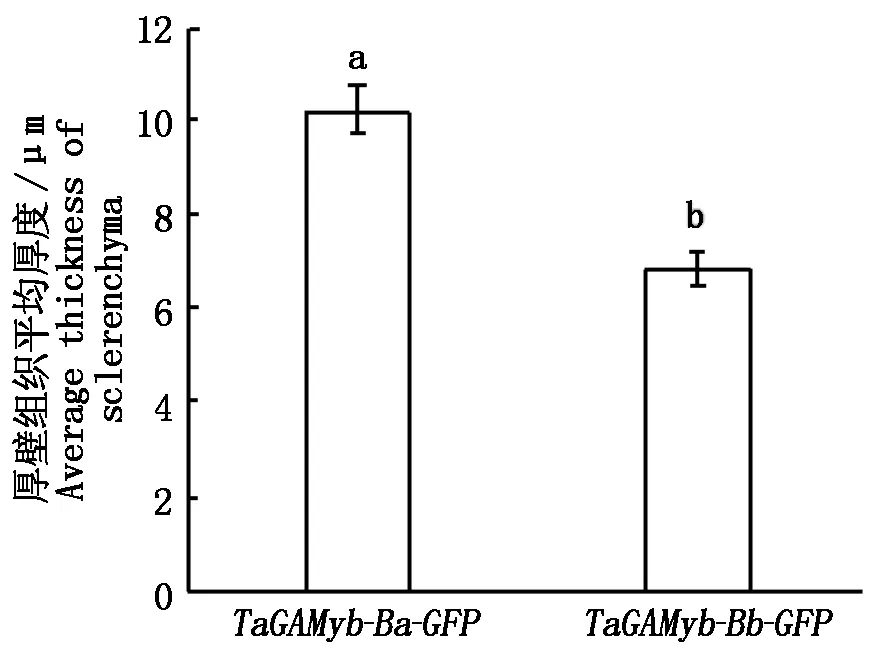
圖8 轉基因水稻第二節間橫切面厚壁組織平均厚度Fig.8 Average thickness of sclerenchyma in transverse sections of second stem section in transgenic rice
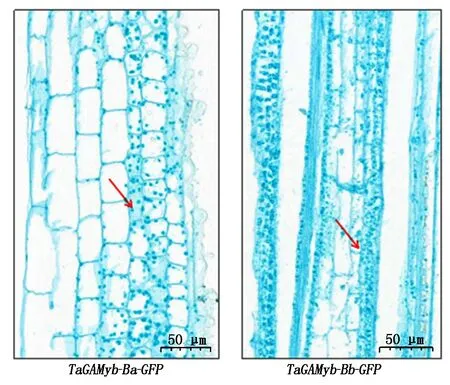
圖9 轉基因水稻第二節間縱切面Fig.9 Longitudinal sections of second stem section in transgenic rice
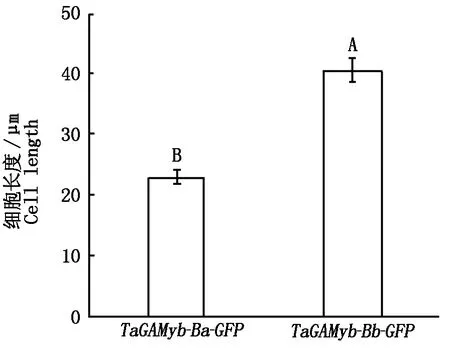
不同大寫字母表示差異極顯著,P<0.01。Different capital letters indicate extremely significant,P<0.01.
3 結論與討論
越來越多的研究發現,內含子中存在調節基因表達的增強元件,對基因的表達具有正向調控作用[26],根據本實驗室發現的TaGAMyb-Bb在第一內含子存在一個反向重復的84 bp插入序列,經Blast對比后發現,該重復序列與小麥中國春一個腳手架基因(GenBank:HG670306.1)具有100%的同源性[17]。劉夢等[18]在對TaGAMyb的研究中發現,TaGAMyb-Ba等位基因型材料株高顯著高于TaGAMyb-Bb等位基因型材料,同樣在轉TaGAMyb-Ba-GFP和TaGAMyb-Bb-GFP基因型水稻的T2表型鑒定中發現,平均株高為TaGAMyb-Ba-GFP大于TaGAMyb-Bb-GFP。進一步分析發現,轉基因水稻的第一、第二和第三莖節平均長度均為TaGAMyb-Ba-GFP小于TaGAMyb-Bb-GFP,第一、二、三莖節粗度均為TaGAMyb-Ba-GFP大于TaGAMyb-Bb-GFP(P=0.00),并且進一步利用細胞組織學觀察驗證了以上結果。證明84 bp的序列缺失形成的等位基因TaGAMyb-Ba類型材料不僅增高了水稻植株的高度,而且增加了莖稈的粗度。這一結果和前人研究的關于GAMYB基因具有促進莖稈伸長的功能[13-15]這一結果是相符的,不同之處在于本研究是TaGAMyb-B第一含子中84 bp序列的缺失導致水稻莖稈的伸長和增粗,這一結果將對增加小麥生物產量、籽粒產量并且增加其莖稈的抗倒伏性具有非常重要的意義。
干旱、高鹽、激素處理等非生物脅迫都是影響植物生長發育和產量的重要因素。因此,研究應答非生物脅迫的基因和培育抗逆性新品種,對于提高作物產量具有重要的意義。研究發現,轉錄因子在植物對非生物脅迫的應答中起著重要的作用,而MYB轉錄因子作為植物最大的轉錄因子家族之一,在植物的生長發育、代謝、生物和非生物脅迫應答中起著重要的調控作用[24,27]。本研究發現,TaGAMyb-B廣泛表達于轉基因水稻不同的組織器官中,并且轉基因水稻第二節間中TaGAMyb-Bb表達量最高,同時其受到NaCl、甘露醇和GA等各種脅迫處理的影響,在各種脅迫處理下均為TaGAMyb-Bb-GFP大于TaGAMyb-Ba-GFP,同時在各種非生物脅迫處理試驗中,TaGAMyb-B的轉錄本表達變化趨勢表現不同。以上結果表明,TaGAMyb-B基因84 bp的序列差異引起該基因的轉錄本表達量的變化,也引起了應對不同非生物脅迫應答時調控能力的改變。

