腦膠質瘤組織Pax3、P4HA1、Rac1基因表達與全切術后復發的關系及意義
王杰 張川
由于腦膠質瘤放化療的抵抗性、增殖遷移能力強等,導致腦膠質瘤術后復發率較高,因此如何預防及延緩復發是現階段研究的重點與熱點[1]。盡管目前關于腦膠質瘤復發影響因素的研究較多,但缺乏關于分子機制的研究,且根據既往資料,即使是一般資料均衡可比患者,術后復發情況亦不盡相同[2,3],提示有其他機制影響了腦膠質瘤術后的復發。組織配對盒基因3(Pax3)可調控細胞增殖、改變特異細胞系分化、促進細胞自我更新等,下調Pax3的表達可抑制胃癌細胞增殖進展,并能誘導胃癌細胞凋亡[4]。脯氨酰4-羥化酶亞基α1(P4HA1)可改變細胞外基質成分,在肺癌等惡性腫瘤中表達升高,且P4HA1過表達能通過促進肺癌細胞增殖和轉移,介導不良預后發生[5]。Rac GTP酶激活蛋白酶1(Rac1)在乳腺癌中,其激活是與放化療抵抗性相關的預后危險因素[6]。本研究探討組織Pax3、P4HA1、Rac1基因表達與腦膠質瘤全切術后復發關系及意義。
1 資料與方法
1.1 一般資料 選取2019年3月至2021年6月80例腦膠質瘤全切術患者作為研究對象,其中男51例,女29例;年齡30~69歲,平均年齡(51.69±10.08)歲。根據是否復發分為復發組、未復發組。經本院倫理委員會審核通過。患者及親屬知情,自愿簽署同意書。2組年齡、體重指數、性別比、術前KPS評分比較,差異無統計學意義(P>0.05)。復發組病理分級、術后輔助治療情況與未復發組比較,差異有統計學意義(P<0.05)。見表1。

表1 2組基線資料比較
1.2 納入與排除標準
1.2.1 納入標準:①符合腦膠質瘤診斷標準[7];②具有腦膠質瘤全切術的指征[7];③首次接受治療,承諾可配合隨訪;④患者或家屬簽署知情同意書;⑤年齡>18歲。
1.2.2 排除標準:①合并其他惡性腫瘤及腦部轉移瘤者;②脫落、失訪者;③身體一般情況較差,不能耐受手術者;④有出血傾向或合并出血類疾病者。
1.3 方法
1.3.1 主要儀器與試劑:Trizol RNA提取試劑盒(美國Thermo Fisher公司);氯仿(武漢易司拓普科技);Quanti Tect 反轉錄試劑盒(北京天根公司);Taq DNA聚合酶(美國Thermo Fisher公司);dNTP(上海博雅生物);引物設計(上海擎科);PCR緩沖液(武漢卡諾斯科技);實時熒光定量PCR儀(美國MJ,PTC-100型);核酸電泳儀(上海譜振生物EPZ-100);紫外可見分光光度計(美國PHARMACIA公司,UV-2000型)。
1.3.2 組織Pax3、P4HA1、Rac1基因表達檢測:取手術切除的腦膠質瘤組織標本,充分研磨后用Trizol RNA提取試劑盒提取RNA。加入氯仿混勻孵育后離心,將上清轉移至新的離心管中,加入等體積的異丙醇,孵育、離心、棄上清。75%乙醇洗滌沉淀后離心,真空干燥5 min,加入水溶解RNA,逆轉錄成cDNA后進行熒光定量聚合酶鏈反應,反應體系包括上下游引物各1 μl、Taq DNA聚合酶1 μl、cDNA 5 μl、dNTP 1 μl、PCR緩沖液10 μl、ddH2O 2 μl,反應條件:93℃預變性3 min,93℃預變性30 s,55℃退火45 s,72℃延伸45 s,40個循環,各檢測基因表達量采用分析2-ΔΔCt法。見表2。

表2 Pax3、P4HA1、Rac1基因引物序列
1.4 觀察指標 (1)比較2組Pax3、P4HA1、Rac1基因表達;(2)分析腦膠質瘤全切術后復發的相關因素;(3)分析Pax3、P4HA1、Rac1基因表達預測復發的價值;(4)比較不同Pax3、P4HA1、Rac1基因表達水平患者術后復發時間。
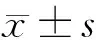
2 結果
2.1 2組組織Pax3、P4HA1、Rac1基因表達比較 復發組組織Pax3 mRNA、P4HA1 mRNA、Rac1 mRNA表達高于未復發組(P<0.05)。見表3。
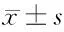
表3 2組組織Pax3、P4HA1、Rac1基因表達比較
2.2 復發多因素分析 校正了病理分級、術后輔助治療情況后,Pax3 mRNA、P4HA1 mRNA、Rac1 mRNA仍是復發的獨立相關危險因素(P<0.05)。見表4。

表4 復發的Logistic回歸分析
2.3 組織Pax3、P4HA1、Rac1基因表達預測復發的ROC曲線 繪制各基因預測復發的ROC曲線顯示,Pax3 mRNA、P4HA1 mRNA、Rac1 mRNA預測復發的AUC依次為0.840、0.825、0.828,采用SPSS的LogP模式構建三者聯合預測復發的Logistic預測模型,結果顯示其AUC為0.940。見表5,圖1。

表5 組織Pax3、P4HA1、Rac1基因表達預測復發的ROC分析結果

圖1 組織Pax3、P4HA1、Rac1基因表達預測復發的ROC曲線
2.4 不同Pax3、P4HA1、Rac1基因表達水平患者復發時間比較 Pax3 mRNA、P4HA1 mRNA、Rac1 mRNA高水平患者復發時間短于低水平患者(P<0.05)。見表6。
3 討論
目前腦膠質瘤仍缺乏行之有效的療法,即使給予手術+放化療,患者總體生存率仍較低,其最主要的原因在于術后復發。朱一碩等[8]報道,病理分級、術后輔助治療情況均與術后復發顯著相關,本研究得到了類似的結論,且本研究還發現,校正了病理分級、術后輔助治療情況后,Pax3 mRNA、P4HA1 mRNA、Rac1mRNA仍是復發的獨立相關危險因素。
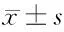
表6 不同Pax3、P4HA1、Rac1基因表達水平患者復發時間比較 月,
Pax3 mRNA系胚胎發育過程中一種重要的干細胞轉錄因子,神經細胞向神經膠質細胞分化過程中,Pax3 mRNA能負性調節神經膠質纖維酸性蛋白,從而影響神經膠質細胞分化過程[9]。沉默Pax3 mRNA被證實可抑制胃癌、前列腺癌等多種癌癥進展,故Pax3 mRNA可能是多種惡性腫瘤共享的促癌因子[10,11]。聶德康等[12]報道,表明Pax3 mRNA與腦膠質瘤復發有關。Pax3 mRNA高表達患者腦膠質瘤細胞惡性程度高,增殖、遷移能力強,術后腦膠質瘤細胞自我更新、重生概率較大,所以復發風險增大。Pax3 mRNA預測復發的AUC為0.840,在單一指標中最高,且其單一應用時,預測復發的特異度達90.91%,可作為預測腦膠質瘤術后復發的一個特異性標志物。
P4HA1可調節細胞基質重塑,起到影響腫瘤黏附、遷移等作用,在乳腺癌、黑色素瘤等腫瘤中均起到促癌因子作用,但在腦膠質瘤患者中的研究較少[13,14]。本研究結果顯示,復發組P4HA1 mRNA高于未復發組,與術后復發有關。方勝等[15]體外細胞實驗說明P4HA1 mRNA高表達對腦膠質瘤復發起到消極作用。本研究發現,P4HA1 mRNA預測復發的AUC為0.825,敏感度為75.00%,特異度為81.82%,呈現出一定預測價值。可見P4HA1 mRNA有望成為預防腦膠質瘤復發的一個作用靶點,沉默或抑制P4HA1 mRNA表達,可改善腫瘤惡性程度,從而為臨床預防腦膠質瘤復發提供了一個新思路。
Rac1 mRNA定位于染色體7p22,被激活后可影響細胞的形態極化,促進細胞骨架重建。本研究顯示,復發組Rac1 mRNA表達高于未復發組,與腦膠質瘤術后復發獨立相關。一方面高表達的Rac1 mRNA可增強癌細胞的干性,從而增加術后復發的風險;另一方面高表達的Rac1 mRNA可增加腦膠質瘤細胞的放化療耐性,抑制Rac1 mRNA能通過靶向腫瘤代謝,使癌細胞對DNA損傷劑敏感,進而逆轉腫瘤化療抗性[16,17]。Rac1 mRNA最重要的下游效應器之一是絲氨酸/蘇氨酸激酶、p21激活激酶1,而絲氨酸/蘇氨酸激酶、p21激活激酶均是癌癥易感性的重要物質[18]。因此靶向Rac1 mRNA可能通過癌細胞干性、腫瘤代謝、放化療敏感性等多個途徑,減少腦膠質瘤術后的復發,促進病情的良好轉歸。但Baker等[19]報道,大量侵襲性癌細胞系顯示出的Rac1水平升高,是檢測方法造成的誤導性結論,具有低Rac1激活水平的癌癥仍然顯示抗Rac1抗體的高信號,本研究觀點與之不同,其原因可能是,以上報道所用的檢測方法是免疫熒光分析法,其檢測結果依賴于抗Rac1抗體,而本研究采用的是不依賴于抗Rac1抗體的實時熒光定量聚合酶鏈法,因此能夠準確反映腦膠質瘤組織中Rac1 mRNA表達情況。Rac1 mRNA預測復發的AUC與P4HA1 mRNA相近,但Rac1 mRNA的敏感度為83.33%,在單一指標中最高,呈現出獨特的應用優勢。同時Pax3 mRNA、P4HA1 mRNA聯合Rac1 mRNA預測復發的AUC大于任一單一指標,預測可靠性與預測敏感度進一步提升,故建議聯合檢測三者作為術后復發的一個預測方案。
在以上研究基礎上,本研究還發現,Pax3 mRNA、P4HA1 mRNA、Rac1 mRNA高水平患者復發時間短于低水平患者,提示三者的高表達不僅與復發有關,還與患者術后復發時間有關,Pax3 mRNA、P4HA1 mRNA、Rac1 mRNA水平越高,患者術后早期復發的危險度越高。郭合伏等[20]報道,顱內膠質瘤組織高表達的Rac1 mRNA與患者生存期呈負相關,佐證了Rac1 mRNA參與腦膠質瘤的進展。從本研究結果可知,檢測患者腦膠質瘤組織標本中Pax3 mRNA、P4HA1 mRNA、Rac1 mRNA表達有助于早期預測患者復發的風險,并初步評估患者復發時間,對Pax3 mRNA、P4HA1 mRNA、Rac1 mRNA高表達患者,應建議患者盡可能完善術后放療、化療,并及時調整放化療方案,而最大化患者受益。
綜上,腦膠質瘤組織中Pax3 mRNA、P4HA1 mRNA、Rac1 mRNA表達與全切術后復發及復發時間相關,單一指標中Pax3 mRNA預測特異度最高,Rac1 mRNA預測敏感度最高,三者聯合預測復發的可靠性與敏感度進一步提高,能為臨床早期精準干預提供重要的參考依據。

