花生油脂合成相關(guān)酰基轉(zhuǎn)移酶基因的研究進(jìn)展
沈悅 沈一 劉永惠 梁滿 張旭堯 陳志德
摘要:花生是重要的油料作物和經(jīng)濟(jì)作物,我國(guó)花生年產(chǎn)量居世界第一,居國(guó)內(nèi)油料作物首位,其總產(chǎn)的50%以上均用于榨油。囿于國(guó)內(nèi)糧油爭(zhēng)地矛盾和不斷增長(zhǎng)的油脂消費(fèi)需求等因素,提高油料作物含油量對(duì)保障我國(guó)食用油脂安全具有重要的戰(zhàn)略意義。花生種子油脂的主要成分為三酰甘油(TAG),其合成受到多個(gè)限速酶基因的協(xié)同調(diào)控,這些基因的時(shí)空表達(dá)特性、脂肪酸底物選擇性和非生物脅迫響應(yīng)等機(jī)制與油脂積累密切相關(guān),最終影響油籽的產(chǎn)量和品質(zhì)形成。植物油脂合成是涉及多個(gè)亞細(xì)胞區(qū)室、多條合成途徑調(diào)控的復(fù)雜代謝網(wǎng)絡(luò),本文在總結(jié)植物油脂區(qū)室化合成步驟的基礎(chǔ)上,對(duì)花生油脂的功能特性以及花生油脂合成途徑中相關(guān)關(guān)鍵酰基轉(zhuǎn)移酶的作用機(jī)制和研究現(xiàn)狀進(jìn)行歸納闡述,并提出存在的問(wèn)題和建議,為花生油脂性狀的精準(zhǔn)鑒定和遺傳育種提供參考。
關(guān)鍵詞:花生;油脂合成途徑;三酰甘油;酰基轉(zhuǎn)移酶
中圖分類號(hào):S565.201 文獻(xiàn)標(biāo)志碼:A
文章編號(hào):1002-1302(2023)05-0065-06
花生(Arachis hypogaea L.)別稱落花生,豆科植物,異源四倍體(AABB,2n=4x=40),為近緣二倍體野生種蔓花生(Arachis duranensis)和Arachis ipaensis單一雜交后經(jīng)染色體自然加倍馴化而來(lái)[1]。花生是我國(guó)主要的油料作物和經(jīng)濟(jì)作物之一,其種植面積長(zhǎng)期居于國(guó)內(nèi)油料作物第二、總產(chǎn)第一水平,在保障我國(guó)食用油脂安全方面具有重要的戰(zhàn)略地位[2]。花生籽仁富含超過(guò)50%的粗脂肪,不飽和脂肪酸含量占比80%以上,是優(yōu)質(zhì)食用植物油的重要原料[3-4]。近年我國(guó)國(guó)產(chǎn)食用植物油自給率僅在1/3左右[5],而花生進(jìn)出口貿(mào)易自2019年開始呈凈進(jìn)口態(tài)勢(shì)[6],其國(guó)際市場(chǎng)競(jìng)爭(zhēng)力已然面臨巨大挑戰(zhàn)。因此,囿于國(guó)內(nèi)糧油爭(zhēng)地和農(nóng)業(yè)供給側(cè)結(jié)構(gòu)現(xiàn)狀,以市場(chǎng)需求為驅(qū)動(dòng)力,如何提高花生油脂含量和品質(zhì),高效、定向培育耐儲(chǔ)存油用型的花生新品種成為當(dāng)前花生育種的重要目標(biāo)之一。
植物油脂屬于甘油脂類中性貯藏脂,通常以三酰甘油(triacylglycerol,TAG)的形式廣泛存在于種子、花粉和一些肉質(zhì)果(如油棕櫚、橄欖等)組織中,常見用于食品、飼料和工業(yè)等。植物中存在多條油脂合成獨(dú)立途徑,其中包括簡(jiǎn)單的依賴酰基輔酶A的Kennedy途徑(從頭合成DAG/TAG)和復(fù)雜的不依賴酰基輔酶A的PC途徑(PC衍生的DAG/TAG),這2條途徑的選擇偏好及TAG合成相對(duì)通量存在一定的種間差異和組織特異性[7-9]。因此,闡明植物油脂生物合成途徑及其關(guān)鍵酶基因的遺傳學(xué)研究進(jìn)展,對(duì)花生油脂性狀的功能鑒定和育種利用具有重要意義。
1 植物油脂生物合成途徑
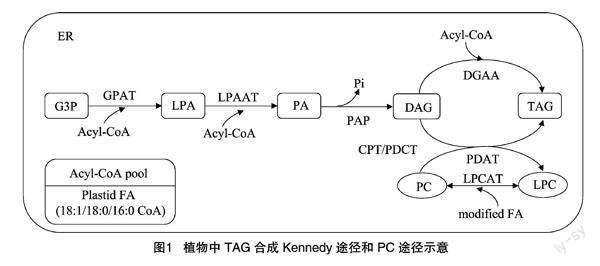
植物油脂合成是一個(gè)涉及多個(gè)亞細(xì)胞區(qū)室、多條合成途徑協(xié)同完成的生化反應(yīng)代謝網(wǎng)絡(luò),通常分為3個(gè)階段:首先,在質(zhì)體中進(jìn)行脂肪酸的從頭合成、去飽和,并被外運(yùn)到細(xì)胞質(zhì);其次,在內(nèi)質(zhì)網(wǎng)中進(jìn)行脂肪酸修飾,然后通過(guò)Kennedy途徑(或PC途徑)組裝TAG(圖1);最后TAG在油體(或脂滴)中穩(wěn)定儲(chǔ)存。基于植物油脂代謝網(wǎng)絡(luò)的復(fù)雜性,質(zhì)體輸出脂肪酸的相對(duì)通量、脂肪酸鏈的延長(zhǎng)、酰基編輯、脂肪酸修飾以及TAG組裝酶的有效通量等都會(huì)影響組織TAG積累及其脂肪酸組成多樣性[10]。
1.1 脂肪酸從頭合成途徑
脂肪酸(fatty acid,F(xiàn)A)從頭合成以糖酵解途徑產(chǎn)生的丙酮酸為前體,經(jīng)丙酮酸脫氫酶(pyruvatedehydrogenase,PDH)和乙酰輔酶A羧化酶(acetyl-CoA carboxylase,ACCase)脫氫、羧化,生成的丙二酰輔酶A在脂肪酸合酶(fatty acid synthase,F(xiàn)AS)催化下在酰基載體蛋白(acyl carrier protein,ACP)上進(jìn)行酰基鏈的組裝,每循環(huán)延長(zhǎng)2個(gè)碳鏈,經(jīng)7個(gè)循環(huán)反應(yīng)生成飽和的16:0-ACP,隨后被酮酰-ACP合成酶Ⅱ(ketoacyl-ACP synthase,KAS)延長(zhǎng)C16酰基鏈生成飽和18:0-ACP,再被硬脂酰-ACP脫飽和酶(stearoyl-ACP desaturase,SAD)去飽和生成18:1-ACP。2種脂肪酸硫酯酶(fatty acid thioesterase,F(xiàn)ATA/FATB)分別水解上述不飽和/飽和中間產(chǎn)物,釋放游離FAs(18:1Δ9>[KG-*2]>16:0>18:0)[9,11-12]。
3種游離FAs被長(zhǎng)鏈酰基輔酶A合成酶(long-chain acyl-CoA synthetase,LACS)轉(zhuǎn)化為酰基輔酶A(acyl-coenzyme A,Acyl-CoA),并被脂肪酸外運(yùn)蛋白(fatty acid export,F(xiàn)AX)輸出質(zhì)體,生成Acyl-CoA庫(kù)(18:1-CoA、18:0-CoA和16:0-CoA)用于下游脂肪酸鏈延長(zhǎng)、修飾和TAG組裝等過(guò)程[13-14]。不難看出,脂肪酸合成存在多個(gè)限速步驟,該途徑?jīng)Q定了碳鏈的長(zhǎng)度(最多18個(gè))以及植物油中飽和脂肪酸的水平。
1.2 Kennedy途徑(DAG/TAG從頭合成)
以甘油-3-磷酸(glycerol-3-phosphate,G3P)為酰基受體、Acyl-CoA為酰基供體,經(jīng)酰基輔酶A:甘油-3-磷酸酰基轉(zhuǎn)移酶(acyl-CoA:glycerol-3-phosphate acyltransferase,GPAT)和酰基輔酶A:溶血磷脂酸酰基轉(zhuǎn)移酶(acyl-CoA:lysophosphatidic acid acyltransferase,LPAAT)在G3P的sn-1和sn-2位進(jìn)行2次順序酰化生成磷脂酸(phosphatidic acid,PA),PA經(jīng)磷脂酸磷酸酶(phosphatidic acid phosphatase,PAP)水解去除磷酸鹽,生成的二酰甘油(diacylglycerol,DAG)經(jīng)酰基輔酶A:二酰甘油酰基轉(zhuǎn)移酶(acyl-CoA:diacylglycerol acyltransferase,DGAT)在底物DAG的sn-3位進(jìn)行第3次酰化生成TAG[8,11],這種G3P與Acyl-CoA經(jīng)3次順序酰化生成從頭DAG/TAG的過(guò)程被稱為Kennedy途徑。除了直接利用質(zhì)體輸出的Acyl-CoA,從頭合成DAG/TAG合成途徑還可以利用細(xì)胞質(zhì)和內(nèi)質(zhì)網(wǎng)中延長(zhǎng)到≥20個(gè)碳的Acyl-CoA。
1.3 PC途徑(PC衍生的DAG/TAG合成)
磷脂酰膽堿(phosphatidylcholine,PC)既是用于FA修飾的位點(diǎn),也是用于TAG合成的新DAG底物的中間體,表明PC衍生的DAG/TAG途徑是增加TAG中不飽和或獨(dú)特(unusual)脂肪酸的一種重要方式。PC從頭合成需要產(chǎn)生2次DAG:首先從頭合成DAG,隨后轉(zhuǎn)化為PC,最后釋放新的DAG。這一過(guò)程中從頭DAG被導(dǎo)入PC后先進(jìn)行FA修飾,再?gòu)腜C釋放含有修飾FA的DAG,因此,不難發(fā)現(xiàn)從頭合成的DAG和PC衍生的DAG之間是明顯不同的分子類型。共存在3種酶促途徑合成PC衍生的DAG:(1)利用CDP-膽堿:二酰甘油膽堿磷酸轉(zhuǎn)移酶(CDP-choline:DAG cholinephosphotransferase,CPT)反向介導(dǎo)PC和DAG相互轉(zhuǎn)化[12];(2)利用磷脂酰膽堿:二酰甘油膽堿磷酸轉(zhuǎn)移酶(phosphatidylcholine:diacylglycerol cholinephosphotransferase,PDCT)介導(dǎo)PC和DAG相互轉(zhuǎn)化[15];(3)基于脂肪酶介導(dǎo)的途徑,如磷脂酶C(phospholipase C,PLC)或PLD/PAP催化水解PC生成DAG[16]。
1.4 酰基編輯
酰基編輯是一個(gè)去酰化-再酰化循環(huán)反應(yīng),該循環(huán)始于PC釋放酰基,通過(guò)酰基輔酶A:溶血磷脂酰膽堿酰基轉(zhuǎn)移酶(acyl-CoA:lyso-phosphatidylcholine acyltransferase,LPCAT)的反向反應(yīng)生成溶血磷脂酰膽堿(lyso-PC/LPC),LPCAT再重新酯化LPC生成PC完成循環(huán)[17]。酰基編輯本身不影響PC和TAG凈積累,它允許PC和Acyl-CoA庫(kù)之間完成快速的酰基交換,可以源源不斷地為從頭合成DAG/TAG提供PC修飾的新生FAs。
2 花生油脂功能特性
花生油脂具有特異的脂肪酸組成,主要包括棕櫚酸(C16:0)、硬脂酸(C18:0)、油酸(C18:1)、亞油酸(C18:2)、亞麻酸(C18:3)、花生酸(C20:0)、花生烯酸(C20:1)、山崳酸(C22:0)、二十四碳烷酸(C24:0)等長(zhǎng)鏈脂肪酸,其中油酸相對(duì)含量最高(34%~68%),亞油酸次之(19%~43%),總不飽和脂肪酸含量超過(guò)80%。油酸具有較好的熱穩(wěn)定性和抗氧化性,提高油酸含量利于促進(jìn)花生油脂及相關(guān)加工產(chǎn)品的耐儲(chǔ)藏性。在對(duì)人體血管穩(wěn)態(tài)保健方面,油酸可以靶向降低低密度脂蛋白膽固醇,亞油酸作為人體必需脂肪酸,也能夠降低人體總膽固醇、預(yù)防高血壓和動(dòng)脈粥樣硬化,但因其不飽和程度較高極易氧化酸敗[18]。含油率和油亞比是評(píng)估花生油脂供給能力和品質(zhì)價(jià)值的重要指標(biāo)。有關(guān)研究表明,花生含油量每提高1%,相當(dāng)于產(chǎn)量提高2%,油脂加工利潤(rùn)相應(yīng)提高7%[19-20];油酸、亞油酸含量遺傳主要受加性效應(yīng)控制,并且兩者之間存在顯著負(fù)相關(guān)[21];另外,花生含油量與油酸、亞油酸含量之間不存在顯著相關(guān)性[22-23],這些結(jié)論有效支撐了當(dāng)前育種工作者對(duì)于專用型花生品種(如高油兼高油酸)定向培育的可行性。
3 三酰甘油合成相關(guān)酰基轉(zhuǎn)移酶研究進(jìn)展
3.1 甘油-3-磷酸酰基轉(zhuǎn)移酶(GPAT)
GPAT主要催化Acyl-CoA上的酰基向G3P羥基位轉(zhuǎn)移,生成溶血磷脂酸(lyso-phosphatidic acid,LPA)。G3P作為合成TAG的碳鏈骨架,存在3個(gè)脂肪酸結(jié)合位點(diǎn)sn-1、sn-2和sn-3。迄今發(fā)現(xiàn)10個(gè)擬南芥GPAT同系物,其中GPAT1-8為陸生植物特有的sn-2-GPAT,主要參與角質(zhì)、軟木脂等極性甘油脂合成,暫無(wú)證據(jù)表明與油脂合成相關(guān)[24-25];GPAT9與動(dòng)物脂肪合成基因GPAT3/4高度同源,作為內(nèi)質(zhì)網(wǎng)定位的sn-1位雙功能酶基因直接參與植物膜脂和TAG的生物合成[26]。此外,質(zhì)體定位的ATS1可利用acyl-ACP為酰基供體催化G3P的sn-1位脂酰化,可能與植物耐寒應(yīng)答機(jī)制相關(guān)[27-28]。花生組織qRT-PCR時(shí)空表達(dá)分析結(jié)果顯示,AhGAPT1、AhGAPT2、AhGAPT6、AhGAPT8和AhATS1主要在葉片和花中的表達(dá)量較高,AhGAPT3和AhGPAT5主要在花生種子發(fā)育初期下胚軸中表達(dá)量較高,AhGPAT9主要在莖、花和種子中表達(dá)并且種子表達(dá)量與種子油脂積累速率呈正相關(guān),這些基因均可能參與(或部分參與)了植物對(duì)低溫、高鹽、脫落酸(ABA)等的非生物脅迫應(yīng)答[29-31]。比較發(fā)現(xiàn),AtGPAT9和AhGPAT9具有高度的序列相似性,過(guò)表達(dá)AtGPAT9導(dǎo)致擬南芥種子質(zhì)量、面積和含油量均上調(diào),并且atgpat9突變體呈雌雄配子體純合致死表型;過(guò)表達(dá)AhGPAT9也導(dǎo)致轉(zhuǎn)基因花生種子含油量顯著增加,沉默表達(dá)株系中表現(xiàn)為降低,不難看出AhGPAT9在植物油脂合成中與AtGPAT9一樣具有相似的功能。此外,AhGPAT9等位基因多態(tài)性高油位點(diǎn)雜交組合也為花生高油育種提供了新思路[31-32]。
3.2 溶血磷脂酸酰基轉(zhuǎn)移酶(LPAAT)
LPAAT(或LPAT)負(fù)責(zé)催化LPA和Acyl-CoA酯化生成磷脂酸(PA)。PA是膜脂、信號(hào)和貯存脂類生物合成的關(guān)鍵中間體,LPAAT通過(guò)調(diào)控LPA在不同組織中轉(zhuǎn)化為不同PA來(lái)調(diào)控生物體細(xì)胞功能。根據(jù)系統(tǒng)發(fā)育和底物選擇性分為4個(gè)亞組,包括LPAAT1、LPAAT2/3(A-class LPAAT)、LPAATB(B-class LPAAT)和LPAAT4/5。目前報(bào)道了5個(gè)擬南芥LPAAT同系物,質(zhì)體定位的AtLPAAT1能夠在各組織中廣泛表達(dá),該基因?qū)︴;孜锏倪x擇性更傾向于16:0-CoA,功能缺失突變體中質(zhì)體PA合成被阻斷,導(dǎo)致純合突變株種子的胚胎在心形—魚雷階段停止發(fā)育而死亡[33-34]。LPAAT2/3亞組對(duì)酰基底物的選擇性更傾向于18:1-CoA,內(nèi)質(zhì)網(wǎng)定位的AtLPAT2也能夠在各組織中廣泛表達(dá),突變后導(dǎo)致雌配子體敗育;AtLPAT3主要在花粉中表達(dá)且活性高于AtLPAT2,兩者存在一定的功能冗余[35]。LPAATB亞組在底物選擇性上傾向于中鏈脂肪酰基(12:0~16:0-CoA),擬南芥中暫無(wú)相關(guān)報(bào)道。LPAAT4/5亞組進(jìn)化上與動(dòng)物AGPAT8接近,AtLPAT4和AtLPAT5能在擬南芥各組織中廣泛表達(dá)但豐度較低[35],并且這2個(gè)基因存在不同的轉(zhuǎn)錄本(TAIR),功能未知,表明植物PA合成的復(fù)雜程度遠(yuǎn)超出目前的認(rèn)知。
花生組織qRT-PCR時(shí)空表達(dá)分析結(jié)果顯示,AhLPAAT2主要在花生種子中高豐度表達(dá),AhLPAAT4、AhLPAAT5、AhLPAAT6等3個(gè)基因在花中的轉(zhuǎn)錄豐度高于其他組織,4個(gè)基因的轉(zhuǎn)錄水平受非生物脅迫(低溫、鹽、干旱和ABA)差異誘導(dǎo)[36]。AhLPAT2定位于內(nèi)質(zhì)網(wǎng),其種子表達(dá)量與籽仁油脂積累速率變化一致,高油品種的AhLPAT2種子表達(dá)量始終高于低油品種;擬南芥中過(guò)表達(dá)AhLPAT2能夠促進(jìn)組織內(nèi)脂肪酸從頭合成、TAG組裝、蔗糖代謝和糖酵解途徑相關(guān)幾個(gè)關(guān)鍵基因的誘導(dǎo)表達(dá),導(dǎo)致轉(zhuǎn)基因株系種子的含油量、粒質(zhì)量均顯著增加[37-38]。AhLPAT4定位于細(xì)胞質(zhì),該基因在花生種子的不同發(fā)育階段的表達(dá)量與油脂積累速率不一致[39]。不難看出,花生AhLPAATs家族成員在組織和亞細(xì)胞中的表達(dá)存在明顯的時(shí)空差異性,意味著其參與了體內(nèi)多種脂代謝功能,它們對(duì)油脂合成及其組分多樣性的貢獻(xiàn)有待進(jìn)一步研究。
3.3 二酰甘油酰基轉(zhuǎn)移酶(DGAT)
DGAT是催化Acyl-CoA依賴的TAG從頭合成途徑的最后一步限速酶,系統(tǒng)發(fā)育進(jìn)化分析劃為4類:DGAT1、DGAT2、可溶性DGAT以及細(xì)菌WS/DGAT,其中DGAT1和DGAT2在真核生物中廣泛存在。目前,AtDGAT1是唯一被證實(shí)與擬南芥種子TAG合成和積累直接相關(guān)的,該基因功能缺失后能導(dǎo)致種子含油量減少20%~40%,某種程度上也表明TAG合成存在其他途徑的補(bǔ)償機(jī)制;同時(shí),AtDGAT1還能介導(dǎo)植物對(duì)低溫脅迫的應(yīng)答[40-42]。擬南芥中AtDGAT2可能不編碼功能性酶,因?yàn)橥蛔凅w遺傳研究發(fā)現(xiàn)該基因與AtDGAT1不存在功能上的互補(bǔ)或冗余關(guān)系[41]。盡管如此,人們還是發(fā)現(xiàn)了一些產(chǎn)生富含獨(dú)特FAs的含油植物DGAT2,如蓖麻、油桐和鐵皮草,它們分別產(chǎn)生富含蓖麻油酸(12-OH 18:1 cisΔ9)、油麻酸(18:3 cisΔ9、transΔ11、transΔ13)和白醋酸(12-環(huán)氧、cisΔ9十八碳烯酸)的TAG[43];此外,油棕EgDGAT2和椰子CoDGAT2具有對(duì)棕櫚酸(C16:1)和油酸(C18:1)的底物偏好,它們的過(guò)表達(dá)擬南芥種子中脂肪酸含量均發(fā)生了顯著差異變化[44-45]。這些研究結(jié)果均有力支撐了DGAT2在植物TAG生物合成中對(duì)獨(dú)特FAs的選擇偏好與TAG積累的積極貢獻(xiàn)。
花生AhDGAT1存在多個(gè)剪接變體,它們表現(xiàn)出不同的組織特異性表達(dá)模式,其中AhDGAT1.1過(guò)表達(dá)擬南芥種子的脂肪酸含量顯著提高[46]。AhGPAT2能夠在花生組織中廣泛表達(dá),葉片和花中相對(duì)較高,酵母功能互補(bǔ)和煙草異源過(guò)表達(dá)結(jié)果均證明了該基因能夠改變或提高FAs含量,同時(shí)也改變了各種內(nèi)源脂代謝基因的轉(zhuǎn)錄水平[47]。人們?cè)诨ㄉ羞€鑒定得到一個(gè)僅在未成熟種子(子葉)特異表達(dá)的AhDGAT3,該基因與DGAT1和DGAT2均不同源,屬于可溶性DGAT酶,能夠促進(jìn)重組大腸桿菌中TAG的積累,并且優(yōu)先選擇18:1-CoA為酰基供體[48-49]。與其他已知植物相比,花生AhDGATs家族進(jìn)化出了獨(dú)特的功能特性,對(duì)這些家族成員的遺傳多樣性、底物選擇性以及生理活性等進(jìn)行深入研究,可能有助于篩選高油兼具優(yōu)異脂肪酸配比的油脂性狀。
3.4 磷脂:二酰甘油酰基轉(zhuǎn)移酶(PDAT)
不依賴Acyl-CoA的TAG合成是以DAG為酰基受體、磷脂為酰基供體進(jìn)行的,該途徑利用磷脂:二酰甘油酰基轉(zhuǎn)移酶(phospholipid:diacylglycerol acyltransferase,PDAT)催化酰基從PC的sn-2位轉(zhuǎn)移到DAG的sn-3位生成TAG[50]。擬南芥中已鑒定出6個(gè)PDAT同系物,其中PDAT1在植物中占大部分PDAT活性。PDAT1可能不是擬南芥TAG合成和積累的直接貢獻(xiàn)因素,研究發(fā)現(xiàn)單一過(guò)表達(dá)或敲除AtPDAT1均沒(méi)有觀察到種子TAG和FA含量發(fā)生明顯變化[51-52];另外,AtPDAT1可能與花粉發(fā)育相關(guān),atdgat1-1/atpdat1-2基因型雙突變能導(dǎo)致不育花粉內(nèi)缺乏可見油體,種子含油量減少70%~80%,這就表明AtPDAT1和AtDGAT1對(duì)花粉活力和種子發(fā)育存在功能重疊,并且在TAG合成中PDAT途徑和DGAT途徑可能具有協(xié)同作用[41]。
不同植物的PDAT表達(dá)方式差異明顯,活性研究表明,該酶可能在多不飽和或獨(dú)特FAs的積累中發(fā)揮重要作用[50]。向日葵HaPDATs主要在種子發(fā)育后期表達(dá),其中HaPDAT1c能夠恢復(fù)酵母突變體H1246細(xì)胞TAG的生物合成能力[53]。油菜BnPDAT1基因表達(dá)和種子TAG含量變化沒(méi)有明顯的直接關(guān)系,但高含油品系中的表達(dá)豐度顯著高于低含油品系[54]。花生全基因組生物信息學(xué)分析研究顯示,AhPDATs家族包含17個(gè)成員,系統(tǒng)進(jìn)化上分為5個(gè)亞組,這些基因的組織時(shí)空表達(dá)模式差異明顯,并且存在豐富的可變剪接基因型[55]。目前已分離獲得AhPDAT1和AhPDAT2,熒光定量結(jié)果顯示AhPDAT1在花生種子中表達(dá)量最高,AhPDAT2在花生下胚軸中表達(dá)量最高,2個(gè)基因分別在果針入土后60 d和36 d的表達(dá)量遠(yuǎn)高于其余各時(shí)期,此外基因表達(dá)受干旱、高鹽、低溫等9類非生物脅迫誘導(dǎo),暗示了AhPDATs對(duì)花生油脂合成和抗逆的正面調(diào)控作用[56]。
4 展望
大量遺傳分析研究表明,花生油脂合成是受多基因控制的數(shù)量性狀遺傳,單一改變某個(gè)基因的表達(dá)水平很難精準(zhǔn)調(diào)控最終的油脂含量及其組分。隨著不同物種脂代謝的深入研究,人們對(duì)花生油脂合成中區(qū)室化途徑的相對(duì)貢獻(xiàn)以及關(guān)鍵限速酶基因的鑒定也有了積極的進(jìn)展,但是主要集中在相關(guān)基因家族的克隆、表達(dá)和生物學(xué)功能初探,TAG合成網(wǎng)絡(luò)的多基因調(diào)控關(guān)系依然不明確。另外,單一的Kennedy途徑對(duì)花生TAG合成的貢獻(xiàn)率如何,PC在多大程度上參與了超長(zhǎng)鏈飽和脂肪酸或其他未在內(nèi)質(zhì)網(wǎng)中修飾的脂肪酸的酰基轉(zhuǎn)移,以及TAG合成中每一步酯化反應(yīng)對(duì)酰基通量的需求等,這些問(wèn)題的解決有助于更全面地了解花生油脂合成及其脂肪酸組成的機(jī)制。囿于技術(shù)限制和安全風(fēng)險(xiǎn),目前通過(guò)基因工程手段來(lái)改良花生優(yōu)異性狀還無(wú)法大規(guī)模實(shí)現(xiàn)。盡管如此,隨著人們對(duì)花生油脂代謝不斷深入了解,對(duì)于今后花生油脂性狀的精準(zhǔn)鑒定和創(chuàng)新利用具有重要意義。
參考文獻(xiàn):
[1]Seijo J G,Lavia G I,F(xiàn)ernández A,et al. Physical mapping of the 5S and 18S-25S rRNA genes by FISH as evidence that Arachis duranensis and A. ipaensis are the wild diploid progenitors of A. hypogaea (Leguminosae)[J]. American Journal of Botany,2004,91(9):1294-1303.
[2]廖伯壽,殷 艷,馬 霓. 中國(guó)油料作物產(chǎn)業(yè)發(fā)展回顧與展望[J]. 農(nóng)學(xué)學(xué)報(bào),2018,8(1):107-112.
[3]Janila P,Nigam S N,Pandey M K,et al. Groundnut improvement:use of genetic and genomic tools[J]. Frontiers in Plant Science,2013,4:23.
[4]Jung S,Swift D,Sengoku E,et al. The high oleate trait in the cultivated peanut (Arachis hypogaea L.). Ⅰ. Isolation and characterization of two genes encoding microsomal oleoyl-PC desaturases[J]. Molecular & General Genetics,2000,263(5):796-805.
[5]趙春江,李 瑾,馮 獻(xiàn). 面向2035年智慧農(nóng)業(yè)發(fā)展戰(zhàn)略研究[J]. 中國(guó)工程科學(xué),2021,23(4):1-9.
[6]Food and Agriculture Organization of the United Nations. FAOSTAT Database:2019—2020[EB/OL]. [2022-11-20]. https://www.fao.org/faostat.
[7]Bates P D,Browse J. The significance of different diacylgycerol synthesis pathways on plant oil composition and bioengineering[J]. Frontiers in Plant Science,2012,3:147.
[8]Bates P D,Stymne S,Ohlrogge J. Biochemical pathways in seed oil synthesis[J]. Current Opinion in Plant Biology,2013,16(3):358-364.
[9]Xu C C,Shanklin J. Triacylglycerol metabolism,function,and accumulation in plant vegetative tissues[J]. Annual Review of Plant Biology,2016,67(1):179-206.
[10]Bates P D. Understanding the control of acyl flux through the lipid metabolic network of plant oil biosynthesis[J]. Molecular and Cell Biology of Lipids,2016,1861(9):1214-1225.
[11]Chapman K D,Ohlrogge J B. Compartmentation of triacylglycerol accumulation in plants[J]. The Journal of Biological Chemistry,2012,287(4):2288-2294.
[12]Li-Beisson Y,Shorrosh B,Beisson F,et al. Acyl-lipid metabolism[J]. The Arabidopsis Book,2013,11:e0161.
[13]Chen G Q,Woodfield H K,Pan X,et al. Acyl-trafficking during plant oil accumulation[J]. Lipids,2015,50(11):1057-1068.
[14]Li N N,Gügel I L,Giavalisco P,et al. FAX1,a novel membrane protein mediating plastid fatty acid export[J]. PLoS Biology,2015,13(2):e1002053.
[15]Lu C F,Xin Z G,Ren Z H,et al. An enzyme regulating triacylglycerol composition is encoded by the ROD1 gene of Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(44):18837-18842.
[16]Lee J,Welti R,Schapaugh W T,et al. Phospholipid and triacylglycerol profiles modified by PLD suppression in soybean seed[J]. Plant Biotechnology Journal,2011,9(3):359-372.
[17]Stymne S,Stobart A K. Evidence for the reversibility of the acyl-CoA:lysophosphatidylcholine acyltransferase in microsomal preparations from developing safflower (Carthamus tinctorius L.) cotyledons and ratliver[J]. Biochemical Journal,1984,223(2):305-314.
[18]禹山林. 中國(guó)花生遺傳育種學(xué)[M]. 上海:上海科學(xué)技術(shù)出版社,2011:29-33.
[19]廖伯壽. 中國(guó)花生油脂產(chǎn)業(yè)競(jìng)爭(zhēng)力淺析[J]. 花生學(xué)報(bào),2003,32(增刊1):11-15.
[20]姜慧芳,任小平,王圣玉,等. 野生花生高油基因資源的發(fā)掘與鑒定[J]. 中國(guó)油料作物學(xué)報(bào),2010,32(1):30-34.
[21]萬(wàn)勇善,譚 忠,范 暉,等. 花生脂肪酸組分的遺傳效應(yīng)研究[J]. 中國(guó)油料作物學(xué)報(bào),2002,24(1):27-29.
[22]姜慧芳,段乃雄. 花生油脂品質(zhì)及含油量、油酸和亞油酸含量間的相關(guān)分析[J]. 花生科技,1993(2):5-6.
[23]Nepote V,Olmedo R H,Mestrallet M G,et al. A study of the relationships among consumer acceptance,oxidation chemical indicators,and sensory attributes in high-oleic and normal peanuts[J]. Journal of Food Science,2009,74(1):1-8.
[24]Chen X,Snyder C L,Truksa M,et al. sn-Glycerol-3-phosphate acyltransferases in plants[J]. Plant Signaling & Behavior,2011,6(11):1695-1699.
[25]Yang W L,Simpson J P,Li-Beisson Y,et al. A land-plant-specific glycerol-3-phosphate acyltransferase family in Arabidopsis:substrate specificity,sn-2 preference,and evolution[J]. Plant Physiology,2012,160(2):638-652.[HJ1.7mm]
[26]Singer S D,Chen G Q,Mietkiewska E,et al. Arabidopsis GPAT9 contributes to synthesis of intracellular glycerolipids but not surface lipids[J]. Journal of Experimental Botany,2016,67(15):4627-4638.
[27]Payá-Milans M,Venegas-Calerón M,Salas J J,et al. Cloning,heterologous expression and biochemical characterization of plastidial sn- glycerol-3-phosphate acyltransferase from Helianthus annuus[J]. Phytochemistry,2015,111:27-36.
[28]Sun S K,Yang N N,Chen L J,et al. Characterization of LpGPAT gene in Lilium pensylvanicum and response to cold stress[J]. BioMed Research International,2015,2015:792819.
[29]Chi X,Yang Q,Pan L,et al. Isolation and expression analysis of glycerol-3-phosphate acyltransferase genes from peanuts (Arachis hypogaea L.)[J]. Grasasy Aceites,2015,66(3):e093.
[30]郝翠翠,梁成偉,石 蕾,等. 花生甘油-3-磷酸酰基轉(zhuǎn)移酶(GPAT)基因的克隆及表達(dá)分析[J]. 花生學(xué)報(bào),2018,47(1):1-10.
[31]Lv Y Y,Zhang X R,Luo L,et al. Characterization of glycerol-3-phosphate acyltransferase 9 (AhGPAT9) genes,their allelic polymorphism and association with oil content in peanut (Arachis hypogaea L.)[J]. Scientific Reports,2020,10(1):14648.
[32]Shockey J,Regmi A,Cotton K,et al. Identification of Arabidopsis GPAT9 (At5g60620) as an essential gene involved in triacylglycerol biosynthesis[J]. Plant Physiology,2016,170(1):163-179.
[33]Krbes A P,Kulcheski F R,Margis R,et al. Molecular evolution of the lysophosphatidic acid acyltransferase (LPAAT) gene family[J]. Molecular Phylogenetics and Evolution,2016,96:55-69.
[34]Kim H U,Huang A H C. Plastid lysophosphatidyl acyltransferase is essential for embryo development in Arabidopsis[J]. Plant Physiology,2004,134(3):1206-1216.
[35]Kim H U,Li Y H,Huang A H C. Ubiquitous and endoplasmic reticulum-located lysophosphatidyl acyltransferase,LPAT2,is essential for female but not male gametophyte development in Arabidopsis[J]. The Plant Cell,2005,17(4):1073-1089.
[36]Chi X Y,Dong F,Yang Q L,et al. Expression and characterization of lysophosphatidyl acyltransferase genes from peanut (Arachis hypogaea L.)[J]. Research on Crops,2014,15(1):141-153.
[37]Chen S L,Huang J Q,Lei Y,et al. Cloning and expression analysis of lysophosphatidic acid acyltransferase (LPAT) encoding gene in peanut[J]. Acta Agronomica Sinica,2012,38(2):245-255.
[38]Chen S L,Lei Y,Xu X,et al. The peanut (Arachis hypogaea L.) gene AhLPAT2 increases the lipid content of transgenic Arabidopsis seeds[J]. PLoS One,2017,10(8):e0136170.
[39]Chen S L,Huang J Q,Lei Y,et al. Identification and characterization of a gene encoding a putative lysophosphatidyl acyltransferase from Arachis hypogaea[J]. Journal of Biosciences,2012,37(6):1029-1039.
[40]Jako C,Kumar A,Wei Y,et al. Seed-specific over-expression of an Arabidopsis cDNA encoding a diacylglycerol acyltransferase enhances seed oil content and seed weight[J]. Plant Physiology,2001,126(2):861-874.
[41]Zhang M,F(xiàn)an J L,Taylor D C,et al. DGAT1 and PDAT1 acyltransferases have overlapping functions in Arabidopsis triacylglycerol biosynthesis and are essential for normal pollen and seed development[J]. The Plant cell,2009,21(12):3885-3901.
[42]Tan W J,Yang Y C,Zhou Y,et al. Diacylglycerol acyltransferase and diacylglycerol kinase modulate triacylglycerol and phosphatidic acid production in the plant response to freezing stress[J]. Plant Physiology,2018,177(3):1303-1318.
[43]Liu Q,Siloto R M P,Lehner R,et al. Acyl-CoA:diacylglycerol acyltransferase:molecular biology,biochemistry and biotechnology[J]. Progress in Lipid Research,2012,51(4):350-377.
[44]Jin Y H,Yuan Y J,Gao L C,et al. Characterization and functional analysis of a type 2 diacylglycerol acyltransferase (DGAT2) gene from oil palm (Elaeis guineensis Jacq.) mesocarp in Saccharomyces cerevisiae and transgenic Arabidopsis thaliana[J]. Frontiers in Plant Science,2017,8:1791.
[45]Zheng Y S,Jin Y H,Yuan Y J,et al. Identification and function analysis of a type 2 diacylglycerol acyltransferase (DGAT2) from the endosperm of coconut (Cocos nucifera L.)[J]. Gene,2019,702:75-82.
[46]Zheng L,Shockey J,Guo F,et al. Discovery of a new mechanism for regulation of plant triacylglycerol metabolism:the peanut diacylglycerol acyltransferase-1 gene family transcriptome is highly enriched in alternative splicing variants[J]. Journal of Plant Physiology,2017,219:62-70.
[47]Zheng L,Shockey J,Bian F,et al. Variant amino acid residues alter the enzyme activity of peanut type 2 diacylglycerol acyltransferases[J]. Frontiers in Plant Science,2017,8:1751.
[48]Saha S,Enugutti B,Rajakumari S,et al. Cytosolic triacylglycerol biosynthetic pathway in oilseeds. Molecular cloning and expression of peanut cytosolic diacylglycerol acyltransferase[J]. Plant Physiology,2006,141(4):1533-1543.
[49]Chi X Y,Hu R B,Zhang X W,et al. Cloning and functional analysis of three diacylglycerol acyltransferase genes from peanut (Arachis hypogaea L.)[J]. PLoS One,2017,9(9):e105834.
[50]Dahlqvist A,Stahl U,Lenman M,et al. Phospholipid:diacylglycerol acyltransferase:an enzyme that catalyzes the acyl-CoA-independent formation of triacylglycerol in yeast and plants[J]. Proceedings of the National Academy of Sciences of the United States of America,2000,97(12):6487-6492.
[51]Stahl U,Carlsson A S,Lenman M,et al. Cloning and functional characterization of a phospholipid:diacylglycerol acyltransferase from Arabidopsis[J]. Plant Physiology,2004,135(3):1324-1335.
[52]Mhaske V,Beldjilali K,Ohlrogge J,et al. Isolation and characterization of an Arabidopsis thaliana knockout line for phospholipid:diacylglycerol transacylase gene (At5g13640)[J]. Plant Physiology and Biochemistry,2005,43(4):413-417.
[53]張 程,董帥飛,朱 藝,等. 向日葵PDAT基因家族鑒定及其對(duì)油脂積累和非生物脅迫的響應(yīng)[J]. 植物生理學(xué)報(bào),2022,58(5):844-856.
[54]譚太龍,馮 韜,羅海燕,等. 甘藍(lán)型油菜磷脂二酰甘油酰基轉(zhuǎn)移酶(BnPDAT1)表達(dá)特性研究[J]. 華北農(nóng)學(xué)報(bào),2019,34(1):12-18.
[55]田海瑩,單 雷,李新國(guó),等. 花生PDAT基因家族的全基因組生物信息學(xué)分析[J]. 花生學(xué)報(bào),2018,47(3):1-7.
[56]徐 赫,潘麗娟,陳 娜,等. 磷脂二酰甘油酰基轉(zhuǎn)移酶(PDAT)基因的克隆與表達(dá)分析[J]. 花生學(xué)報(bào),2018,47(4):33-40.
收稿日期:2022-12-20
基金項(xiàng)目:國(guó)家自然科學(xué)基金(編號(hào):31701461);江蘇省農(nóng)業(yè)科技自主創(chuàng)新資金[編號(hào):CX(20)3121];江蘇省種業(yè)振興“揭榜掛帥”項(xiàng)目[編號(hào):JBGS(2021)062];國(guó)家現(xiàn)代農(nóng)業(yè)產(chǎn)業(yè)技術(shù)體系建設(shè)專項(xiàng)(編號(hào):CARS-13)。
作者簡(jiǎn)介:沈 悅(1986—),女,江蘇宜興人,博士,助理研究員,主要從事花生遺傳育種與分子生物學(xué)研究。E-mail:syjaas@163.com。
通信作者:陳志德,博士,研究員,主要從事花生資源與遺傳育種研究。E-mail:chen701865@aliyun.com。

