微生物表面活性素合成調控和高效生產研究進展
劉青, 劉波, 徐欣欣, 張紅兵, 張宇宏*, 張偉
(1.河北經貿大學生物科學與工程學院,石家莊 050061; 2.中國農業科學院生物技術研究所,北京 100081)
表面活性素(surfactin)是一類由芽孢桿菌屬微生物次級代謝產生的脂肽,與傳統化學合成的表面活性劑相比,由菌株生產的表面活性劑因具有可持續獲得、可生物降解、毒性低、對環境兼容性好、在高溫和高鹽等極端環境下結構穩定等優點而備受關注[1-4]。表面活性素可作為食品添加劑及乳化劑用于食品領域[5],亦可替代化學表面活性劑提高石油采油率[6-7],還可開發成生物農藥以防治病蟲害[8]、促進植物生長[9],另外在日化及醫學領域也有廣闊的應用前景[10-12]。但目前來看,微生物表面活性素產量低、生產成本高,嚴重限制了其實際應用范圍[13]。本文主要對發酵工藝優化、新型生產原料開發、定向進化及基因工程理性設計多種策略進行綜述,以期為解決微生物表面活性素產量低等問題提供理論參考。
1 表面活性素的結構及性質
表面活性素是由長鏈β-羥基脂肪酸鏈連接7個氨基酸組成的環肽,肽鏈上第7位氨基酸羧基與脂肪酸鏈的β-羥基形成內酯鍵。環肽包含2個親水氨基酸(谷氨酸、天冬氨酸)和5個疏水氨基酸(亮氨酸、纈氨酸)[2,14]。L-Glu1-L-Leu2-D-Leu3-LVal4-L-Asp5-D-Leu6-L-Leu7是表面活性素典型的氨基酸順序(圖1)。因脂肪酸鏈的長度及肽鏈上氨基酸位置、種類的變化,使表面活性素有眾多同系物及異構體。
表面活性素最早由Arima等[14]在枯草芽孢桿菌中發現,其在低于臨界膠束濃度(critical micelle concentration,CMC)下可將水的表面張力從72.0 mN·m-1降至27.9 mN·m-1,是迄今已報道的表面活性最好的生物表面活性劑之一。表面活性素具有強大的自聚集能力,在極低水平下可由肽環之間的強氫鍵形成膠束團聚體,隨著表面活性素脂肪鏈長度的增加,其表面活性增強,溶液中趨向于形成更大的聚集體[16-17]。
表面活性素的長鏈脂肪酸可滲入細胞膜內部,使磷脂雙分子層形成滲透環境,造成細胞膜的溶解和破壞,可有效作用于革蘭氏陽性菌和陰性菌的細胞膜,具有抗菌活性且不產生耐藥性[18]。表面活性素還能分解病毒脂質包膜,且可通過形成離子通道分解病毒衣殼,從而具有抗病毒能力[19]。表面活性素對細胞膜的破壞是非特異性的,因此還具有溶血效應[20]。
2 表面活性素的來源及合成調控
2.1 表面活性素的來源
表面活性素源自芽孢桿菌屬微生物的次級代謝,目前已知可以產生表面活性素的菌種有枯草芽胞桿菌、解淀粉芽胞桿菌、多粘芽胞桿菌、側孢短芽胞桿菌、巨大芽胞桿菌、短小芽胞桿菌、萎縮芽胞桿菌、蠟質芽抱桿菌、地衣芽孢桿菌和貝萊斯芽孢桿菌等[21-25]。從環境中分離的野生型菌株其表面活性素產量在20~600 mg·L-1[26-28];經各種策略改造后產量顯著提高,突變菌株或優化發酵條件后菌株的表面活性素產量增加至1 000~2 000 mg·L-1[29-30];通過基因工程理性設計的菌株產量增加尤為明顯,如野生型B.subtilisTHY-7菌株經人工嵌合啟動子Pg3替換原始啟動子后,表面活性素產量由550 mg·L-1增加到9.7 g·L-1[27]。
2.2 表面活性素的合成調控
表面活性素的合成途徑主要包括前體物質(脂肪酸和氨基酸)的生物合成及結構組裝[31]。微生物通過初級代謝,如糖酵解、三羧酸循環、磷酸戊糖途徑、蛋白質代謝、脂質代謝等途徑合成相應前體;然后進行結構組裝。表面活性素的組裝過程分為啟動、起始、肽鏈延伸及環化、釋放,由非核糖體肽合成酶系(non-ribosomal peptide synthetase,NRPS)完成,用于合成表面活性素的NRPS是由多模塊組成的多結構域蛋白,包含AA、AB、AC、AD 4個亞基,分別由srfA基因簇上的srfAA、srfAB、srfAC和srfAD編碼,該基因簇總長達27 kb[32]。NRPS催化的表面活性素合成過程如圖2所示。SrfAA和SrfAB蛋白均含有3個功能模塊;SrfAC蛋白僅含有1個功能模塊。每個模塊負責1種氨基酸的識別和縮合[33],且每個模塊至少包括腺苷酰化結構域、肽酰載體蛋白結構域和縮合結構域;模塊3和6中還另含有異構域,如將L-Leu異構為D-Leu[34]。SrfAA負責脂化反應(谷氨酸與脂肪酸)[35]及組裝L-Glu、L-Leu和D-Leu;SrfAB的3個模塊按順序組裝L-Val、L-Asp和D-Leu;SrfAC組裝剩下的L-Leu殘基;SrfAC的末端連接1個Ⅰ型硫酯酶TEI,負責環化和釋放。srfAD編碼II型硫酯酶,執行表面活性素組裝過程的監視和修復功能[36]。sfp基因位于srfA操縱子下游30.5 kb左右,是參與表面活性素合成的另一要素,該基因編碼的SFP酶具有磷酸泛酰巰基乙胺基轉移酶(phosphopantetheinyl transferase,PPTase)功能,可催化非核糖體肽和載鐵蛋白前體的形成,并以此激活表面活性素合成酶,屬PPTase超家族[37]。在sfp基因缺失或有缺陷的情況下,表面活性素將無法合成[31]。
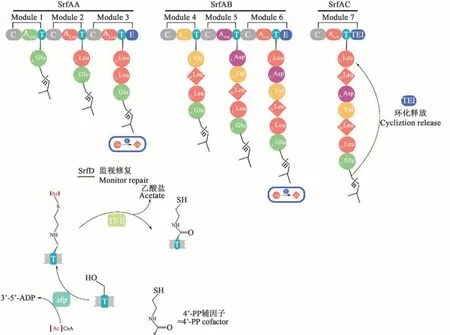
圖2 NRPS 催化的表面活性素合成過程示意圖(根據參考文獻[33]修改)Fig.2 Schematic diagram of surfactin synthesis catalyzed by NRPS(modified on reference[33])
表面活性素的調控是多重級聯反應過程[38],與芽孢桿菌天然感受態形成、芽孢形成、細胞游動性、生物膜形成等生物活性相關[39]。在調控過程中,芽孢桿菌信息素ComX與膜蛋白組氨酸激酶ComP結合,使其自磷酸化后,將磷酸基團轉移給調控蛋白ComA。磷酸化的ComA與基因簇srfA的啟動子結合,激活srfA轉錄。感受態刺激因子(competence and sporulation factor,CSF)也參與調控表面活性素的合成。CSF由phr基因編碼,Phr前體肽在胞外通過寡肽透性酶Opp運至胞內,與Rap蛋白結合,導致其喪失磷酸酶活性,無法對磷酸化ComA進行脫磷酸化,使ComA處于活性狀態,從而有利于srfA轉錄。全局調控因子CodY對srfA轉錄具有負調控作用。CodY與srfA的啟動子結合,占據DNA與正調控蛋白的結合位點導致srfA轉錄受到抑制,敲除codY基因能顯著提高表面活性素的產量[40-41]。
3 表面活性素的應用
在食品領域,表面活性素的抗菌活性能有效控制食品中有害微生物的滋生,可作為生物防腐劑應用于食品防腐保鮮領域[5,42-43]。作為兩親性分子,表面活性素具有乳化、洗滌、發泡、增溶、殺菌、潤濕、滲透、分散、低毒等特性,可有效應用于化妝品,如增溶劑、肥皂、潔面乳等產品[44-46]。表面活性素的抗菌性、抗氧化性及不產生耐藥性使其具有顯著的醫學應用價值,可抑制白色念珠菌,并抑制細菌與感染部位的粘附,在預防真菌感染和皮膚疾病方面具有潛在作用[12,47]。
表面活性素可降低油/水界面張力,改變油藏的潤濕性以及乳化原油,提高原油的流動性,增加原油的采收率[48]。研究發現,Bacillus licheniformisL20生產的表面活性素可將原油采收率提高19.58%,表明生物表面活性劑的潤濕和乳化機制在微生物提高原油采收率工藝中發揮了重要作用[49]。表面活性素驅油已成為一種綠色高效的采油方法,但其在固體表面的吸附問題仍有待解決[50-51]。表面活性素在農業領域也具有廣泛的應用前景,如對黃瓜枯萎病有明顯的防治效果[52];可促進大白菜葉際定殖[53];有利于不結球白菜生長及增強光合作用,并能提高植株對微量元素的吸收,不僅可作為作物的葉面有機營養劑直接施用,還可作為水溶性肥料的增效劑[54]。
4 表面活性素的高效合成策略
目前,微生物表面活性素產量低且價格昂貴,為解決這個問題,主要通過發酵工藝優化、新型生產原料開發、定向進化及基因工程理性設計4種策略提高其產量。
4.1 發酵工藝優化
發酵條件優化可提高菌株的表面活性素產量。目前優化主要集中在發酵方式及發酵培養基組分。研究發現,通過泡沫分離、添加金屬離子[55]、使用厭氧生物反應器[56]、采用分批發酵[29]、優化培養基組分[28,57]、使用兩段進料工藝及優化礦物鹽培養基[58]等均可提高表面活性素的產量。Yi等[29]采用重復分批發酵、低成本泡沫分餾、可重復使用的固定化細胞和高效能的開放式(非無菌)發酵技術,使表面活性素產量達7 887.3 mg。Liu等[28]利用響應面法優化解淀粉芽孢桿菌培養基,使表面活性素產量增加1.52倍。
4.2 新型生產原料的開發
利用廉價的工農業廢棄物作為生產原料,可降低表面活性素的生產成本,同時降低廢棄物處理成本,減少環境污染,實現綠色循環生產。研究表明,以秸稈[59]、大豆莢和甘蔗渣[60]、橄欖磨廢料[61]進行固體發酵,均可生產表面活性素;以合成廢水、生物柴油生產過程中的副產物甘油為原料進行液體發酵,表面活性素產量與以LB為培養基時的產量相差不大[26]。Zhou等[62]研究發現,Bacillus velezensisBS-37在甘油培養基中生長36 h,表面活性素產量達1 000 mg·L-1以上。
4.3 定向進化
在表面活性素的實際生產過程中,開發高效廉價的生物合成過程(發酵工藝優化及新型生產原料開發)對產量增長貢獻有限,通過菌種改造獲得高產表面活性素的菌株更具有實際生產意義,如對菌株進行定向進化、基因工程理性設計等。
定向進化主要包括化學誘變和物理誘變。郭芳芳等[63]通過多種化學試劑(氯化鋰、亞硝基胍、甲基磺酸乙酯和鏈霉素)進行復合誘變,篩選到1株表面活性素產量比出發菌株提高44.56倍的突變體。陸雅琴[57]通過紫外誘變及溴麝香草酚藍(bromothymol blue, BTB)高效篩選體系,成功篩出高產量突變菌株。Zhu等[64]利用常壓室溫等離子體(atmospheric room temperature plasma, ARTP)進行突變,以聚二乙炔(polydiacetylene, PDA)囊泡作為傳感器的高通量篩選方法獲得高產菌株,其生產的表面活性素產量是出發菌株的5.4倍。
4.4 基因工程理性設計
定向進化的工作量大,高通量篩選方法建立較難,存在回復突變及菌種退化等問題。通過基因工程手段對表面活性素的代謝途徑進行理性設計改造是提高表面活性素產量的有效方法。表面活性素產量可提高2~20倍(表1)。主要包含啟動子替換工程、前體物質合成途徑設計、轉錄調控基因改造、分泌途徑改造等。

表1 基因理性設計策略優化后表面活性素的產量Table 1 Surfactant production under different rational design strategies of gene
4.4.1 啟動子替換工程 表面活性素的合成基因簇長達27 kb,利用過表達方式來提高表面活性素的產量難度較大,而啟動子可以決定基因表達水平,因此替換PsrfA成為提高產量的有效手段。替換啟動子主要是選擇天然強誘導型啟動子及人工嵌合誘導啟動子,通常是蔗糖、異丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG)作誘導劑及厭氧型啟動子。Sun等[65]通過同源重組將B.subtilisfmbR的啟動子PsrfA替換成強誘導型啟動子PspaC,使表面活性素產量提高為野生型的10倍;Jiao等[27]通過替換天然強組成型啟動子PgroE及蔗糖誘導型啟動子PsacB和PsacP后,通過人工嵌合誘導啟動子Pg3使菌株表面活性素產量達到9.74 g·L-1。Hoffmann等[70]提出了1種在缺氧條件下自誘導合成表面活性素的新方法,枯草芽孢桿菌在厭氧生長過程中硝酸鹽和亞硝酸鹽還原酶均高水平表達,因此將菌株JABs24原生啟動子PsrfA分別替換為PnarG和PnasD后,可在厭氧條件下誘導合成表面活性素。
通過替換啟動子PsrfA并不都會提高表面活性素產量。研究表明,PgroE替換天然啟動子PsrfA后,菌株并不能合成表面活性素[27];用強組成型啟動子Pveg替換野生型啟動子PsrfA后,有的重組菌株表面活性素產量遠低于原始菌株[71]。
4.4.2 前體物質合成途徑設計 在表面活性素合成過程中,脂肪酸及氨基酸前體的生物合成是第一步,前人對氨基酸及脂肪酸供應改變是否會影響表面活性素產量進行了相關研究。Wang等[31]對4種氨基酸生物合成分支代謝途徑上的核心基因通過CRISPRi進行抑制,L-Glu酰化是表面活性素縮合反應的第一步,抑制與L-Glu代謝相關的基因yrpC、racE、murC后,表面活性素的產量增加尤為顯著,且yrpC和racE共抑制效果最好;此外,抑制與L-Leu和L-Val代謝相關的bkdAA和bkdAB,不僅提高了表面活性素的產量,還增加了C14亞型的比例。
關于對脂肪酸前體供應增加的研究,主要有敲除相關基因消除其競爭途徑及過表達脂肪酸合成途徑相關基因。Hu等[72]通過敲除pps和pks消除其競爭途徑并過表達酰基載體蛋白(acyl carrier protein,ACP)硫酯酶,兩步強化B. subtilis168生產表面活性素的脂肪酸前體供給途徑,使表面活性素產量達4.02 g·L-1。王苗苗等[67]通過過表達β-羥基脂肪酸合成的限速酶yngH基因,以增強乙酰輔酶A羧化酶活性,增加脂肪酸前體供應,使表面活性素產量達13.3 g·L-1;之后在此基礎上分別通過強化脂肪酸生物合成關鍵基因以及該途徑全部基因,并對發酵條件進行優化,使表面活性素產量達34 g·L-1[68]。
4.4.3 轉錄調控基因的改造 表面活性素的合成需要多種調控因子參與,可通過過表達或敲除這些調控因子的基因來提高表面活性素產量。研究表明,過表達與表面活性素合成相關的芽孢桿菌信息素ComX基因和感受態刺激因子CSF基因,其表面活性素產量為野生型的6.4倍[26];OppA可能在表面活性素合成調控中間接發揮作用[73];敲除編碼全局轉錄調控因子基因codY、降解支鏈氨基酸的lpdV基因[40]、產孢基因spoIVB或過表達Leu合成基因leuABCD-K并補加Leu[69]均可提高表面活性素的產量。此外敲除降解支鏈氨基酸的lpdV基因可使C14亞型比例增加2.5倍。B. subtilis3NA因spo0A基因發生無義突變和AbrB的延伸成為非產孢菌株,JABs32菌株是B. subtilis3NA的1種高產表面活性素的變體[58]。Klausmann等[70]在B. subtilis168衍生菌KM1016中構建spo0A基因缺失和AbrB延伸的突變體,在分批補料培養中表面活性素產量達18.27 g·L-1。Wu等[25]采用系統工程方法來高表面活性素產量,刪除與生物膜形成相關的基因和非核糖體肽合成酶/多酮合成酶途徑相關的基因,過表達潛在的自我抵抗相關蛋白(SwrC,AcrB),增強支鏈α-酮酰輔酶A的供應,過表達整個脂肪酸合成酶復合物,增強srfA的轉錄,將前體乙酰輔酶A從細胞生長轉移到表面素的生物合成,最終使表面活性素產量達12.8 g·L-1。
4.4.4 分泌途徑的改造 對表面活性素分泌途徑的改造,可通過強化表達參與其分泌的跨膜蛋白來增加產出,但目前其分泌機制并不清楚。研究表明,表面活性素的自我抗性基因yerP與其分泌有關[74]。Li等[30]利用脂質體和跨膜轉運抑制劑發現,B. subtilisTHY-7中的表面活性素外流主要依賴于質子驅動力(proton motive force,PMF),過表達3種假定的以PMF為能量源的脂肽轉運蛋白YcxA、KrsE和YerP,分別使表面活性素產量增加89%、52%和145%。
5 展望
微生物表面活性素具有多種優勢屬性,在多個領域有巨大的應用潛力。目前微生物表面活性素在實驗室研究階段已取得一定進展,但其大規模產業化仍受限于發酵工藝、生產菌種和生產成本等因素,有待進一步優化。在發酵工藝上,發酵液的泡沫分離及下游的提取純化方面等問題亟待解決。此外,廉價生產原料的開發也是降低生產成本、促進工業化生產的有效方法。生產菌株可從兩方面入手研究。在定向進化方面,可以通過開發高通量篩選方法減少高產菌株篩選的工作量。在基因工程理性設計方面,強啟動子替換已明確可提高表面活性素產量,可繼續探索效果更好的啟動子;或改變氨基酸前體合成途徑對脂肪酸長度產生的影響,進而影響表面活性素的性質;還可研究脂肪酸前體的從頭合成途徑及其參與合成的方式,從而提升表面活性素產量,同時有助于開發表面活性素的新同系物。

