藥師干預住院患者全腸外營養支持效果評價*
司延斌,馬昭朝,趙志剛
(首都醫科大學附屬北京天壇醫院,北京 100070)
腸外營養(PN)是經靜脈(包括外周靜脈及中心靜脈)途徑補充氨基酸、脂肪、碳水化合物、維生素、電解質、微量元素等營養素的營養支持治療方式,主要適用于存在臨床營養風險且胃腸功能不全患者的營養補充。由于PN 涉及藥品種類復雜,患者營養支持治療個體適宜性和混合配制液穩定性要求高,加之臨床對于營養藥品和不同品種配伍及相互作用的認識不足,易出現不合理用藥。目前推薦在靜脈用藥調配中心(PIVAS)潔凈環境下由藥師配制全營養混合液(TNA)。有研究表明,藥師參與TNA 配制及其醫囑干預,可保證PN 用藥的規范性、安全性和有效性,顯著改善營養支持治療的效果和預后[1-2]。我院采用人工自定義規則的智能審方軟件結合藥師人工核查,通過臨床科室責任藥師復核溝通的分工協作模式,將發現的全腸外營養(TPN)用藥問題及潛在用藥隱患及時反饋至臨床科室,保障了患者TNA輸注的安全性和有效性。現報道如下。
1 資料與方法
1.1 一般資料
從醫院信息系統調取我院2021 年8 月至2022 年1 月未經PIVAS 藥師審核干預的TNA 醫囑715 份(涉及患者492 例)為對照組,以2022 年2 月至7 月經PIVAS藥師審核干預的TNA 醫囑882 份(涉及患者608 例)為干預組。兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。詳見表1。
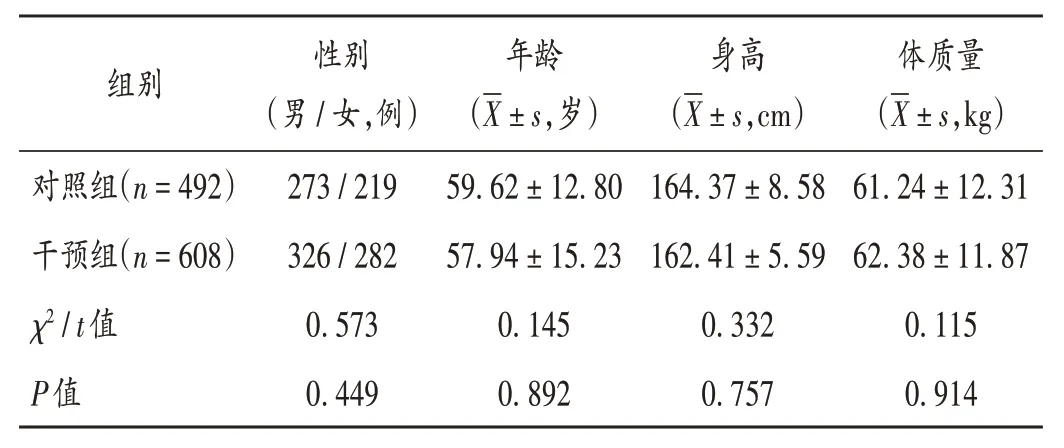
表1 兩組患者一般資料比較Tab.1 Comparison of the patients′ general data between the two groups
1.2 方法
1.2.1 干預標準
參考中華醫學會腸外腸內營養學分會藥學協作組《規范腸外營養液配制》[3]、廣東省藥學會《腸外營養臨床藥學共識(第二版)》[4]等制訂如下干預標準。TNA 葡萄糖終體積分數為3.3%~23.0%;氨基酸終體積分數≥2.5%;糖脂比為(1~2.5)∶1;熱氮比為(80~200)∶1;一價、二價陽離子濃度應分別小于150,10 mmol/L;混合液滲透壓>900 mOsm/L 時選擇中心靜脈置管給藥;魚油脂肪乳、丙氨酰谷氨酰胺等不宜單獨使用等。
1.2.2 涉及常用PN 藥物
包括葡萄糖注射液(5%,10%,50%);復方氨基酸注射液(3AA,9AA,18AA - Ⅱ,18AA - Ⅶ,19AA - I,20AA),丙氨酰谷氨酰胺;脂肪乳注射液(20%、30%,長鏈、中長鏈),結構脂肪乳,多種油脂肪乳,ω-3 魚油脂肪乳;氯化鈉注射液(0.9%,10%),10%氯化鉀注射液、門冬氨酸鉀鎂注射液,葡萄糖酸鈣注射液,硫酸鎂注射液,水溶性維生素注射液,脂溶性維生素注射液,多種微量元素注射液等。
1.2.3 干預方法
通過自定義規則錄入審方系統,以信息化審核與人工審核相結合的方式雙重把關。對于不符合上述干預標準的TNA 醫囑,智能審核系統將其標記為“存疑”醫囑,再經審方藥師或科室責任藥師進行核查復審;并進一步結合患者的臨床診斷、肝腎功能、實驗室檢查指標等分析醫囑的合理性和用藥安全性。將前置審核具有潛在問題的醫囑及時反饋給臨床科室,規范臨床用藥。此外,醫囑審方藥師與臨床科室責任藥師組建干預小組,科室責任藥師就患者個體化問題進行溝通協調,并負責病區合理用藥的宣教。
1.2.4 研究內容
對患者TPN 營養支持方式及TNA 醫囑成分進行合理性干預;分別從營養液組分的液體量及總能量、糖脂比、熱氮比、滲透壓、陽離子濃度等方面,并結合臨床診斷、實驗室檢查指標進行營養液使用的合理性評價;分別從人均TNA 費用、TNA 用藥天數、日均TNA 費用等方面進行經濟學評價。
1.3 統計學處理
采用SPSS 19.0 統計學軟件分析。計量資料符合正態分布時以X±s表示,反之則以M(P25,P75)描述,組間比較采用t檢驗/秩和檢驗;計數資料比較采用Pearson檢驗或校正χ2檢驗,樣本量小的頻數(樣本量<40且理論頻數<1)比較采用Fisher 精準概率法。P<0.05 為差異有統計學意義。
2 結果
2.1 不規范醫囑發生情況
經藥師審核干預后,TNA 不規范醫囑發生率由12.45%(89/715)降至2.49%(22/882)(P< 0.01),詳見表2。
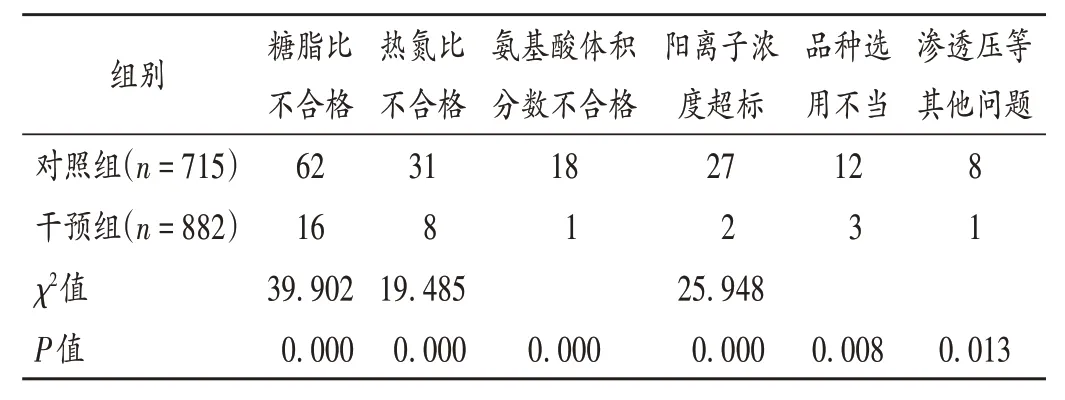
表2 兩組TNA不規范醫囑發生情況比較(份)Tab.2 Comparison of the incidence of irrational TNA medical orders between the two groups(medical order)
2.2 藥師干預TPN 情況
藥師審核干預共協助臨床調整營養支持方式21例次,包括調整為腸內營養(EN)聯合PN 14 例次,全腸內營養4 例次,暫停TPN 醫囑3 例次。藥師干預TPN 支持治療情況見表3。其中,CPT 為Child-Pugh-Turcotte 肝功能分數,INR 為凝血酶原時間國際標準化比值,CCr為肌酐清除率。

表3 藥師干預TPN支持治療情況Tab.3 Pharmacists′ intervention in the TPN support
2.3 TPN 支持治療藥物相關費用
干預組患者日均TNA 費用為(458.62±96.15)元,明顯低于對照組的(572.82 ± 84.23)元(t= 5.682,P< 0.01);干預組患者人均TNA 費用為(3 169.02 ±1 908.36)元,與對照組的(3 572.97±1 863.15)元相當(t=0.941,P>0.05)。
3 討論
3.1 TNA 穩定性的影響因素
臨床實踐表明,對于因胃腸功能缺失不宜進行EN支持治療的患者給予外源性TPN 支持治療,可降低死亡率、提高治愈率,促進康復,縮短住院時間[5]。TNA 預混配置可克服商品化TNA 成分固定,無法個體化進行成分調整的弊端,但為了多成分營養液混配在保證配伍穩定性的情況下發揮最大的營養支持治療效果,應動態調整其總能量、液體量、糖、脂肪、氨基酸、電解質、微量元素等的用量和比值,以保證患者用藥的安全性及有效性。其中,脂肪乳與葡萄糖雙能源能供給和保障機體各臟器所需能量,合理掌握熱氮比,可促進機體蛋白質合成,達到正氮平衡[1,6-7]。一般建議,外周靜脈輸注滲透壓濃度應低于900 mOSm/L,以降低高滲液外周滴注導致機體不適及靜脈炎的發生率[8]。丙氨酰谷氨酰胺注射液為高濃度溶液,不可直接輸入體內,使用時需加入其他氨基酸溶液或含氨基酸的輸液輸注,稀釋比例應至少為1∶5,脂溶性維生素應加入脂肪乳等均為藥師干預時的要點。本研究中,藥師干預后不規范醫囑發生率約下降10%,效果顯著。藥師的干預,既保障了TNA 輸注的安全性與有效性,也體現了藥師在保障TNA合理使用方面不可或缺的專業價值[1,9-10]。
3.2 藥師干預TNA 合理使用的關注點
藥師應關注患者個體化臨床診斷、實驗室檢查指標等因素,關注營養支持是否合理。進行營養支持治療患者應動態評估營養風險及胃腸功能,對于仍存在營養風險但胃腸道功能已部分恢復的患者,應積極考慮切換為符合生理、更經濟的EN 支持治療,或序貫過渡為TPN 聯合EN 方式,減少因工作疏忽導致的TPN 療程的非必要延長。此外,對于伴血流動力學不穩定的重癥患者,不建議過于積極足量給予TNA,因為患者不但不能從營養支持治療中獲益,反而增加了臟器代謝負擔,增加并發癥發生率。在此過程中,藥師可發揮專業優勢,建議臨床依據指南建議及患者個體化情況調整TPN治療,必要時調整支持治療方式或序貫過渡,促使臨床營養支持治療更加規范合理[11]。
3.3 藥師干預對TNA 費用的影響
本研究結果顯示,干預組患者日均費用明顯低于對照組,提示藥師干預可有效降低患者的營養類藥物費用[12]。但干預前后人均費用無顯著差異,分析原因可能與患者疾病狀況、轉歸、住院時間差異大等因素密切相關。其中涉及的營養類藥品價格在研究期內未作調整,故研究結果較可信,但今后還需進行大樣本、設計更嚴格的研究,進一步考察干預措施對患者營養支持治療費用的影響。
3.4 小結
本研究中不僅關注了TNA 配伍規范性問題,還關注了患者個體化營養支持治療的適宜性問題,并結合營養支持的診療規范,對患者營養支持治療的時機和方式的適宜性等方面進行干預評價,避免單純從藥品角度去評價用藥合理性,體現了以患者為中心的服務宗旨和合理用藥的循證理念。本研究中雖對患者的營養用藥費用進行了初步比較,但未考慮營養治療相關的間接成本及與患者預后的關聯性,存在一定的不足。藥師參與TNA 醫囑審核干預,可提高TNA 醫囑臨床使用的合理性,保障患者的用藥安全,同時減輕了患者的經濟負擔[13]。藥師作為臨床治療團隊不可或缺的成員,在進行營養醫囑審核干預外,可利用信息化手段進一步探索延伸至患者營養支持治療的實施及用藥監護中,促進更精細化藥學服務的實現。

