溴氰蟲酰胺暴露對赤子愛勝蚓的轉錄組學的影響
喬治華,劉 翔,姚向峰,杜慶志,張建業,孫石昂,張風文,姜興印*
(1.山東農業大學植物保護學院,泰安 271018;2.農藥毒理與應用技術省級重點實驗室,山東泰安 271018;3.中國農業科學院煙草研究所,山東青島 266101)
在現代農業生產中,農藥被廣泛應用于防治病蟲草害[1],溴氰蟲酰胺作為第二代雙酰胺類殺蟲劑,已得到廣泛應用。溴氰蟲酰胺具有觸殺和內吸作用,當接觸害蟲并被蟲體吸收后,激活靶標昆蟲的魚尼丁受體(RyRs),造成昆蟲細胞內外鈣離子濃度平衡破壞,最后肌肉過度收縮導致昆蟲死亡[2-3]。目前關于溴氰蟲酰胺的主要研究集中于對靶標害蟲的防治。研究表明,溴氰蟲酰胺可以很好地防治鱗翅目[4]、半翅目[5]和纓翅目[6-7]害蟲。通常,溴氰蟲酰胺在蔬菜和果樹上可直接噴霧使用或者灌根防治害蟲[8-10],在玉米田中可以直接進行種子處理和土壤混施等方式來防治小地老虎和雙委夜蛾[11-12],先正達于2020年首次登記溴氰蟲酰胺種子處理懸浮劑,用來防治玉米田小地老虎。這些防治方法都是利用了其優良的內吸活性,來達到防治害蟲的效果。隨著使用時間的延長,農藥的弊端也逐漸暴露出來,農藥對土壤環境、水環境的污染逐漸受到人們的關注[13-14]。溴氰蟲酰胺的長期使用,在土壤中發生富集,也必然會對土壤環境帶來問題。
蚯蚓廣泛分布于土壤中,占土壤動物生物量的60%~80%,是控制陸地生態系統物質和能量循環的重要組成部分[15-16]。蚯蚓因為具有對環境污染物敏感,體積較大,常見,易于繁殖等特點,常作為監測土壤污染的指示生物,特別是用于確定土壤中污染物的生態毒理學[17-18]。
隨著分子生物學的發展,一些現代化的手段應用于蚯蚓的生態毒理學研究,如轉錄組學、基因組學、蛋白組學、代謝組學等[19-21]。通過現代分子生物學手段研究對蚯蚓微觀指標的影響成為目前生態毒理學研究的熱點,通過轉錄組學可以研究污染物對生物的轉錄水平的影響,從而探究其分子機理。
目前溴氰蟲酰胺對環境生物的影響研究較少,主要集中于急性毒性和生理生化水平的亞慢性毒性研究,而在轉錄組學水平上的研究尚未報道。本研究的主要目的是研究溴氰蟲酰胺對于土壤生物蚯蚓的生態毒性,基于本研究前期溴氰蟲酰胺對蚯蚓的基礎生理生化指標的研究結果,進一步通過轉錄組學的方式研究溴氰蟲酰胺對蚯蚓轉錄水平的影響,及其對蚯蚓使用的分子機理,同時評價溴氰蟲酰胺對于土壤環境的影響,為溴氰蟲酰胺的合理使用提供理論基礎。
1 材料與方法
1.1 試劑與儀器
94%溴氰蟲酰胺原藥,上海杜邦農化有限公司;TRIzol試劑,上海生工生物技術有限公司;RNA Nano 6000檢測試劑盒,安捷倫科技(中國)有限公司。QuantStudio 5 熒光定量PCR 儀,美國ABI 公司;BIO-BEST140E紫外凝膠成像儀,美國SIM公司;MyCyclerTMThermal Cycler梯度PCR基因擴增儀,美國Bio-rad公司;NanoDrop One分光光度計,賽默飛世爾科技中國有限公司。
1.2 赤子愛勝蚓
赤子愛勝蚓(Eisenia fetida)購于江蘇省句容市王軍蚯蚓養殖場。在天然的土壤中,20±1℃下馴養2 w后使其適應人工養殖環境。試驗前,取環帶明顯且大小較一致,重量在300~500 mg的健康成蚓,用0.9%的生理鹽水將蚯蚓體表洗凈,放置在培養皿中,皿內鋪有去離子水濕潤的濾紙。20±1℃下放置一夜,目的是清除蚯蚓腸道內的雜質等[22],保證試驗過程中蚯蚓的死亡率不超過1%。
1.3 試驗土壤
蚯蚓的試驗土壤采用OECD土[23]。高嶺土和苔蘚泥炭土均購于普天試劑公司。

表1 OECD 土配方
1.4 試驗方法
1.4.1 蚯蚓染毒
溴氰蟲酰胺在土壤中的初始殘留濃度為0.40~3.6 mg/kg,半衰期為9.2~20.8 d[14,24],根據我們先前的研究結果[25-26],轉錄組試驗設計溴氰蟲酰胺濃度為0.1、10 mg/kg干土和100 mg/kg干土,以丙酮處理為對照組,后面的轉錄組分析0.1 mg/kg干土處理組編號為Cya.L,10 mg/kg干土處理組編號為Cya.M,100 mg/kg干土處理組編號為Cya.H,丙酮對照組編號為CK。
稱取0.212 8 g溴氰蟲酰胺原藥用丙酮溶解于100 mL的容量瓶中配制成2 000 mg/L的母液,然后將母液稀釋為系列濃度。在50 g的人工土中加入適量的藥液配制成所需要濃度的土壤[23],對照組加入25 mL丙酮,攪拌均勻,放于通風處使丙酮揮發干凈,再和450 g人工土混合均勻。加入一定量的無菌去離子水,使土壤含水量達到土壤質量的40%,放在1 L的燒杯中。
從低濃度到高濃度依次進行染毒,每個處理3個重復。每個燒杯放入15條經過清洗大小一致的蚯蚓,每周于土壤表面加入定量的牛糞和水,用皮筋將保鮮膜封住燒杯口并扎孔保持空氣的流通[27]。放在生化培養箱,溫度為20±1℃,L//D=12 h∶12 h[22]。于染毒后14 d取樣,樣品用液氮及時冷凍,并放入-80℃冰箱凍存待檢測。
1.4.2 蚯蚓轉錄組學檢測與分析
用TRIzol試劑按照說明書提取蚯蚓樣品中的總RNA。RNA的完整性通過Agilent Bioanalyzer 2100系統(Agilent Technologies,CA,US)的RNA Nano 6000檢測試劑盒檢測。RNA的純度和濃度由NanoDrop One 分光光度計測定(Thermo Fisher Scientific,Wilmington,DE)。樣品經過檢測合格之后,由南京集思慧遠生物科技有限公司進行轉錄組測試。本試驗參考基因組信息詳見網址https://bigd.big.ac.cn/search/?dbId=gwh&q=GWHACBE00000000。對差異表達基因在7個數據庫(Swiss-Prot,GO,KEGG,COG,KOG,Pfam,NR)進行比對。
采用DESeq2 軟件進行差異篩選,將Fold Change≥2且FDR<0.05作為篩選標準。使用R(v3.6.2)ggplot2程序包繪制差異基因火山圖,使用R(v3.6.2)pheatmap繪制基因表達聚類熱圖。利用clusterProfiler R軟件包實現差異表達基因(DEGs)的基因本體(GO)富集分析,使用Kobas軟件檢測[28]KEGG通路中差異表達基因的富集。
1.4.3 熒光定量PCR
通過RT-qPCR技術對轉錄組數據準確性進行驗證,選擇10個與差異顯著相關的基因進行熒光定量表達分析,基因及其引物序列設計列表見表2。反應體系見表3、4。每處理3次生物學重復,每個重復3次技術重復,采用2-ΔΔCT法進行數據分析計算。

表2 用于實時熒光定量PCR 的蚯蚓基因引物序列設計

表3 實時熒光定量PCR 反應體系配制

表4 實時熒光定量PCR 反應條件
2 結果與分析
2.1 RNA質量檢驗
所有用于轉錄組的RNA質量檢測如圖1所示,通過電泳條帶可以看出18SRNA條帶清晰無拖尾,由于大多數的無脊椎生物中28SRNA 有一個“hidden break”的結構[29],恰好位于28S的中央導致電泳時與18S重合。通過Nanodrop定性定量分析,各個處理的OD260/280值均在1.8~2.2之間,檢測結果均為A,說明RNA的純度和完整性較好,RNA濃度均大于400 ng/μL。則12個樣品的RNA質量合格,符合建庫的要求。

圖1 RNA 提取電泳結果
2.2 差異表達基因篩選與分析
圖2可以快速準確地比較出1、10 mg/kg干土溴氰蟲酰胺處理的蚯蚓與CK的差異基因數目。圖中一個點代表一個基因,其中點偏離橫坐標的0點越遠,說明該點對應的基因的表達量與CK差異越大;點的縱坐標越大,說明該點代表的基因在樣本間差異表達越顯著。因此試驗中應盡量選擇偏離橫坐標原點且縱坐標值大的點所代表的基因作為功能驗證基因。

圖2 1 mg/kg 干土(A)、10 mg/kg 干土(B)和100 mg/kg 干土(C)溴氰蟲酰胺處理14 d 后蚯蚓差異表達基因(DGEs)的數量火山圖及差異基因韋恩圖(D)
我們可以發現1 mg/kg干土的處理在第14 d時與CK相比,顯著差異基因有960個,其中上調表達438個,下調表達522個(圖2A)。10 mg/kg干土的處理在第14 d時與CK相比,篩選出顯著差異基因1 212個,其中上調表達632個,下調表達580個(圖2B)。100 mg/kg干土處理在第14 d時與CK相比,篩選出顯著差異基因1 081個,其中上調表達608個,下調表達473個(圖2C),同時從1 mg/kg干土到10 mg/kg干土差異基因顯著增多,10 mg/kg干土到100 mg/kg干土差異基因有所下降。由圖2D中的韋恩圖可知,蚯蚓在3 個處理組中共有3 253 條差異表達基因(differentially expressed gene,DEG),不同差異表達基因集中的DEG有重疊,其中93個基因在不同處理組間均呈現出差異表達。
對差異表達的基因進行聚類分析(圖3),其中橫坐標表示不同樣品對應的基因。顏色不同表示基因在樣品中的表達量水平不同。2個處理間所有差異表達基因共聚類成6組,組內基因的表達水平基本相似。通過結果我們可以看出CKvsCya.L(圖3A)中聚類結果將CK和Cya.L很好地分開,每個處理的3個重復聚類到一起,說明重復性良好。同樣CKvsCya.M、CKvsCya.H也是如此。
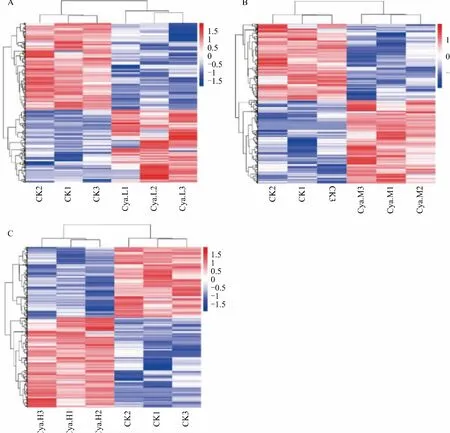
圖3 CK vs Cya.L(A)、CK vs Cya.M(B)、CK vs Cya.H(C)差異表達基因聚類圖

圖4 CK vs Cya.L(A)、CK vs Cya.M(B)、CK vs Cya.H(C)的差異表達基因GO 注釋分類統計圖
2.3 差異表達基因功能富集分析
2.3.1 差異基因注釋結果
對篩選的差異基因與7個數據庫進行比對分析,得出在各個基因庫中注釋的基因數量如表5所示。可以看出CKvsCya.L在7個數據庫中比對注釋的基因數為586個,其中在GO注釋基因數為288個,KEGG數據庫注釋基因數為65個,COG數據庫注釋基因數86個;CKvsCya.M在7個數據庫中比對的注釋基因數為760個,其中在GO注釋基因數為438個,KEGG數據庫注釋基因數為125個,COG數據庫注釋基因數為114個;CKvsCya.H在7個數據庫中比對的注釋基因數為669個,其中在GO注釋基因數為413個,KEGG數據庫注釋基因數為111個,COG數據庫注釋基因數為113個。

表5 注釋的差異表達基因數量統計表
2.3.2 差異基因GO富集分析
共有25 709條Unigene被成功注釋到三大類的55個二級功能條目中。3個處理在細胞組分共富集了19個功能條目,在分子功能共富集了13個功能條目,在生物學過程共富集了23個功能條目。細胞組分上1、10、100 mg/kg干土處理與CK相比,胞外區、細胞、膜部分、突觸部分、細胞組分等二級分類的功能條目顯著增加。分子功能上1、10、100 mg/kg干土與CK相比,酶的催化活性、分子功能調節轉錄調節活性等二級分類的功能條目顯著增加。在生物學過程上,1、10、100 mg/kg干土處理與CK處理相比,繁殖、細胞進程、繁殖過程、發育過程、生長、刺激反應、生物調節、解毒等二級分類的功能條目顯著增加。
2.3.3 差異基因KEGG富集分析
在圖5中,3個濃度的處理與CK之間的差異基因富集的KEGG一級代謝通路均為細胞進程、遺傳信息處理、人類疾病、環境信息處理、代謝作用、有機系統六大通路。在細胞進程一級代謝通路中,各個處理的差異基因主要富集于細胞的生長與死亡、真核生物的細胞群落、運輸和分解代謝3個二級代謝通路中,同時高濃度(10、100 mg/kg干土)的處理在細胞進程代謝通路富集的差異基因顯著高于低濃度(1 mg/kg干土)的處理。在環境信息處理一級代謝通路中,低濃度(1 mg/kg干土)的處理的差異基因主要集中于信號轉導、信號分子的相互作用二級代謝通路。高濃度(10、100 mg/kg干土)處理相比于低濃度又增加了膜信號二級代謝通路,同時在其他2個二級代謝通路富集的差異基因也顯著增加。在遺傳信息處理的一級代謝通路中,各個處理的差異基因主要富集于折疊、分類和降解,高濃度(10、100 mg/kg干土)處理均有差異基因在翻譯二級代謝通路富集。在新陳代謝一級代謝通路中,低濃度(1 mg/kg干土)處理的差異基因在糖代謝二級通路富集最多,在其他6條二級通路富集差異基因較少。在高濃度(10、100 mg/kg干土)處理中,在脂質代謝二級通路富集的差異基因最多,100 mg/kg干土的處理組在糖代謝二級通路中與低濃度處理相比,富集的差異基因顯著增多。同時高濃度處理組中差異的二級通路也比低濃度處理增多。在有機系統一級代謝通路中,低濃度的處理差異基因主要富集在內分泌系統和免疫系統。在高濃度的處理中差異基因顯著增多,同時富集的二級通路也顯著增加。主要表現在原有的二級通路富集基因數增加,同時增加了在循環系統、環境適應、消化系統等二級通路的富集基因。

圖5 CK vs Cya.L(A)、CK vs Cya.M(B)、CK vs Cya.H(C)的差異表達基因KEGG 分類圖
2.3.4 RT-qPCR對關鍵基因的驗證
分別選取了10 個差異顯著的基因進行了RT-qPCR驗證,通過計算出相對表達量與CK的相對表達量倍數得出圖6。可以看出經過RT-qPCR后的結果與轉錄組學的結果基本一致。結果顯示控制谷胱甘肽S-轉移酶基因evm.TU.Chr02.2134表達下調,控制熱激蛋白70基因evm.TU.Chr11.1027上調,控制細胞色素P450 18 a1基因evm.TU.Chr01.306和evm.TU.Chr04.1250均下調。控制鈣調蛋白-腺苷酸環化酶反應的基因evm.TU.Chr11.1424下調。控制調節幼蟲生長發育的基因evm.TU.Chr09.1717下調,證明本次轉錄組測序結果可靠性較高。

圖6 RT-qPCR 對關鍵基因的轉錄水平驗證
3 討論與結論
基于Illumina HiSeq測序技術探究溴氰蟲酰胺對赤子愛勝蚓轉錄水平的影響。通過差異基因的韋恩圖和火山圖可以看出,溴氰蟲酰胺1、10 mg/kg干土和100 mg/kg干土處理與CK相比,差異基因顯著增加,這表明溴氰蟲酰胺對蚯蚓轉錄水平產生顯著影響。Zhu等[20]研究土壤中的TiO2納米粒子對蚯蚓的影響也是如此,從5 mg/kg到500 mg/kg與CK相比,差異基因也顯著增加。
GO數據庫是2000年構建的一個結構化標準生物學注釋系統,目的是建立一個基因及其產物適用于各個物種的知識標準詞匯體系[30]。GO注釋系統是一個有向無環圖,其中包括3個主要分支,分別為生物學過程、細胞組分和分子功能[31]。通過GO富集分析可以看出,暴露于溴氰蟲酰胺后,蚯蚓在細胞組分上與神經信號傳導的相關二級分類條目增加,這可能與溴氰蟲酰胺作用于魚尼丁受體,導致細胞內外鈣離子的變化有關。在分子功能的二級條目的基因富集說明蚯蚓暴露于溴氰蟲酰胺后,蚯蚓體內的各種抗氧化酶及其他酶的活性會發生變化,同時蚯蚓體內開始對于溴氰蟲酰胺的毒性做出反應調節,因此差異基因富集于酶的催化活性、分子功能調節和轉錄調節活性上。同時我們之前的研究也表明溴氰蟲酰胺能夠導致蚯蚓體內抗氧化酶活性的改變[25]。但是蚯蚓暴露于溴氰蟲酰胺后差異基因最多的還是富集于生物學過程上,可以看出隨著濃度的增加,溴氰蟲酰胺對蚯蚓的繁殖、生長的生物學過程的影響也在加強。刺激反應、生物調節、解毒二級功能條目主要是對外界的刺激條件做出反應,同時進行自身的調節作用和對污染物的解毒作用。隨著濃度的增加,這些二級功能條目的富集基因增加,說明蚯蚓對于溴氰蟲酰胺的毒性應激反應增加。Liu等[32]研究氯蟲苯甲酰胺對于蚯蚓生長繁殖的影響,試驗結果表明,隨著濃度的增加,蚯蚓的體重降低,繁殖量減少。同時也有研究表明蚯蚓暴露于污染物后體內的抗氧化酶活性、解毒酶活性、抗逆基因以及生殖基因等相關基因的表達量發生改變[33-35]。
作為有關Pathway的主要公共數據庫[36],KEGG主要提供代謝途徑的查詢,其中包括碳水化合物、核苷、氨基酸等代謝途徑及有機物的生物降解途徑,而且對催化各步反應的酶進行了全面的注解。KEGG是對生物體內代謝分析和代謝網絡研究的有效工具。通過KEGG差異基因富集分析可以看出,低濃度的溴氰蟲酰胺處理下主要影響環境信息處理和代謝途徑一級代謝通路,差異基因主要富集于這2個通路。而高濃度處理下,則影響環境信息處理、代謝途徑和有機系統一級代謝通路,同時富集的差異基因顯著增多,差異基因富集到的二級通路也顯著增加。這可能是溴氰蟲酰胺濃度增加對蚯蚓的影響增大引起的。在代謝途徑一級通路中,低濃度的溴氰蟲酰胺影響蚯蚓的差異基因主要富集于糖代謝途徑,而在高濃度處理下差異基因還更多的富集于脂質代謝途徑。這可能是溴氰蟲酰胺濃度的增高不僅對于糖代謝途徑影響加大,同時也開始影響脂質代謝途徑。內分泌系統和免疫系統是機體內起主導作用的調節系統,它們密切聯系,互相配合,維持內環境相對穩定[37]。當隨著濃度的升高,溴氰蟲酰胺開始影響蚯蚓的消化系統和循環系統。我們認為溴氰蟲酰胺可能首先導致蚯蚓的內分泌系統和免疫系統相關基因發生改變,然后導致內環境的紊亂,影響了蚯蚓的各種代謝途徑,最終導致循環系統和消化系統的相關基因表達發生改變。陳婷[38]研究重金屬鉛對蚯蚓的生態毒性表明,鉛能夠導致蚯蚓能量代謝、氨基酸代謝等代謝途徑失衡。
通過轉錄組學結果我們可以看出,低濃度的溴氰蟲酰胺對于蚯蚓的轉錄水平影響較小,影響的代謝通路較少。隨著濃度的升高,溴氰蟲酰胺對蚯蚓影響的差異基因增多,差異基因富集的代謝通路在增加,說明溴氰蟲酰胺對蚯蚓轉錄水平影響增大,可能對蚯蚓的毒性增大。

