貝伐珠單抗聯合免疫治療對非鱗非小細胞肺癌血清學指標及預后的影響
朱加作,李春燕,趙吉光,程志原,解 華
肺癌是我國最常見的惡性腫瘤,病死率居惡性腫瘤的首位,而非小細胞肺癌是臨床常見的病理類型,其中非鱗非小細胞肺癌(nsNSCLC)包括腺癌、大細胞癌及其他不常見的類型[1-2]。臨床研究顯示,大部分nsNSCLC患者在就診時已無根治性手術治療機會,且預后較差[3]。此外癌癥的治療策略需依據腫瘤臨床分期、病理類型及患者身體狀況等多種因素制訂,而在無法進行手術的情況下,患者僅能依賴藥物及放射治療。隨著現代醫學的發展,更為精確的分子靶向治療逐漸成為臨床研究熱點,其中免疫治療主要通過阻斷程序性細胞死亡分子1及其配體相互作用的免疫檢查點來達到治療癌癥的效果,目前臨床使用的藥物包括Pembrolizumab、納武利尤單抗、阿替利珠單抗等[4]。貝伐珠單抗是血管內皮生長因子(VEGF)抑制劑,能有效阻斷惡性腫瘤組織血管生成,目前已在多種癌癥治療中獲得肯定的效果[5]。本研究基于血清細胞角蛋白19片段抗原21-1(CYFRA21-1)、糖類抗原125(CA125)水平變化探究貝伐珠單抗聯合免疫治療對nsNSCLC患者預后的預測價值,現報告如下。
1 資料與方法
1.1 一般資料
回顧性分析2018年1月—2020年6月我院收治94例nsNSCLC的臨床資料。納入標準:均經組織病理學檢查確診,符合nsNSCLC的診斷標準[6];年齡>18歲,且<60歲者;無癌癥治療史;充分知情同意者。排除標準:無法耐受或對研究藥物過敏者;合并其他惡性腫瘤者;預計生存期<6個月者;存在腫瘤侵犯重要血管或腦轉移者;合并精神障礙者;心、腎、肝嚴重功能不全者;合并咯血或血液系統疾病者;妊娠或哺乳期女性。根據治療方案將納入患者分為對照組和觀察組,每組47例。2組一般臨床資料比較差異無統計學意義(P>0.05),具有可比性。見表1。

表1 2組非鱗非小細胞肺癌一般臨床資料比較
1.2 方法
2組均予以營養支持、止痛等常規對癥治療。在此基礎上對照組予以納武利尤單抗(Bristol-Myers Squibb Holdings Pharma, Ltd. Liability Company,批準文號:S20180014)3 mg/kg靜脈注射,治療時間60 min,治療頻率為2周1次,直至患者出現疾病進展或不可接受的不良反應。觀察組在對照組基礎上予以貝伐珠單抗(Roche Diagnostics GmbH,批準文號:S20170035)15 mg/kg靜脈注射,首次注射時持續90 min,若患者耐受性良好則自第二次開始縮短至60 min,治療頻率為3周1次;納武利尤單抗使用劑量與對照組一致,但治療頻率調整為3周1次。在觀察組貝伐珠單抗治療3個周期結束后統計2組結果,治療期間對患者持續觀察,治療結束后均隨訪2年。
1.3 臨床療效
治療3個周期后,探究2組臨床療效差異,以影像學檢查結果為參考,使用WHO頒布的實體瘤療效評價標準1.1[7]對療效進行評估。完全緩解:所有目標病灶完全消失;部分緩解:全部可測量靶病灶直徑之和縮小超過30%;疾病進展:出現新病灶或全部可測量靶病灶直徑之和增大超過20%;疾病穩定:處于部分緩解與疾病進展之間者。總有效以完全緩解與部分緩解之和計算。
1.4 血清學指標
比較2組治療前、治療3個周期后血清癌癥相關指標及生長因子指標差異,采集患者空腹靜脈血6 mL,離心后取血清,應用化學發光定量法檢測血清CYFRA21-1水平,應用微粒子發光法檢測血清CA125水平,應用酶聯免疫吸附試驗檢測血清載脂蛋白A1(ApoA1)、VEGF、轉化生長因子-β1(TGF-β1)、巨噬細胞移動抑制因子(MIF)水平。
1.5 不良反應及生存情況
記錄并統計2組治療期間不良反應發生情況及隨訪2年生存情況差異。
1.6 統計學方法
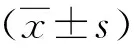
2 結果
2.1 臨床療效比較
觀察組治療3個周期后臨床總有效率高于對照組(P<0.05)。見表2。
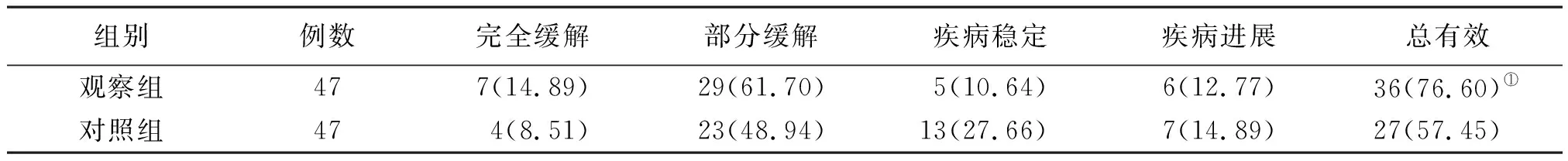
表2 2組非鱗非小細胞肺癌臨床療效比較[例(%)]
2.2 血清癌癥指標比較
治療3個周期后,2組血清CYFRA21-1、CA125水平均較治療前降低,且觀察組低于對照組(P<0.05)。治療3個周期后,2組血清ApoA1較治療前升高,且觀察組高于對照組(P<0.05)。見表3。
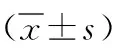
表3 2組非鱗非小細胞肺癌治療前后血清癌癥指標比較
2.3 血清生長因子指標比較
治療3個周期后,2組血清VEGF、TGF-β1、MIF水平均較治療前降低,且觀察組低于對照組(P<0.05)。見表4。
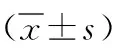
表4 2組非鱗非小細胞肺癌治療前后血清生長因子指標比較
2.4 不良反應比較
治療期間,2組疲勞、腹痛腹瀉、惡心嘔吐、口腔潰瘍、食欲不振、皮疹等不良反應發生率比較差異無統計學意義(P>0.05)。見表5。

表5 2組非鱗非小細胞肺癌治療期間不良反應比較[例(%)]
2.5 2年生存率比較
隨訪2年后,觀察組2年生存率為93.62%,對照組2年生存率為85.11%。2組2年生存率比較差異無統計學意義(P>0.05)。見圖1。
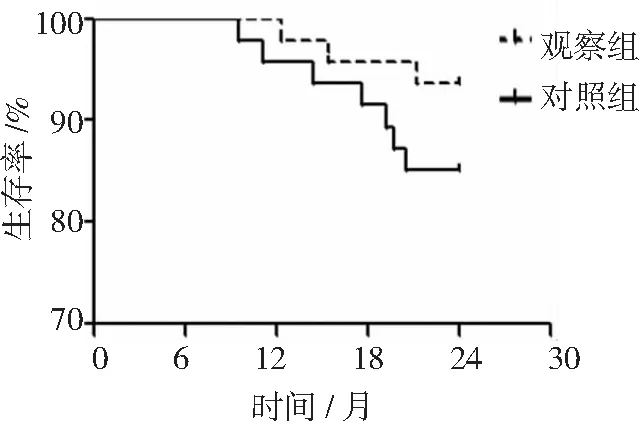
觀察組予以貝伐珠單抗聯合納武利尤單抗治療,對照組予以納武利尤單抗治療。圖1 2組非鱗非小細胞肺癌隨訪2年生存情況
3 討論
nsNSCLC是臨床常見的肺癌類型,由于大多數患者確診時已屬于晚期,喪失根治性手術機會,臨床多采用化療方案治療。有部分研究認為,盡管化療能延長nsNSCLC患者中位生存時間,但對提高遠期生存率的效果仍存在爭議[8-9]。隨著免疫治療技術的發展,程序性細胞死亡分子1及其配體通路選擇性抑制劑在腫瘤治療中逐漸應用,成為治療多種癌癥的新選擇,該藥物可通過激活殺傷性T淋巴細胞發揮抗腫瘤作用[10-11]。腫瘤可通過新生血管進行增殖,抗血管生成藥物主要通過阻斷新生血管發揮抗腫瘤作用,且能改善腫瘤微環境中的免疫抑制,因此具有提升免疫治療效果的可能性[12],故本研究探討抗血管生成藥物聯合免疫治療對nsNSCLC患者的效果。
貝伐珠單抗屬于抗血管生成藥物,是一種VEGF單克隆抗體,能特異性結合VEGF異構體中的VEGF-A,阻斷其與相關酪氨酸激酶受體之間的相互作用[13]。本研究結果顯示,觀察組治療3個周期后臨床療效更好,其原因可能在于腫瘤生長過程中異常的血管生成可引起微環境免疫抑制,抑制異常血管生成可使腫瘤微環境趨于正常,有助于抗腫瘤藥物在患者體內起效,因此貝伐珠單抗對免疫治療有增效作用。RIZVI等[14]研究證實,抗血管生成藥物聯合免疫治療能提升癌癥治療效果,本研究結果與之相似。CYFRA21-1廣泛分布于層狀或鱗狀上皮中,其水平上升與腫瘤細胞溶解或壞死存在聯系[15];CA125在正常人血清中含量低下,但機體正常組織被腫瘤浸潤時會被釋放進入血液[16];ApoA1是由肝臟及小腸合成的功能蛋白,能在一定程度上調節腫瘤微環境及機體免疫反應。本研究結果顯示,治療3個周期后,觀察組血清CYFRA21-1、CA125水平低于對照組,而ApoA1水平高于對照組。究其原因可能在于:1)聯合使用貝伐珠單抗能通過競爭性結合相關受體阻斷血管生成,進而阻斷腫瘤組織的營養供應,發揮抗腫瘤作用[17];2)nsNSCLC患者血管生成因子與抗血管生成因子失衡,內皮細胞大量增殖、遷移在腫瘤組織周圍形成高通透性的管狀及囊狀血管,影響組織周圍血流,不利于抗腫瘤藥物發揮作用,而貝伐珠單抗通過抑制異常血管生成,為免疫治療藥物在腫瘤局部的聚集創造條件,進而改善患者血清癌癥指標。
VEGF能與相應受體結合而介導血管生成,還可參與腫瘤的生長、浸潤、轉移過程;TGF-β1可通過調節基質金屬蛋白酶的表達影響腫瘤細胞增殖、轉移;MIF可通過影響細胞分裂、調節免疫反應、促血管生成等參與腫瘤生長進程。本研究結果顯示,治療3個周期后,觀察組血清VEGF、TGF-β1、MIF水平均低于對照組。其原因可能在于貝伐珠單抗可直接抑制血管生成,進而降低患者體內血清生長因子水平。從不良反應來看,貝伐珠單抗聯合免疫治療盡管會導致部分不良反應發生增加,但2組之間差異并無統計學意義,提示聯合用藥的安全性尚在可接受的范圍內。鄔仁華等[18]研究證實,免疫治療聯合貝伐珠單抗治療Ⅳ期肺腺癌不會導致不良反應增加,本研究結果與之一致。本研究結果還顯示,2組2年生存率比較差異無統計學意義,可能與本研究隨訪時間較短有關。
綜上所述,貝伐珠單抗聯合免疫治療有利于提高nsNSCLC患者的臨床療效,還能降低血清CYFRA21-1、CA125及相關生長因子水平,且不良反應不會顯著增加,安全性較好,但對患者生存期無顯著影響。本研究的不足之處為單中心研究,有待臨床進一步展開多中心、大樣本研究,深入探討貝伐珠單抗聯合免疫治療的有效性。

