復合微生物菌劑對大豆生長發育、結瘤和產量的影響
候婷婷 于德水 何鑫 劉治廷 曹旭 陳靜宇 王向向 李晶 孟利強
摘要:大豆是重要的糧食與經濟作物,與根瘤菌形成共生固氮體,將空氣中的氮轉化成NH+4供大豆使用,然而大豆生長后期固氮能力降低,因此選用綠色肥料復合菌劑檢測大豆產量等是否提升,為農業上大豆生長提供理論依據。為探究不同根瘤菌和復合微生物菌劑對大豆生長、結瘤和產量的效果,通過大量盆栽試驗,以前期分離、鑒定、純化的快生型根瘤菌HH103、TY3-5-12株根瘤菌和3種單一微生物菌劑(枯草芽孢桿菌、膠凍芽孢桿菌、巨大芽孢桿菌)為供試材料,對黑河43號大豆分別進行根瘤菌與菌劑的組合處理,研究不同根瘤菌與不同微生物菌劑下大豆結瘤數、根瘤干質量、鮮質量、株高、根長、單株質量、生物量、產量等數據。結果表明:接種根瘤菌均能促進大豆根系結瘤,提高農藝性狀與生長發育,其中根瘤菌TY3-5-1主要提高大豆農藝性狀;根瘤菌HH103主要是增加大豆的產量,2種菌株的結瘤數無明顯差異;施入微生物菌劑后,復合微生物菌劑對大豆的影響明顯高于單一菌劑;將2種根瘤菌1∶1混合形成復合菌劑對大豆的產量、結瘤和性狀的影響明顯高于單一根瘤菌。復合微生物菌劑在根瘤菌的配施下明顯增加結瘤數,促進大豆的生長發育與產量提高。
關鍵詞:大豆;復合微生物菌劑;根瘤菌;結瘤數;生長生理;產量
中圖分類號:S565.106文獻標志碼:A
文章編號:1002-1302(2023)10-0065-07
大豆是我國重要的糧食和油料作物,能夠為人類提供大量的植物蛋白與脂肪,也是我國進口量最大的農產品之一[1]。東北地區是我國大豆的主要產區,種植面積達30%以上,近年來,一方面由于國家對于農作物的結構調整,另一方面由于東北地區氣候環境特點,大豆產量大幅下降[2]。與玉米,小麥等農作物相比,大豆根系可以進行固氮,最常見的是大豆根部與根瘤菌共生形成根瘤,共生關系是互惠互利的,根瘤菌將空氣中的氮氣轉化為NH+4,為大豆生長發育提供豐富的氮,減少氮肥的使用,促進可持續發展農業,降低大豆成本,獲得較高產量,是大豆產業可持續發展的有效措施。
大豆起源于中國,已有5000多年的栽培歷史。有關豆類作物固氮共生的研究也已有百年之久,我國是全球根瘤菌資源最豐富的國家,從20世紀30年代起,我國就開始研究大豆與根瘤菌。我國幅員遼闊,地理和氣候多樣造就了大豆豐富的種質資源。早在20多年前,大豆與根瘤菌的互作就非常成熟,黑龍江地區根瘤接種面積達到了80%。在巴西,大豆產量占全球的28%,大豆根瘤菌的使用率達100%,在阿根廷,根瘤菌的使用面積也超過了90%,充分說明了根瘤菌在大豆種植方面的重要性[3]。盡管大豆與根瘤菌互作增加了大豆產量,增長速度卻在逐漸變慢,可能原因是:(1)菌劑在田間的競爭結瘤能力趕不上土著根瘤菌,本身黑土土壤內就存在大量的適應性強,結瘤能力好的土著性根瘤菌;(2)長期使用氮肥,抑制了根瘤菌結瘤、固氮,低氮能促進根瘤菌結瘤,高氮能抑制根瘤菌結瘤,我國目前仍選擇大量施加氮肥,可能會導致固氮結瘤能力弱;(3)大豆品種更新快,菌劑與大豆匹配性差,篩選優良的根瘤菌菌株進度較慢,導致結瘤能力差;(4)不同的根瘤菌菌劑類型根據不同的方式接種到不同類型的大豆內,包括:菌肥接種;土壤噴施;直接拌種和幼苗接種等,在不同的地區和生產下要選擇不同的接種方式才能最大程度地提高大豆產量[4-5]。
對大豆施加根瘤菌劑可以形成大豆-根瘤共生固氮,產生植物所需要的銨態氮,促進大豆產量提升土壤肥力,然而近幾年大豆產量增長速度逐漸變緩,大量施用化肥會降低土壤肥力,因此本試驗選用綠色肥料復合微生物菌劑代替化肥,通過大豆農藝形狀,結瘤數及產量經濟狀況的角度分析復合微生物菌劑對大豆的影響,從而為農業生態的未來發展提供有力依據。微生物菌劑,作為一種新型肥料,也是近年來應用較多的多功能肥料,相比于化肥,菌劑中含有的一些特殊微生物及其正常代謝的產物可以提高大豆周圍養分的含量,提高大豆的產量和品質。從長遠看,相對單一的微生物菌劑、復合菌劑能夠長期顯著發揮作用并提高土壤肥力[6]。因此本研究在大豆生長過程中通過大豆結瘤數、農藝形狀及產量等進一步觀察根瘤菌配施復合微生物菌劑對大豆生長的影響,以期為大豆的實際生產提供技術支撐。
1材料與方法
1.1供試材料
供試大豆品種為黑河43號:大豆品種更新快,為了研究黑河43添加復合菌劑與根瘤菌之后的產量和品質,田間試驗分析大豆出苗率,每個處理播種100顆種子,盆栽試驗每個處理播種3顆種子。
供試根瘤菌:模式菌株費氏中華根瘤菌菌株HH103;TY3-5-1(同試驗組篩選得到)。
復合微生物菌劑(枯草芽孢桿菌∶膠凍芽孢桿菌∶巨大芽孢桿菌=1∶1∶1):提前準備好所需3種菌,利用各自培養基配制,在無菌操作臺上用梯度稀釋法稀釋,進行斜面劃線,放入細菌培養基內,等菌長出后,對菌株進行形態學鑒定,觀察菌株的菌落形態、大小、顏色等特點,并在光學顯微鏡下進行革蘭氏染色,經觀察沒問題后放入-20℃內保存。在超凈工作臺上,將3種菌用移液槍蘸一點后放入100mL無菌水中,搖勻30min,吸取1mL到培養皿中,進行平板劃線,經細菌培養室培養后,放入室溫保存。
黑土選取:黑土有機質含量為8.42g/kg,速效磷含量為14.3mg/kg,速效鉀含量為128mg/kg,堿解氮含量為28.6mg/kg,pH值為7.6。一部分黑河43號在黑龍江省佳木斯市同江市三富村(地理位置47°79N,132°70E)大田試驗種植,另一部分大豆埋入黑土與蛭石體積比為2∶1混合的盆栽里,在黑龍江省科學院微生物研究所植物試驗室培養。
TY液體培養基含胰蛋白胨16g,酵母粉10g,氯化鈉5g,蒸餾水1000mL,pH值為7.6。LB固體培養基含胰蛋白胨10g,牛肉膏3g,氯化鈉5g,瓊脂17g,蒸餾水1000mL,pH值為7.2。
試驗用品:1m量尺、2000mL燒杯、2000mL量筒、麻繩、剪子、分析天平(精確度0.001g)、500mL錐形瓶、1000mL玻璃瓶、300mL塑料瓶、高溫滅菌鍋,臺式高速離心機等。
1.2方法
1.2.1盆栽試驗設計
第1天,將黑河43號大豆滅菌:挑選表面無縫光滑的大豆,鋪滿在玻璃皿底部,準備好次氯酸鈉與濃鹽酸,將裝好的大豆放入通風櫥里的玻璃器皿內,器皿蓋子立在側面,將100mL次氯酸鈉放入小燒杯內,并放入干燥器中,用移液槍吸取4mL濃鹽酸放入小燒杯內,迅速蓋上干燥器,使其產生氯氣,消毒17h,待完成后將大豆放入超凈工作臺內開強風吹30min,完成后放置在一側等待種植。將黑土:蛭石蘸水潤濕后(手能握住,松手能成塊散落即可),按照體積比為2∶1的比例混合后裝入300mL塑料瓶內,達到塑料瓶2/3處。1000mL玻璃瓶內放入2/3的水量,將塑料瓶座坐落在玻璃瓶上后包上錫紙,放入高溫滅菌鍋內滅菌30~60min,等待滅菌結束冷卻至室溫后,將滅好菌的大豆種入黑土,每盆3個種子,埋在離黑土表面4cm處。3~4d后選取1株長勢較好的大豆幼苗,將另2株拔掉。
第2天,將提前準備好的HH103與TY3-5-1等2種快生菌株從-80℃冰箱中拿出稀釋103倍。用移液槍吸取100μLHH103放入提前配好滅菌的5mLTY培養基內進行活化,搖床搖勻1d,將活化好的HH103拿出,取出1μL進行擴大培養,培養時用裝有TY培養基300mL的500mL錐形瓶進行培養,搖勻1d使得菌液的D600nm在0.8~1.0之間(D600nm利用分光光度計測量,空白對照選擇TY培養基)。將搖好的菌液裝在離心管進行富集離心,6000r/min,離心5min后將菌體富集下來,上清液倒掉,富集的菌體用無菌水重懸,先用100mL無菌水重懸,測量D600nm值(空白對照用無菌水),再用無菌水稀釋到D600nm值為0.1(若原來是0.5,則稀釋5次):稀釋時用移液槍吸取10.0mL菌液,加入帶玻璃珠滅菌的100mL無菌水中,靜置20min,在搖床上以200r/min充分振蕩30min,形成母液菌懸液。用無菌移液槍分別吸取10.0mL上述菌懸液加入無菌水,依次稀釋,直到D600nm值變成0.1。
第3天,將準備好的枯草、巨大、膠凍3種芽孢桿菌的斜面培養基從-20℃的冰箱中取出,將移液管伸入斜面培養基中蘸取菌株分別放入提前配好且滅菌培養基中,其中枯草、巨大2種菌放入LB培養基內,膠凍芽孢桿菌放入膠凍培養基內。28℃搖床中活化1d,等待大豆發芽。
1.2.2處理設計
將2種根瘤菌HH103與TY3-5-1每種1mL分別接入大田試驗和盆栽試驗,每個試驗共設2組,每組7個處理,每個處理重復10次,共140個處理:
(1)對照組(CK);(2)施加根瘤菌;(3)施加根瘤菌∶枯草芽孢桿菌=1∶1;(4)施加根瘤菌∶膠凍芽孢桿菌=1∶1;(5)施加根瘤菌∶巨大芽孢桿菌=1∶1;(6)施加根瘤菌∶復合菌劑=1∶1;(7)只施加復合菌劑。
大田試驗于2021年5月6日接菌,10月18日收獲成熟期考種。盆栽試驗于2022年5月9日接菌,6月9日收獲成熟期考種。
1.3測定指標與方法
1.3.1大豆農藝形狀
取每個處理組的植株進行室內考種,測定大豆株高、主根長、根總長、根體積、根瘤質量。
1.3.2大豆結瘤數與生物量
在大豆鼓粒期調查其結瘤情況,利用傳統挖掘法將大豆根部完全取出,從大豆子葉節處剪斷,把根部放入尼龍網袋中浸泡30min,再用清水沖洗,洗干凈后控干水分,將每株根部根瘤取下,計算根瘤數目,將每株所有根瘤放在分析天平上稱質量,記錄下根瘤鮮質量,放在量筒內加水根據排水法稱量根瘤體積,將稱完的根瘤在105℃下殺青30min,80℃烘干至恒質量,測量根瘤干質量[7]。
1.3.3大豆產量
測定大豆主莖總節數,單株粒數,單株莢數,將大豆籽粒在65℃烘箱下烘干至恒質量,測定單粒質量、百粒質量。
1.4數據處理
應用MicrosoftExcel2010進行數據處理,SPSS對數據進行顯著性分析,顯著性水平α=0.05、0.01。
2結果與分析
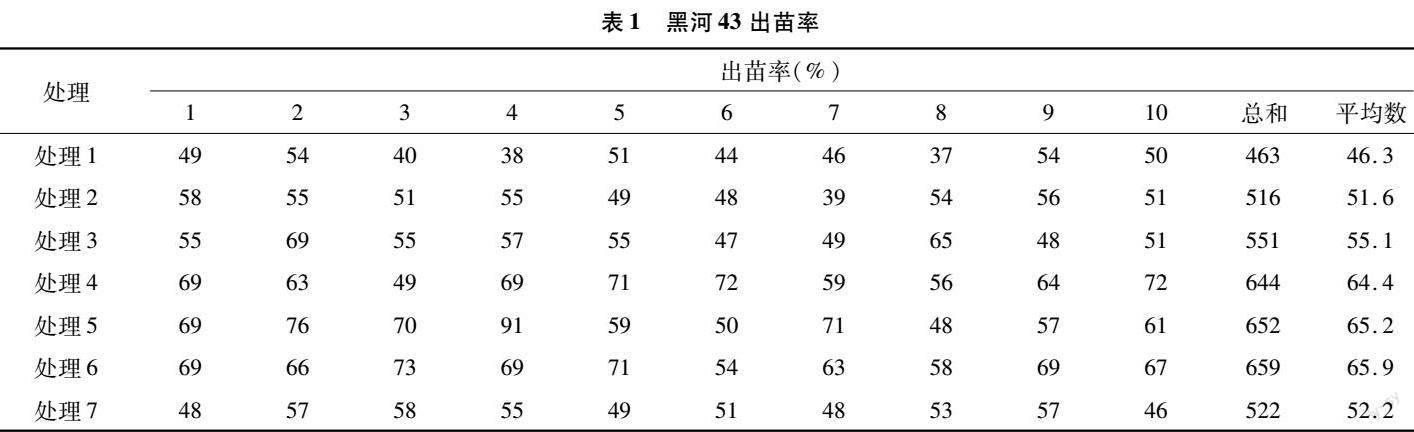
2.1大豆黑河43出苗率分析
由表1可知,每個處理種子出苗率均高于對照組,處理6種子出苗率最高,說明加入適量菌劑有利于種子發苗,其中復合菌劑和根瘤菌共同作用對種子出苗率影響最高。處理2對比處理7出苗率降低,說明在黑河43種子出苗期,根瘤菌對種子的作用低于復合菌劑。
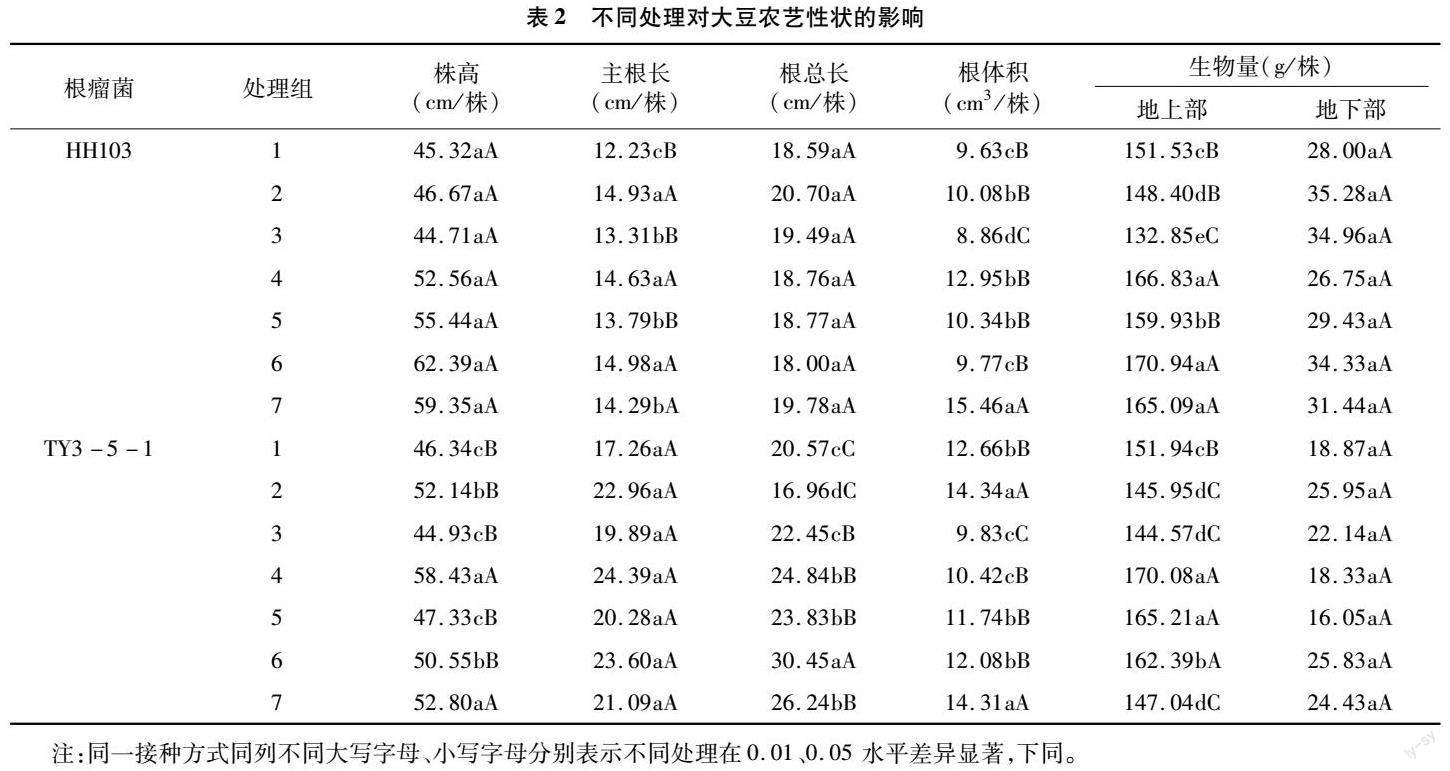
2.2大豆農藝性狀分析
由表2可知,在添加HH103根瘤菌處理中:大豆株高、主根長、根總長和地下部生物量均無顯著性差異。在大豆主根長中,處理6最長,較處理1增加22.49%,其次是處理2,較處理1增加22.08%,處理4較處理1增加19.62%,說明復合菌劑與根瘤菌共同作用效果最強,復合菌劑中的膠凍芽孢桿菌起主要作用,3種處理對比處理1均達到極顯著水平,比較處理2與處理7可以發現單獨施加復合菌劑處理不如根瘤菌效果好。在大豆根體積中,處理7根體積最大,較處理1增加60.54%,對比其他處理達到極顯著水平,處理3中的根體積對比處理2不增反降,說明枯草芽孢桿菌與根瘤菌對大豆生長起拮抗作用。大豆地上部生物量中,處理6生物量最大,其次是處理4與處理7,對比處理1增加12.81%,10.10%、8.95%,均達極顯著水平,說明復合菌劑與根瘤菌共同作用對大豆生物量影響最大,其中枯草芽孢桿菌起主要作用。處理2與處理3地上部生物量相比處理1在降低,說明單獨施加根瘤菌抑制了大豆地上部生物量的生長,可能是外源復合菌劑與土著根瘤菌競爭土壤養分導致的,處理3生物量最低,對比處理1降低了12.33%,說明枯草芽孢桿菌與根瘤菌共同作用對大豆生物量起抑制作用。
由表2可知,在添加TY3-5-1根瘤菌處理中,處理間大豆的主根長與地下部生物量無顯著性差異。在大豆株高中,處理4最高,其次是處理7與處理2,較處理1分別增加26.09%、13.94%、1252%,處理4、處理7對比處理1呈現極顯著差異,說明膠凍芽孢桿菌與根瘤菌共同作用效果最好,單獨施加復合菌劑和根瘤菌變化不大但二者呈現極顯著差異,處理3對比處理1株高降低但未有顯著性差異。在大豆根總長中,處理6最長,較處理1增加48.03%,對比其他處理呈現極顯著差異,處理2較處理1降低17.55%,二者呈現顯著差異,說明大豆施加復合菌劑后根總長的下降可能是大豆根際土著根瘤菌與外源根瘤菌競爭導致的。處理7對比處理1呈現極顯著差異,說明復合菌劑促進大豆根總長生長,膠凍芽孢桿菌作用最大。大豆根體積中,處理2、處理7對比處理1增加13.27%、1303%,呈極顯著差異。其他處理對比處理1根體積均降低,說明單獨施加復合菌劑與根瘤菌可以增加根體積,單一菌劑與根瘤菌作用反而抑制根生長,其中處理1對比處理3呈現極顯著水平,說明枯草芽孢桿菌與根瘤菌之間的拮抗作用最激烈。大豆地上部生物量中,處理4與處理5對比處理1增加11.94%、8.73%,呈現極顯著差異。處理6對比處理1生物量也增加6.88%,對比處理1呈現極顯著差異,與處理4、處理5呈現顯著差異,其他處理對比處理1均降低,說明復合菌劑與根瘤菌共同作用可以提升大豆地上部生物量,其中巨大芽孢桿菌與膠凍芽孢桿菌起主要作用。處理2、處理7與處理1呈現極顯著差異,說明單獨施加復合菌劑與大豆根瘤菌均會降低地上部生物量。
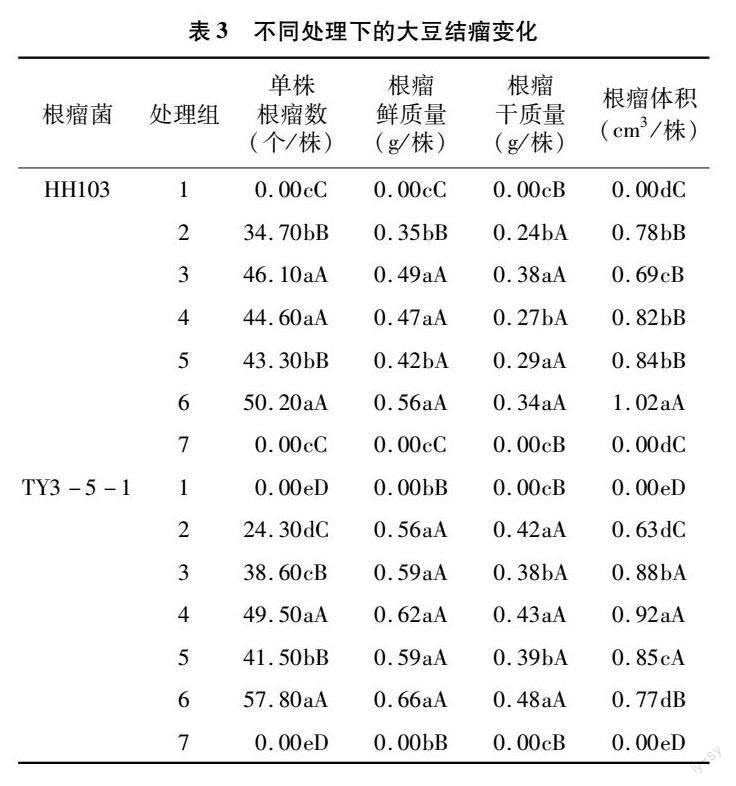
2.3大豆結瘤數分析
有研究表明,不添加根瘤菌的大豆生長過程中不產生根瘤菌[8-9],處理1與處理7結果同樣驗證了此結論,因此在結瘤數分析中只討論處理2至處理6。
由表3可知,在添加HH103根瘤菌處理中:在大豆單株根瘤數中,每個處理對比處理2均增加。說明在施加大豆根瘤菌后添加復合菌劑能有效提高根瘤數,其中復合菌劑作用效果強于單一菌劑,枯草芽孢桿菌效果最好。在大豆根瘤鮮質量中,處理6、處理3、處理4對比處理2增加60.00%、4000%、34.29%,對比處理2呈現極顯著差異,說明在大豆根瘤菌施加后復合菌劑作用強于單一菌劑,依然是枯草芽孢桿菌與根瘤菌作用效果最好。在大豆根瘤干質量中,處理3、處理6、處理5對比處理2增加58.33%、41.67%、20.83%,與處理2相比差異顯著,其中處理4對比處理2無顯著差異,說明枯草芽孢桿菌與根瘤菌共同作用效果最好。在大豆根瘤體積中,處理6根瘤體積最大,對比處理2增加30.77%,呈現極顯著性差異。處理3對比處理2降低11.54%,呈現顯著性差異,說明復合菌劑與根瘤菌共同作用效果最強,枯草芽孢桿菌與大豆根瘤菌作用產生的根瘤菌體積最小。
由表3可知,在添加TY3-5-1根瘤菌處理中,大豆根瘤鮮質量無顯著性差異。在大豆單株根瘤數中,每個處理根瘤菌均高于處理2,均呈極顯著差異。處理6根瘤數最多,對比處理2增加13786%,說明在施加大豆根瘤菌中添加單一菌劑和復合菌劑均增強根瘤效果,其中復合菌劑作用效果最強。在大豆根瘤干質量中,處理6根瘤干質量最大,較處理2增加14.29%,處理4較處理2增加2.38%,均無顯著性差異。處理3與處理5對比處理2根瘤干質量均降低,呈現顯著差異。數據表明在施加大豆根瘤菌后施加復合菌劑提升根瘤干質量,單一菌劑與根瘤菌作用降低干質量,說明是3種單一菌劑間的反應提升了根瘤干質量。在大豆根瘤體積中,每個處理對比處理2根瘤體積均增加,其中處理4根瘤體積最大,對比處理2增加46.03%,呈現極顯著差異。處理6根瘤體積低于處理4,說明3種單一菌劑之間的反應抑制了根瘤體積的形成。整體來看根瘤菌與復合微生物菌劑共同處理提高結瘤數與結瘤質量。
2.4接種根瘤菌后大豆經濟狀況分析
從表4可知,在添加HH103根瘤菌處理中:在大豆主莖節數中,每個處理的數量均高于處理1,除處理4外的其他5個處理均與處理1呈現極顯著差異,處理5、處理6與處理1的極顯著差異最明顯,分別增加了117.19%、115.62%,說明復合菌劑中巨大芽孢桿菌效果最強。在大豆分枝數中,每個處理對比處理1均增加且均與處理1呈現極顯著差異,其中處理7與處理3分枝數對比處理1增加5714%,處理6分枝數低于處理7。數據顯示單獨施加復合菌劑與枯草芽孢桿菌和根瘤菌共同作用效果相同,復合菌劑與根瘤菌共同作用低于單獨施加復合菌劑的效果,說明在分枝數中,復合菌劑單獨作用高于和根瘤菌共同作用。在大豆單株莢數中,每個處理均與處理1呈現極顯著差異,處理5單株莢數最多,對比處理1增加30.97%,處理2單株莢數低于處理1,說明單獨施加根瘤菌降低單株莢數。處理6與處理7低于處理4與處理5,說明單獨施加根瘤菌會降低大豆單株莢數,而枯草芽孢桿菌、巨大芽孢桿菌與根瘤菌作用后卻會明顯提升單株莢數。在大豆單株粒數中,每個處理對比處理1均增加并均與處理1差異極顯著,其中處理3最多,對比處理1增加26.63%,處理6高于處理7,說明復合菌劑促進根瘤菌提升大豆單株粒數,枯草芽孢桿菌與根瘤菌共同作用效果最強。大豆單粒質量中,每個處理對比處理1呈現極顯著差異,處理6單粒質量最高,對比處理1增加51.24%,處理6高于處理7,說明復合菌劑與根瘤菌共同作用效果高于單獨施加根瘤菌。處理5低于處理1,可能是巨大芽孢桿菌與根瘤菌作用降低了大豆根際土壤微生物或者養分。大豆百粒質量中,除處理4外的其他5個處理均與處理1呈現極顯著差異,處理6百粒質量最大,對比處理1增加20.89%,說明復合菌劑與根瘤菌共同作用高于復合菌劑單一作用。
從表4可知,在添加TY3-5-1根瘤菌這7個處理中:在大豆主莖節數中,每個處理的數量均高于處理1,除處理4外的其他5個處理均與處理1呈現極顯著差異,處理6主莖節數最多,對比處理1增加108.97%,其中處理3、處理4低于處理2,說明枯草芽孢桿菌與巨大芽孢桿菌抑制根瘤菌起作用。在大豆分枝數中,每個處理的數量均高于處理1(處理7除外),處理6與處理2最高,對比處理1增加52.94%,處理7與處理1數量相等,說明施加復合菌劑對大豆分枝數無影響,3種單一菌劑抑制根瘤菌對大豆起作用。在大豆單株莢數中,每個處理對比處理1均增加并均與處理1呈現極顯著差異,處理6單株莢數最多,對比處理1增加了36.01%,說明復合菌劑與根瘤菌共同作用效果最強。在大豆單株粒數中,每個處理對比處理1均增加并均與處理1呈現極顯著差異,處理7單株粒數最多,對比處理1增加了5939%,說明單獨施加復合菌劑對單株粒數效果最強,其中處理6高于處理2,說明復合菌劑促進根瘤菌對大豆起作用。在大豆單粒質量中,每個處理對比處理1均增加,處理2單粒質量最高,對比處理1增加了33.18%,說明根瘤菌對大豆單粒質量作用最強,菌劑減低根瘤菌的作用。在大豆百粒質量中,每個處理的質量均高于處理1并均與處理1呈現極顯著差異,處理6百粒質量最高,對比處理1增加了27.40%,說明復合菌劑與根瘤菌共同作用效果最強。
由表5可知,對大豆施加根瘤菌后繼續施加復合微生物菌劑明顯提升作物產量和品質。
2.52種根瘤菌對于大豆的農藝性狀和產量的綜合分析
研究2種根瘤菌對于大豆的農藝性狀和產量的數據對照,發現在根瘤菌結瘤數、主根長、根總長、根體積、單株莢數、百粒質量、分枝數、主莖總節數單株質量上TY3-5-1根瘤菌的促進作用更強;而在株高、生物量、單株粒數上HH103根瘤菌對大豆的促進作用更強;說明添加根瘤菌TY3-5-1可以提高大豆的農藝性狀,在圖1中將2種根瘤菌按照1∶1的比例混合施用大豆中,相對單一根瘤菌更能提升產量,從另一方面也證明了復合菌劑作用強于單一菌劑。
3討論與結論
大豆在生長發育過程中對氮素的需求量很多,因此調節好施氮與固氮之間的關系非常重要。大豆吸收氮素的主要來源有:從土壤中吸收氮素;生物固氮產生的氮素和化肥施氮。根系、根瘤是決定大豆養分高效吸收的重要因素,通過改良根系來增加大豆吸收養分的含量,為培養大豆新品種提供數據。諸多研究表明,種植大豆時接種根瘤菌可形成具有固氮作用的共生體,可以顯著提高豆科植物的根瘤數、單株質量、根瘤質量和生物量[10],本研究結果也很好地吻合這一系列變化,形成大豆-根瘤菌固氮。本研究在接入2種根瘤菌后,形態與產量對比對照組有明顯提升,說明接種根瘤菌對植株的生
長有促進作用,不僅能增加植株高度,還能明顯提高植株根瘤數、單粒數和生物量以及大豆產量,這與Mishra等的研究結果[11-12]一致。
在共生固氮的匹配性研究過程中,根瘤是決定大豆養分高效吸收的重要因素[13],大豆-根瘤菌共生體明顯能提高大豆根瘤數,復合菌劑的施用也大大提高大豆結瘤數,從而提高大豆養分吸收。根瘤菌與大豆植株形成根瘤是一個由共生雙方共同調控的多步驟過程,宿主大豆、根瘤菌與土著根瘤菌之間形成競爭作用,本試驗接種的HH103根瘤菌與TY3-5-1根瘤菌均為快生型大豆根瘤菌,在都促進植株生長的條件下,根瘤菌TY3-5-1主要是提高大豆的性狀形態,使植物長得又高又壯;根瘤菌HH103主要增加大豆的產量,提高大豆的經濟效益,因此選取2種根瘤菌按1∶1比例每種0.5mL添加到大豆中,做等量試驗,根據產量對比發現復合菌劑比單一菌劑更能促進大豆生長和形態。
然而豆科植物單單依靠根瘤固氮僅能滿足正常生命活動代謝所需的50%,在豆科生長后期會出現供氮不足的情況,因此需要在后期施入一定量的氮肥。化肥雖然含有各種豆科植物所需要的養分,但容易出現化肥添加過多反而減少豆科植物產量的現象,理論上隨著化肥增多施氮量增大,大豆固氮效果會降低,太多的化肥也不利于土壤生態系統平衡和循環利用。魏啟舜等研究表明,減施氮肥可以更好地促進大豆結瘤數促進大豆的生長[14-15]。Lanier等認為,接種菌肥可以有效提高作物產量[16]。而微生物菌劑作為綠色肥料剛好滿足提供適量養分增加大豆-根瘤菌固氮作用并且保護了生態環境。綜上可知,接種根瘤菌可以影響大豆的結瘤數,減氮肥影響了根瘤的固氮數,因此根瘤菌與微生物菌劑共同作用可以高效提高大豆形態與產量。本研究中施加單一菌劑得到的植株高度、根瘤數、生物量及產量整體上少于3種菌劑復合的處理6,一定程度上說明了復合菌劑效果整體上高于單一菌劑。
除此之外,根瘤菌接種方式也是影響大豆產量的另一個重要因素。唐穎等研究表明,施入顆粒菌肥的產量高于根瘤菌種下方式[17]。張紅俠等研究表明,噴施接種的產量高于根瘤菌液體拌種[18-19]。
可見,在大豆生長過程中,合理利用根瘤菌的固氮作用,用復合微生物菌劑來代替化肥從而減少氮肥,還可以提供大豆正常生長所需要的養分,提高大豆產量和品質[20],是大豆可持續發展的重要措施。2種根瘤菌1∶1混合施用再加入復合微生物菌劑,不僅能減輕化肥的使用成本,還可以達到大豆的穩定增長收入,在實際農業生產中可以推廣使用。
參考文獻:
[1]劉函西,呂浩,郭廣雨,等.大豆根瘤菌HH103rhcN突變對結瘤能力的影響[J].中國農業科學,2021,54(6):1104-1116.
[2]王蕾,姜昭,王磊,等.黑土區大豆耕地土壤障礙及其對策研究進展[J].大豆科技,2022(1):27-36.
[3]AlvesBJR,BoddeyRM,UrquiagaS.ThesuccessofBNFinsoybeaninBrazil[J].PlantandSoil,2003,252(1):1-9.
[4]伍惠.優良大豆根瘤菌株的分離、鑒定及應用研究[D].武漢:華中農業大學,2017.
[5]吳樹,徐玥,張磊,等.根瘤菌接種方式對復播大豆籽粒灌漿特性及產量的影響[J].江蘇農業科學,2022,50(5):101-106.
[6]何飛燕,杜全能,楊正,等.復合微生物菌劑對花生生長及產量的影響[J].江蘇農業科學,2020,48(14):104-109.
[7]徐玥,李玲,胥雅馨,等.根瘤菌接種方式對復播大豆生長及結瘤的影響[J].新疆農業科學,2022,59(4):810-817.
[8]馬家斌,于曉波,吳海英,等.接種根瘤菌對西南地區大豆光合性能和固氮能力的影響[J].中國油料作物學報,2020,42(1):102-108.
[9]HerrmannL,ChotteJL,ThuitaM,etal.Effectsofcroppingsystems,maizeresiduesapplicationandNfertilizationonpromiscuoussoybeanyieldsanddiversityofnativerhizobiainCentralKenya[J].Pedobiologia,2014,57(2):75-85.
[10]張博文,高珊,王玲玉,等.供氮水平對大豆結瘤固氮的系統性影響[J].鄉村科技,2021,12(34):53-55.
[11]MishraPK,BishtSC,MishraS,etal.CoinoculationofRhizobiumleguminosarum-Pr1withacoldtolerantPseudomonassp.improvesironacquisition,nutrientuptakeandgrowthoffieldpea(PisumsativumL.)[J].JournalofPlantNutrition,2012,35(2):243-256.
[12]李艷萍,張敏,袁梅,等.根瘤菌和復合促生菌對大豆結瘤和生長的影響[J].大豆科學,2017,36(4):583-591.
[13]廖紅,李欣欣,楊永慶,等.大豆養分高效根系遺傳改良[C]//2019年中國作物學會學術年會論文摘要集.杭州,2019:170.
[14]魏啟舜,郭東森,王琳,等.不同施肥條件下接種根瘤菌對鮮食大豆結瘤和產量的影響[J].江蘇農業科學,2021,49(23):77-82.
[15]朱海榮.減氮條件下增施根瘤菌肥和葉面液肥對大豆生長發育和產量的影響[J].江蘇農業科學,2022,50(1):60-65.
[16]LanierJE,JordanDL,SpearsJF,etal.Peanutresponsetoinoculationandnitrogenfertilizer[J].AgronomyJournal,2005,97(1):79-84.
[17]唐穎,盧林綱,隋文志,等.根瘤菌不同接種方式對大豆根瘤分布及產量的影響[J].現代化農業,2002(4):13-14.
[18]張紅俠,馮瑞華,關大偉,等.黃土高原地區優良大豆根瘤菌的篩選與接種方式研究[J].大豆科學,2010,29(6):996-1002.
[19]高山.大豆種質資源的結瘤性狀鑒定及不同大豆生態區土著根瘤菌的分離鑒定[D].哈爾濱:東北農業大學,2018.
[20]馬超,郭淼鑫,馬勝男,等.大豆根瘤菌HH103ΩNopAAΩNopD雙突變體構建及結瘤能力鑒定[J].中國油料作物學報,2022,44(5):989-995.

