纖溶酶原激活物抑制物-1在哮喘小鼠氣道炎癥反應中的作用*
周 霞 杜春玲
復旦大學附屬中山醫院青浦分院呼吸與危重癥醫學科,上海市 201700
支氣管哮喘(以下簡稱哮喘)是由嗜酸性粒細胞、肥大細胞和T細胞等多種炎性細胞參與的氣道慢性炎癥性疾病。纖溶酶原激活物抑制物-1(Plasminogen activator inhibitor 1,PAI-1)是纖維蛋白溶解系統的主要抑制劑,通過抑制纖溶酶原激活物對纖溶酶原的激活,抑制細胞外基質成分降解,促進細胞外基質成分過多沉積,從而在組織重塑中發揮重要作用;PAI-1還可調節細胞黏附、運動和細胞因子水平,在機體免疫、炎癥控制及細胞內信號轉導等方面具有重要作用[1-2]。目前有關PAI-1在哮喘炎癥反應中的作用研究甚少,本實驗通過PAI-1基因敲除(PAI-1-/-)小鼠制備哮喘模型,旨在探討PAI-1在哮喘炎癥反應中的作用。
1 材料與方法
1.1 實驗動物及分組 野生型BALB/C小鼠,購于上海斯萊克實驗動物有限責任公司。來源于BALB/C背景的PAI-1基因敲除小鼠為復旦大學呼吸病研究所繁育的穩定種群。鼠齡6~8周, 飼養于復旦大學醫學院SPF級動物室。將野生型和基因敲除小鼠隨機分為野生型對照組(NS/WT 組)、基因敲除對照組(NS/PAI-1-/-組)、野生型哮喘組 (OVA/WT組)和基因敲除哮喘組(OVA/PAI-1-/-組),每組8只。動物飼養及實驗方案均嚴格按照復旦大學動物倫理委員會動物實驗規范執行。
1.2 主要藥物和試劑 卵白蛋白、氫氧化鋁購于美國Sigma公司;生理鹽水購于上海百特醫療用品有限公司;磷酸鹽緩沖溶液(PBS)購于吉諾生物醫藥有限公司;CD68單克隆抗體和免疫組化試劑盒購于北京中杉金橋生物技術有限公司。小鼠Magnetic LuminexAssays (IL-4、IL-13、IL-10、IL-2、INF-γ),購于美國Life Technologies;戊巴比妥鈉購于德國默克公司。
1.3 主要儀器 壓縮式霧化器,型號:AG CLASSIC,購于飛利浦公司;全自動動物血細胞分析儀,型號:ProCyte Dx,購于美國IDEX公司;高通量多元生物醫學應用軟件MILLIPLEX Analyst,購于美國密理博公司;小動物肺功能檢測分析儀,型號:FinePointeTM NAM,購于美國Buxco公司。
1.4 動物模型復制[3]哮喘組均于第0天和第7天小鼠腹腔內注射致敏液(0.1mg OVA+2mg氫氧化鋁溶于0.1ml生理鹽水),第14天將小鼠置于自制透明密閉容器中40cm×30cm×20cm,用1% OVA溶液進行霧化吸入,1次/d,30min/次,連續7d。對照組則均使用生理鹽水腹腔注射,生理鹽水霧化吸入。最后1次激發后24h,用小動物肺功能儀檢測氣道反應性,以PBS、不同濃度的乙酰甲膽堿溶液(3.125、6.25、12.5、25、50mg/ml)進行支氣管激發,觀察不同濃度乙酰甲膽堿激發下特殊氣道阻力(specific airway resistance,sRaw)值的變化。
1.5 取材 腹腔注射1.5%戊巴比妥鈉60mg/kg麻醉,眼球取血后開胸,氣管插管并固定,使用1 ml注射器以無菌PBS行雙肺肺泡灌洗,回收率>80%,肺泡灌洗液(BALF)進行細胞分類計數。全血于3 000r/min,4℃,離心10min,取上清于-80℃凍存。
1.6 肺組織HE染色和CD68免疫組化染色 未灌洗過的肺組織放入緩沖中性福爾馬林液,固定48h后常規石蠟包埋切片、HE染色;免疫組化檢測肺組織巨噬細胞數量,陽性反應為細胞質呈棕褐色。
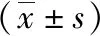
2 結果
2.1 肺功能檢測 OVA/WT組小鼠sRaw值在乙酰甲膽堿濃度為6.25、12.5和25mg/ml時顯著高于NS/WT組,表明哮喘模型構建成功。見表1。

表1 不同濃度乙酰甲膽堿激發下sRaw值變化
2.2 BALF炎癥細胞計數 OVA/PAI-1-/-組和OVA/WT組BALF的炎癥細胞總數及各分類計數均顯著高于對照組(P<0.01)。其中,OVA/PAI-1-/-組的中性粒細胞數量較OVA/WT組顯著上升(P<0.01)。見表2。

表2 BALF中炎性細胞水平
2.3 肺組織HE染色 NS/WT組和NS/PAI-1-/-組小鼠肺泡結構完整,未見明顯肺損傷;OVA/PAI-1-/-組氣道炎癥細胞浸潤及平滑肌增厚程度較OVA/WT組更為顯著。見圖1。

圖1 肺組織HE染色(×100)a.NS/WT 組 b.OVA/WT組 c.NS/PAI-1-/-組 d.OVA/PAI-1-/-組
2.4 肺組織CD68免疫組化染色 巨噬細胞是組織炎癥的主要來源。正常肺組織CD68表達較低,呈弱陽性,主要分布在肺泡腔內側。OVA激發后,OVA/WT組肺組織有大量的CD68+強陽性染色,提示巨噬細胞激活明顯。OVA/PAI-1-/-組小鼠肺組織CD68+陽性細胞數較OVA/WT增多。見圖2。

圖2 肺組織CD68的免疫組化染色(×200)a.NS/WT 組 b.OVA/WT組 c.NS/PAI-1-/-組 d.OVA/PAI-1-/-組
2.5 血漿細胞因子水平 與NS/WT組比較,NS/PAI-1-/-組血漿IL-13水平明顯升高,而INF-γ水平明顯降低(P<0.01或P<0.05)。OVA/PAI-1-/-組小鼠血漿中細胞因子IL-10、INF-γ含量較OVA/WT組顯著減少(P<0.01或P<0.05)。IL-4和IL-2水平在各組間無統計學差異。見表3。
3 討論
支氣管哮喘是由嗜酸性粒細胞、中性粒細胞、肥大細胞等多種炎癥細胞和細胞組分參與,與Th1/Th2型細胞因子產生失衡有關,以氣道高反應性、黏液過分泌和嗜酸性粒細胞浸潤為特征的氣道慢性炎癥性疾病。PAI-1可在中性粒細胞、單核細胞、肥大細胞、T淋巴細胞等細胞上表達,并與這些炎癥細胞的遷移活化密切相關,在機體免疫和炎癥控制方面發揮重要作用[4]。本研究發現,OVA/PAI-1-/-組小鼠BALF中的中性粒細胞數量較OVA/WT明顯增加;肺組織HE染色結果也顯示OVA/PAI-1-/-組小鼠肺組織炎性細胞浸潤較OVA/WT組更嚴重,CD68陽性細胞數較OVA/WT組增加,表明PAI-1在哮喘中對炎癥細胞的募集與趨化具有負調節作用,PAI-1基因缺失導致肺部炎癥細胞聚集。相反的,Ara Jo等人發現PAI-1-/-哮喘小鼠BALF中總炎癥細胞和嗜酸性粒細胞數量較野生型哮喘小鼠明顯減少,且肥大細胞來源的PAI-1在促進肺部炎癥反應和氣道重構中起主要作用[5]。慢性哮喘小鼠給予PAI-1抑制劑治療后,小鼠氣道炎癥反應和膠原沉積明顯減輕[6]。Tutluoglu B等人發現哮喘急性發作期患者血漿 PAI-1水平較健康者雖增加,但經激素治療后反而進一步升高[7]。因此,受研究對象、疾病嚴重程度等影響,PAI-1在哮喘病程中到底是起促炎還是抗炎作用及其具體調節機制需進一步研究。
PAI-1還可影響多種炎癥因子水平,Renchens等人發現PAI-1在健康肺組織過表達可導致肺內TNF-α、IL-6、IFN-γ和角質細胞源性趨化因子等細胞因子表達水平增加[8]。本研究顯示,PAI-1基因敲除使哮喘小鼠血漿中IL-10和INF-γ水平顯著降低。IL-10是具有抗炎和免疫調節的細胞因子,可抑制Th2細胞因子和抗原特異性IgE分泌,抑制肥大細胞脫顆粒釋放炎癥介質,阻止嗜酸粒細胞聚集及氣道高反應性,從而抑制過敏性炎癥反應[9-11]。INF-γ有利于Th1細胞的分化,抑制Th2細胞的分化,使Th1/Th2亞群達到平衡[12-13]。因此,PAI-1表達降低導致哮喘小鼠血漿中L-10和INF-γ水平降低不利于哮喘氣道炎癥的控制。除此之外,PAI-1在哮喘氣道重構中也占有重要地位,有研究表明,PAI-1通過抑制基質金屬蛋白酶和纖維蛋白溶解酶的活性促進氣道的膠原沉積,促進氣道高反應性、過敏性炎癥、氣道重塑的發生,加重哮喘[14]。哮喘患者的支氣管平滑肌細胞、炎癥細胞可在體外產生大量PAI-1,抑制纖溶酶的分裂作用,導致TGF-β1釋放減少,誘導平滑肌細胞合成膠原[15]。研究還發現緩解組哮喘患者血漿PAI-1水平還與FEV1% pred呈負相關,進一步提示PAI-1可能與氣道重構有關[16]。本實驗只局限在PAI-1對哮喘氣道炎癥水平的研究,對氣道重構的研究有待進一步探索和論證。
綜上所述,PAI-1表達降低促進哮喘小鼠肺部炎癥細胞募集,降低血漿IL-10和INF-γ水平,可加重哮喘氣道炎癥,提示血漿PAI-1水平或許可以成為評估哮喘患者氣道炎癥程度的標志物之一,為病情評估和指導用藥提供依據。

