羅伊氏乳桿菌對大鼠不同類型腹瀉的影響
王金銘,張如春,2,趙德輝,蔡熙姮,劉晗璐,3※
(1.中國農業科學院特產研究所,吉林 長春 130112;2.吉林農業大學動物科學技術學院,吉林 長春 130118;3.赤峰學院,內蒙古 赤峰 024000)
腹瀉是臨床上較為常見的癥狀之一,通常可以由藥物、細菌和病毒等因素所導致。一般感染性的腹瀉如細菌感染、病毒感染可以使用抗生素進行治療,但是對于抗生素的使用存在較大的爭議。近年來,微生物組學的研究表明,過度使用、長期使用、不正確使用抗生素以及抗生素的機械特性可能會引起抗生素相關性腹瀉(antibiotic-associated diarrhea, AAD)。AAD 被定義為與抗生素聯合發生的不明原因腹瀉[1],同時導致一些不良的后果,包括腸道菌群紊亂、假膜性結腸炎等。AAD的機制尚不明確,但目前認為主要是由于腸道微生物群落的破壞以及隨后碳水化合物、短鏈脂肪酸和膽汁酸代謝的變化而導致的滲透性腹瀉并對病原體的抵抗能力下降所導致[2]。2019 年國家農業農村部發布194 號公告,我國飼料中全面禁止添加抗生素,以減少濫用抗生素造成的危害,維護動物源食品安全和公共衛生安全,因此尋找新的止瀉策略成為研究的焦點。
益生菌被世界衛生組織定義為活的、非致病性的微生物,攝入后對宿主的健康和生理產生積極的影響[3]。在過去的幾十年中,益生菌對人和動物健康的有益作用在文獻中被大量報道。研究證明了益生菌對多種炎癥的輔助治療效果,如關節炎[4,5]、結膜炎[6]、濕疹[7]和胃腸炎[8]等,其中最重要的就是對炎癥性腸病的預防及治療效果,同時許多研究證實了內源性益生菌在胃腸道疾病中的預防及治療作用。益生菌主要的機制包括能產生抗菌物質[9]、能夠與病原菌競爭性抑制[10]及調節機體免疫系統功能[11]等,其作用機制也在被逐步揭示。目前大部分益生菌改善腸道健康的共同機制是益生菌可以防止或抑制病原體的增殖,抑制病原體產生毒力因子,調節腸道免疫功能,減輕腸道炎癥,從而減少后續的感染。近年來,許多研究表明,酵母菌[12]、芽孢桿菌[12]、乳桿菌[13]、雙歧桿菌[13]、片球菌、鏈球菌和放線菌等多種細菌都可以作為益生菌材料,并且乳桿菌被認為是最有潛力的益生菌。已有文獻報道羅伊氏乳桿菌對動物[8]和人[14]具有止瀉的作用如JIRI HRDY 等[15]研究發現,羅伊氏乳桿菌5454 和動物雙歧桿菌5764 改善了三硝基苯磺酸和嚙齒枸櫞酸桿菌引起的小鼠結腸炎。URBANSKA 等[16]在進行一項羅伊氏乳桿菌17938(L.reuteri17938)治療兒童各類腹瀉病的療效的研究中發現羅伊氏乳桿菌17938 可縮短腹瀉的持續時間并增加治愈的機會。CHEN 等[17]發現羅伊氏乳桿菌可顯著預防仔豬大腸桿菌感染引起的腹瀉。目前,動物用益生菌大部分分離于禽類、豬及牛等反芻動物和水產動物的胃腸道內容物或排泄物,還有一部分來源于土壤、海洋等環境和植物、發酵食品[18]。本試驗采用從健康藍狐腸道分離獲得的羅伊氏乳桿菌,研究其對不同類型腹瀉的預防及治療作用,以期為益生菌資源的開發利用提供實驗材料及科學數據。
1 材料與方法
1.1 試驗材料
1.1.1 試驗菌株及制備 羅伊氏乳桿菌Lactobacillus reuteri ZJF036 由本實驗室自健康藍狐腸道中分離、鑒定及保藏;沙門氏菌Salmonella typhimurium ATCC 14028 購于中國微生物菌種保藏中心。
1.1.2 試驗動物 2~4 周齡健康SPF 級雌性SD 大鼠,購自長春生物制品研究所有限責任公司;所有大鼠專人飼養,預飼期7 d,飼喂常規大鼠日糧,自由采食、飲水。
1.2 試驗方法
1.2.1 試驗分組與設計 80 只大鼠隨機分為10 組。具體分為正常對照組(NC)、DSS 誘導的腹瀉對照組(DSSC)、DSS誘導腹瀉治療組(DSS1)和預防組(DSS2)、沙門氏菌腹瀉對照組(STMC)、沙門氏菌腹瀉治療組(STM1)和預防組(STM2)、慶大霉素和頭孢拉定相關性腹瀉對照組(GCC)、乳酸菌對慶大霉素和頭孢拉定相關性腹瀉治療組(GC1)和預防組(GC2)。
DSS 誘導腹瀉方法:將DSS 粉末配置成2% 的DSS溶液[19],自由飲用7 d。沙門氏菌感染誘導腹瀉方法:將沙門氏菌發酵液(1 108CFU/mL)按照每天1 mL/只的用量連續灌胃7 d[20]。抗生素相關性腹瀉誘導方法:慶大霉素(2 mL,8 萬U/支),頭孢拉定膠囊,用無菌生理鹽水配制成質量濃度為62.5 g/L 的抗生素混合液[21]1 mL/只。將羅伊氏乳桿菌ZJF036 發酵液(1 108CFU/mL)按照每天1 mL/只的用量連續灌胃進行治療或預防。具體試驗設計見圖1。
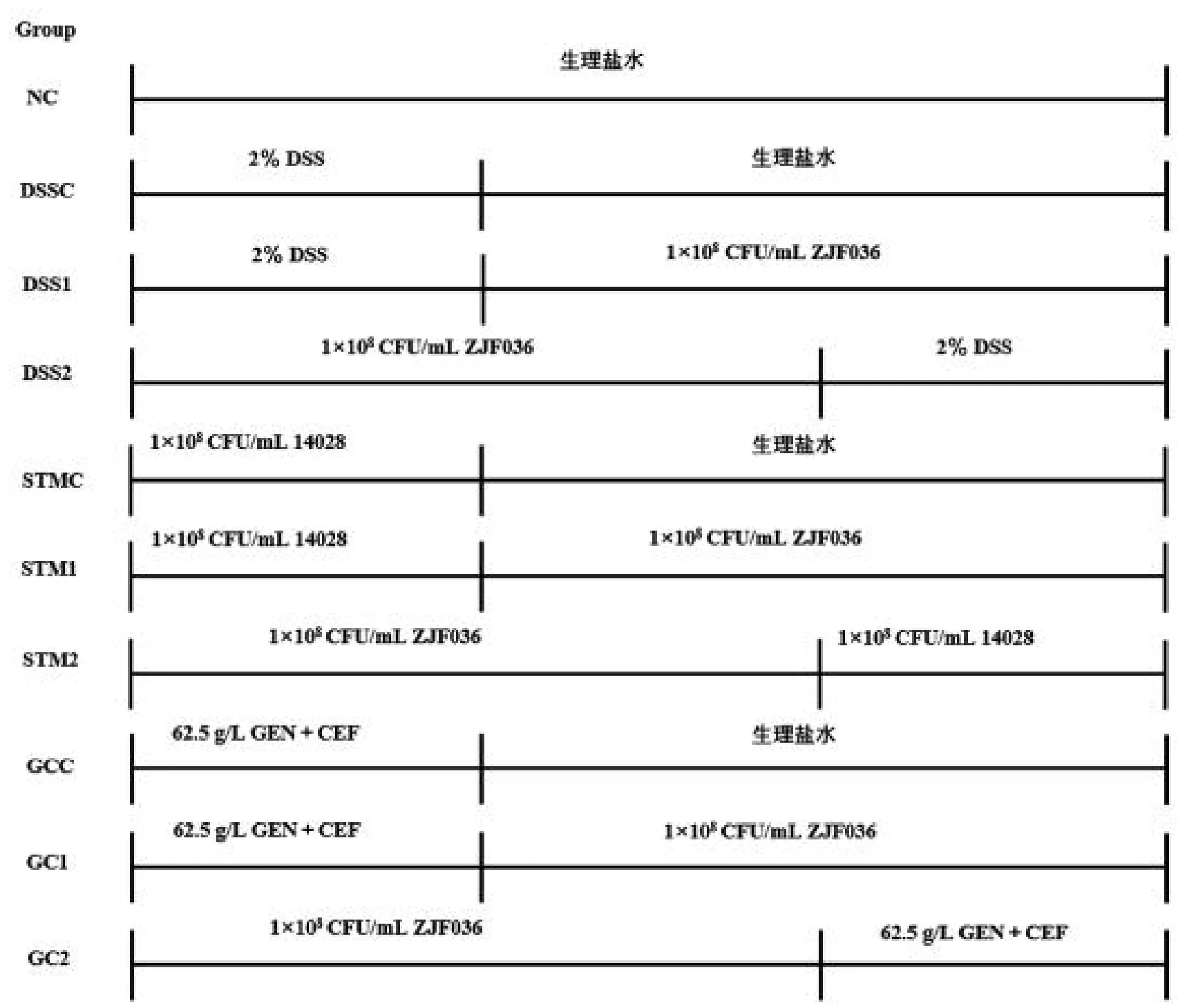
圖1 大鼠分組及灌胃情況Fig.1 Grouping and gavage of rats
1.2.2 總增重 試驗周期為21 d,分別于試驗第0 d、7 d、14 d 和21 d 對所有試驗大鼠進行稱重,觀察比較不同組大鼠的生長情況,繪制總增重圖。
1.2.3 試驗動物處理及樣品采集 試驗結束,將全部試驗大鼠戊巴比妥鈉麻醉,眼球采血后頸椎脫臼處死[22]。采集的血液用于酶聯免疫吸附法(enzyme linked immunosorbent assay,簡寫ELISA)測定血清中細胞因子水平。
1.2.4 血清中細胞因子水平的測定 促凝采血管收集的血液樣本,離心(3 000 r/min、10 min、4 ℃)后收集血清,80 ℃保存備用。采用ELISA 法根據酶聯生物科技有限公司生產的ELISA 試劑盒說明書中的操作步驟測定大鼠血清中IL-2、IL-4、IL-10、IL-12與TNF- 水平。
1.3 數據統計與分析
本試驗所得數據使用Microsoft Excel 2019 進行整理后采用SAS中的單因素方差分析(one-way ANOVA)檢驗差異顯著性,試驗結果用平均值(Mean)±標準誤(SEM)來表示,其中P <0.05 為有統計學意義的顯著性差異,同時用GraphPad Prism 8 進行繪圖。
2 結果與分析
2.1 羅伊氏乳桿菌對各組大鼠總增重的影響
如圖2 所示,圖2 A 為DSS 處理各組0~21 d 大鼠總增重情況,與DSSC 組相比DSS2 組總增重顯著增高(P <0.05)。圖2 B 為沙門氏菌處理各組0~21 d大鼠總增重情況,與STMC 組相比STM1、STM2 組大鼠總增重顯著增加(P <0.05);圖2 C 為GEN +CE 處理各組0~21 d 大鼠總增重情況,GC1 和GC2組大鼠總增重與GCC 組相比沒有顯著差異。說明羅伊氏乳桿菌灌服后對沙門氏菌感染以及DSS 誘導的大鼠體重下降有一定的抑制作用,并且預防作用要大于治療作用。
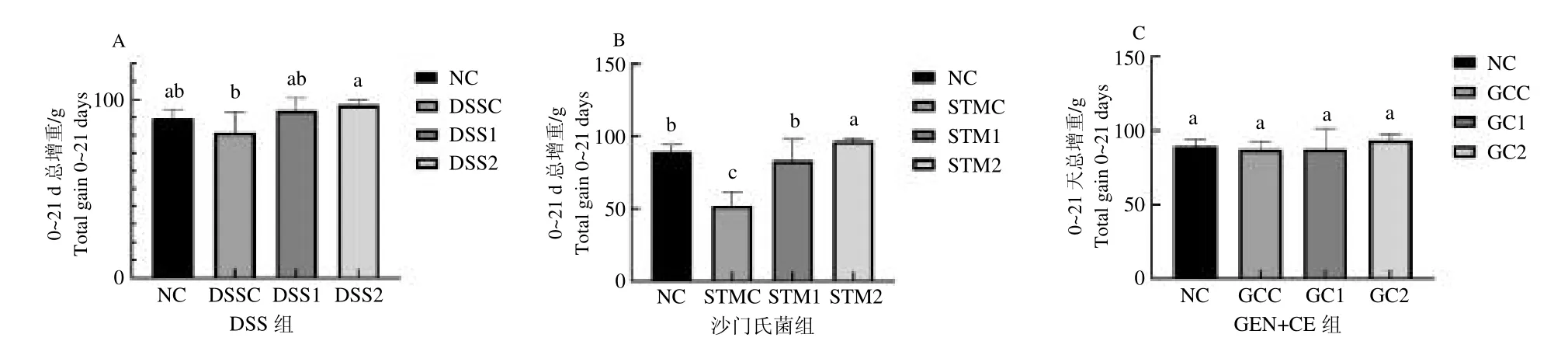
圖2 各組大鼠0~21 d 總增重Fig.2 Weight gain of rats in 0-21 days
2.2 羅伊氏乳桿菌DSS誘導腹瀉大鼠血清免疫學指標的影響
采用ELISA 試劑盒對各組大鼠血清中的IL-2、IL-4、IL-10、IL-12 和TNF- 5 個細胞因子水平進行測定。DSS 組測定結果如下圖3,與DSSC 組相比,DSS2組大鼠血清中IL-2、TNF- 和IL-4 的水平顯著降低(P <0.05),DSS1 組大鼠血清中IL-12、TNF- 的水平顯著降低(P <0.05)。
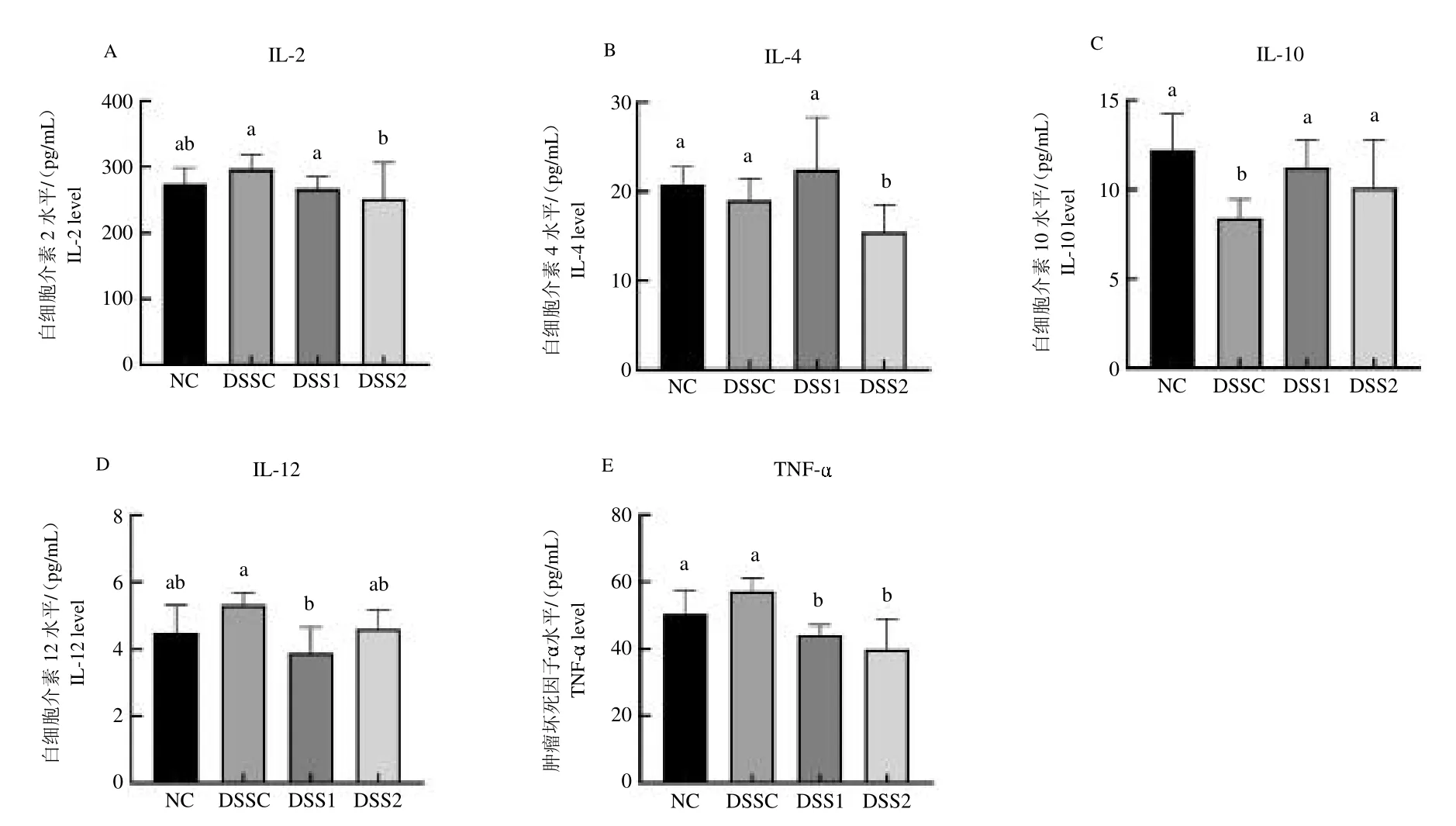
圖3 DSS 組大鼠血清中(A)IL-2、(B)IL-4、(C)IL-10、(D)IL-12 和(E)TNF- 的水平Fig.3 The levels of(A)IL-2,(B)IL-4,(C)IL-10,(D)IL-12 and(E)TNF- in serum of rats in DSS group
2.3 羅伊氏乳桿菌沙門氏菌誘導腹瀉大鼠血清免疫學指標的影響
沙門氏菌組測定結果如下圖4,與STMC組相比,STM1 組大鼠血清中IL-2、IL-4、IL-12 和TNF- 的水平顯著降低(P <0.05),STM2 組大鼠血清中IL-12的水平顯著降低(P <0.05)。
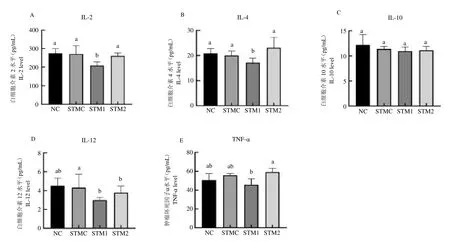
圖4 沙門氏菌組大鼠血清中(A)IL-2、(B)IL-4、(C)IL-10、(D)IL-12 和(E)TNF- 的水平Fig.4 The levels of(A)IL-2,(B)IL-4,(C)IL-10,(D)IL-12 and(E)TNF- in serum of rats in salmonella group
2.4 羅伊氏乳桿菌慶大霉素+頭孢拉定誘導腹瀉大鼠血清免疫學指標的影響
GEN+CE 處理組測定結果如下圖5,與GCC 組相比,GC1、GC2 組大鼠血清中IL-2、IL-12 的水平顯著降低(P <0.05),GC1 組大鼠血清中IL-10 的水平顯著提高。GC1 與GC2 對大鼠血清中IL-4 和TNF-的水平沒有顯著影響。
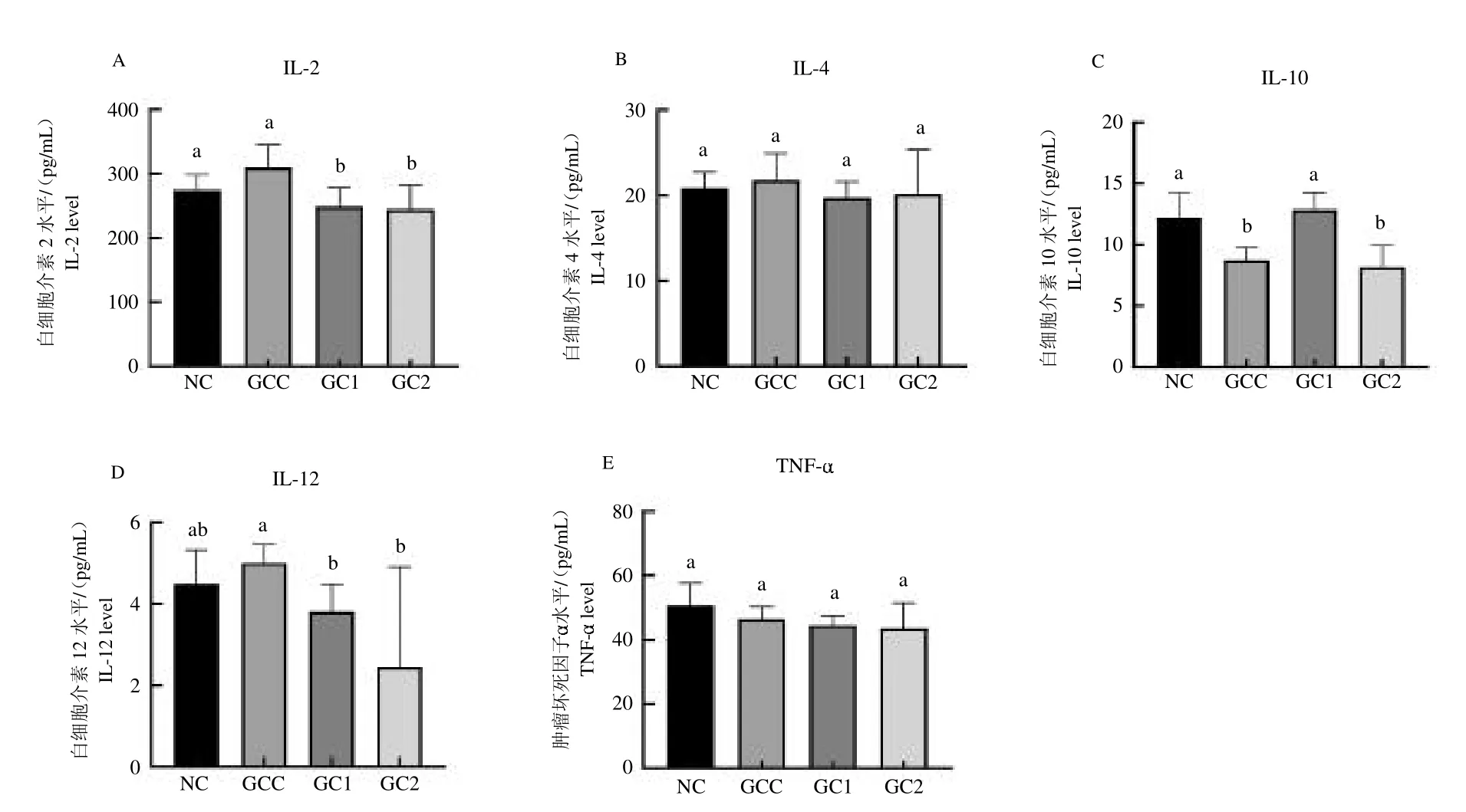
圖5 GEN+CE 組大鼠血清中(A)IL-2、(B)IL-4、(C)IL-10、(D)IL-12 和(E)TNF- 的水平Fig.5 The levels of(A)IL-2,(B)IL-4,(C)IL-10,(D)IL-12 and(E)TNF- in serum of rats in GEN+CE group
3 討論
DSS 常用作誘導潰瘍性結腸炎(Ulcerative colitis,UC)模型,UC 是一種病因不明的直腸和結腸炎性疾病,會導致動物出現血性腹瀉、體重減輕、精神沉郁及被毛雜亂等癥狀[23]。潰瘍性結腸炎導致的長期腹瀉可引起水電解質紊亂和酸堿平衡失調,影響動物對營養物質的消化吸收,從而使體重減輕。目前益生菌制劑常用于各類腹瀉或腸炎的輔助治療。益生菌的調節機制也是多因素的,包括調節免疫功能、調節腸道屏障功能及調節宿主 微生物穩態等。本實驗室在前期的研究中發現羅伊氏乳桿菌ZJF036 具有良好的益生作用,如耐酸、耐膽鹽、耐人工胃腸液、對腸上皮細胞有較好的黏附能力以及對大腸桿菌和沙門氏菌等致病菌的體外抑制作用等[24]。當機體受到外界刺激時會調節促炎細胞因子的增加,同時激發機體的免疫,調節抗炎因子的分泌,進而維持機體的穩態。目前已發現與UC 疾病相關的細胞因子涉及白細胞介素、腫瘤壞死因子和干擾素等[25]。IL-2 是一種控制T 細胞增殖和分化、維持Treg 細胞和NK 細胞激活的免疫調節細胞因子[26]。研究表明敲除小鼠IL-2 基因后可引起小鼠IBD 說明IL-2 在鼠腸炎中起重要作用同時對腸道免疫穩態有調節作用[27],IL-2 還可誘導2 型淋巴細胞產生抗炎因子10[28]。IL-4、IL-10 具有免疫調節作用,主要是由Th2細胞產生,并且可以抑制中性粒細胞的趨化作用,下調促炎因子的表達和分泌,減輕組織損傷程度,抑制炎癥的發展進程[29]。腫瘤壞死因子 是一種主要由巨噬細胞和單核細胞產生的促炎細胞因子,并參與正常炎癥反應和免疫反應,能通過刺激中性粒細胞和巨噬細胞進而加速細胞的增殖,促進單核細胞等分泌炎性細胞因子進而導致腸道組織受損[30]。在本研究中,探究了羅伊氏乳桿菌ZJF036 在DSS 誘導大鼠腹瀉中的作用。結果顯示羅伊氏乳桿菌ZJF036 預防處理DSS 誘導的腹瀉大鼠可顯著緩解大鼠體重下降,說明羅伊氏乳桿菌ZJF036 預防處理可減輕DSS 引起的腸道炎癥,這與鄭雨星[31]研究結果一致。這一結果可能與羅伊氏乳桿菌參與對腸道屏障功能的維護及改善了造模引起的腸道菌群多樣性降低有關。本試驗還發現與DSS 對照組相比羅伊氏乳桿菌預防處理和治療處理分別顯著降低了DSS 誘導的腹瀉大鼠血清中IL-2 和IL-12 的水平,且顯著降低了TNF- 的水平,提高了大鼠血清中IL-10 的水平,說明經羅伊氏乳桿菌ZJF036可減少炎癥因子的生成在調節和維持腸道免疫穩態方面有一定的作用。
沙門氏菌是禽類養殖中常見的致病菌,該菌可通過口服被污染的食物和水源等獲得,可在多種動物宿主中引起腸炎、腹瀉、發熱及生長性能低下等。益生菌是一種替代抗生素的添加劑,用于防止或減少養殖中病原體的感染。據報道,許多乳酸桿菌產生的物質具有抗沙門氏菌的抗菌活性[32]。羅伊氏乳桿菌ZJF036 預防處理和治療處理沙門氏菌感染的腹瀉大鼠,可顯著緩解大鼠體重下降,并且預防組大鼠體重增重顯著高于正常對照組,說明預防的效果要好于治療的效果。M.NAKPHAICHI等[33]和石水琴[34]研究表明羅伊氏乳桿菌能穩定定植在雞腸道內同時降低腸道pH,從而顯著降低沙門氏菌在雞腸道內的定植和復制。沙門氏菌穿過腸道屏障后被宿主巨噬細胞吞噬,其在體內的感染涉及Th1 誘導的細胞因子,這些細胞因子中IFN- 是較強大的防御之一,而IL-12 能誘導其產生[35]。羅伊氏乳桿菌預防處理和治療處理沙門氏菌感染的腹瀉大鼠都顯著降低了血清中促炎細胞因子IL-2、IL-12 及TNF- 的水平,增加了抗炎細胞因子IL-4 的水平,提示大鼠腸道免疫穩態的恢復。石水琴[34]研究結果表明,羅伊氏乳桿菌在雞消化系統的各個腸段內均有定殖,主要位于結腸和盲腸,并且可促進雞腸道屏障的緊密連接和腸上皮細胞的完整性,改善腸道屏障功能。
抗生素相關性腹瀉是抗生素使用的常見并發癥,可破壞腸道菌群平衡,輕度表現在排便次數及糞便形態上的變化,重度則是由艱難梭菌、金黃色葡萄球菌等致病菌的大量繁殖引起的假膜性結腸炎、胃腸功能衰竭等臨床表現[36]。本試驗結果羅伊氏乳桿菌ZJF036對GEN+CE 誘導的腹瀉大鼠體重沒有顯著的影響。與GEN+CE 對照組相比,羅伊氏乳桿菌預防處理和治療處理都顯著降低了大鼠血清中IL-2、IL-12和TNF-的水平。說明羅伊氏乳桿菌的治療處理和預防處理都能顯著緩解GEN+CE 誘導的大鼠抗生素相關性腹瀉程度并提高IL-10 水平和降低IL-2、IL-12 和TNF-的水平來改善腸道炎癥情況及黏膜屏障的功能,在大鼠腹瀉過程中起到保護作用。Lorenzo Drago 等[37]發現羅伊氏乳桿菌LRE02 與鼠李糖乳桿菌LR04 兩種益生菌的混合物計量為每天1.2 109CFU 持續30 d可以降低兒童(1 月至18 歲)AAD 的發生率、腹瀉天數改善糞便性狀。M.KOLODZIEJ[38]的研究在隨機、雙盲及安慰劑對照實驗中,沒有發現108CFU/mL 的羅伊氏乳桿菌對口服或者靜脈注射抗生素治療的18 歲以下兒童腹瀉有效。所以推測羅伊氏乳桿菌ZJF036 對慶大霉素和頭孢拉定誘導的腹瀉大鼠總增重沒有顯著的作用可能與益生菌使用劑量、菌種來源、菌株特異性和持續時間等差異有關[36]。其對于抗生素相關性腹瀉的影響及機制未來還需進一步研究。
4 結論
綜上所述,藍狐源羅伊氏乳桿菌ZJF036 對潰瘍性結腸炎引起的腹瀉、沙門氏菌感染引起的腹瀉和抗生素相關性腹瀉有一定的防治效果,能緩解由不同原因引起的大鼠腸道炎癥、調節抗炎細胞因子和促炎細胞因子水平從而維持腸道免疫穩態。

