基于甘蔗糖蜜的黑曲霉產β-Ffase酶的單因素條件研究
雷光鴻,樊紅日,李 元,陳 亮,李莉嬌,尹 麗*
(1廣西工業職業技術學院輕工化工學院,廣西南寧 530003;2廣西大學輕工與食品工程學院,廣西南寧 530004)
0 引言
低聚果糖(FOS)合成過程中的關鍵酶是β-呋喃果糖苷酶(β-Ffase),葡萄糖和果糖分子的同時存在,調控好該過程中主要的底物分子蔗糖的濃度,將有助于酶將其聚合生成低聚果糖,在提高轉化效率的情況下,促進了產物FOS的產生[1]。目前有關微生物催化生產低聚果糖的相關報道較少,Shin等[2]在研究利用蔗糖生產低聚果糖之后,評估3種不同的金黃色葡萄球菌菌株使用糖蜜作為蔗糖等效物生產低聚果糖的能力,并且在55℃和pH 5.5條件下培育24 h后實現了FOS的生產,但是FOS的產率低。黑曲霉具有良好的特性,本文研究了黑曲霉菌株的不同發酵條件(糖蜜添加量、氮源、孢子接種量、溫度和pH等單因素條件)對黑曲霉菌株產β-Ffase酶酶活和菌絲體濃度(DCW)的影響,得到利用糖蜜產β-Ffase酶的優化條件。
1 材料與方法
1.1 菌株與原料
黑曲霉Aspergillus niger,編號:ATCC 20611,下簡稱黑曲霉,凍干管保藏菌種,購于美國模式培養物集存庫(American Type Culture Collection);甘蔗糖蜜:由廣西南寧糖業股份有限公司明陽糖廠提供。
1.2 試驗方法
1.2.1 培養基的配制
YM培養基:麥芽糖提取物3.0 g/L,葡萄糖10.0 g/L,酵母提取物3.0 g/L,蛋白胨5.0 g/L,115℃滅菌30 min,作為黑曲霉活化(種子)培養基。
FM培養基:蔗糖20.0 g/L,酵母提取物15.0 g/L,MgSO4·7H2O 0.5 g/L,KCl 0.5 g/L,NaNO32.0 g/L,K2HPO45.0 g/L,用0.1 mol/L HCl調pH至5.5,121℃滅菌20 min,作為黑曲霉發酵產酶培養基。
1.2.2 黑曲霉菌絲體的制備
先將黑曲霉ATCC 20611菌株經YM培養基活化,在通過發酵培養基誘導產酶后,分離出成熟的菌絲體并將其保存在檸檬酸-磷酸氫二鈉緩沖液中。
1.2.3 黑曲霉菌絲體酶活的測定
β-Ffase酶活的測定:1 U的β-Ffase定義為1 min酶催化蔗糖反應產生1 μmol的還原糖所需的酶量,參考Dorta等[3]的酶活測定方法并加以修改后具體如下:配制4 mL 25%的蔗糖溶液和6 mL pH 5.0的檸檬酸磷酸氫二鈉緩沖液,混合,加入0.04 g黑曲霉菌體后,50℃條件下水浴震蕩反應2 h后置于電爐上后加熱沸騰10 min使酶失活。加入1 mL上述稀釋適當倍數的上清液于25 mL的酶標管中,隨后加入2 mL DNS試劑,置于沸水浴中計時2 min后,迅速放置于冰水中冷卻,最后在酶標管中加入超純水至25 mL,于540 nm波長下測定樣品對的吸光值。根據制備的DNS標準曲線代入計算出菌絲體酶活。
1.2.4 DCW的測定
使用干重法測定發酵液菌絲體濃度。分別將離心管置于烘箱中烘干至恒重,隨后置于干燥器中冷卻至室溫后稱重(X1),黑曲霉發酵過程中每間隔12 h取5 mL發酵液樣品于上述已經烘干處理后的離心管中,在7000 r/min的條件下離心10 min,棄上清液,加入10 mL生理鹽水振蕩混勻,隨后同樣在7000 r/min的條件下離心10 min后倒掉上清液,重復該步驟1次。隨后將帶有菌絲體沉淀的離心管置于烘箱烘干至恒重,再稱重(X2),每個樣品進行3次平行測定后取平均值。
式(1)中,DCW為β-Ffase酶菌絲體濃度,g/L;X2為干燥至恒重后菌絲體和離心管的總質量,g;X1為干燥至恒重后離心管的質量,g;V為發酵液體積,mL。
1.2.5 糖蜜預處理方法
量取500 mL糖蜜于燒杯中,以1∶1將糖蜜與蒸餾水在2 L大燒杯中混合,將2 mmol/L EDTA溶液加入甘蔗糖蜜溶液中,靜置12 h,取上清液,在上清液中加入適量的活性炭(1.5% w/v),脫色,12000 r/min離心15 min,取上清液。
1.2.6 黑曲霉發酵產酶條件優化
根據參考文獻[3-4]提供的培養條件,預處理后糖蜜添加量10%,氮源酵母粉添加量10 g/L,孢子接種量7.5 %,培養基pH 6.0,發酵溫度35℃,200 r/min條件下培養48 h,β-Ffase酶活289.17 U/mL,細胞干重7.95 g/L。在此基礎上,將新鮮的黑曲霉孢子接種于糖蜜發酵培養基中,進行培養基的優化,考察不同條件單因素對黑曲霉菌株產β-Ffase酶酶活和DCW的影響。
2 結果與分析
2.1 糖蜜添加量對菌株產β-Ffase的影響
預處理后的糖蜜,極大程度上保留甘蔗糖蜜中蔗糖含量,有效地除去了原糖蜜中膠體灰分等不利于微生物生長產酶的有害成分,另外,糖蜜本身就含有豐富的營養物質,生物素含量也很可觀,是很好的發酵原料,可作為黑曲霉菌絲體發酵生長和產酶的發酵原料(廉價碳源替代品)。本研究進一步選取2.5%、5%、10%、15%和20%糖蜜添加量分析β-Ffase酶活和菌絲體DCW,將新鮮的黑曲霉孢子接種于糖蜜發酵培養基中,孢子接種量7.5%,氮源(酵母粉)添加量為10 g/L,培養基pH 6.0,發酵溫度35℃,200 r/min條件下培養48 h,考察不同糖蜜添加量對黑曲霉發酵產酶及菌株生長的影響。實驗結果由圖1所示。
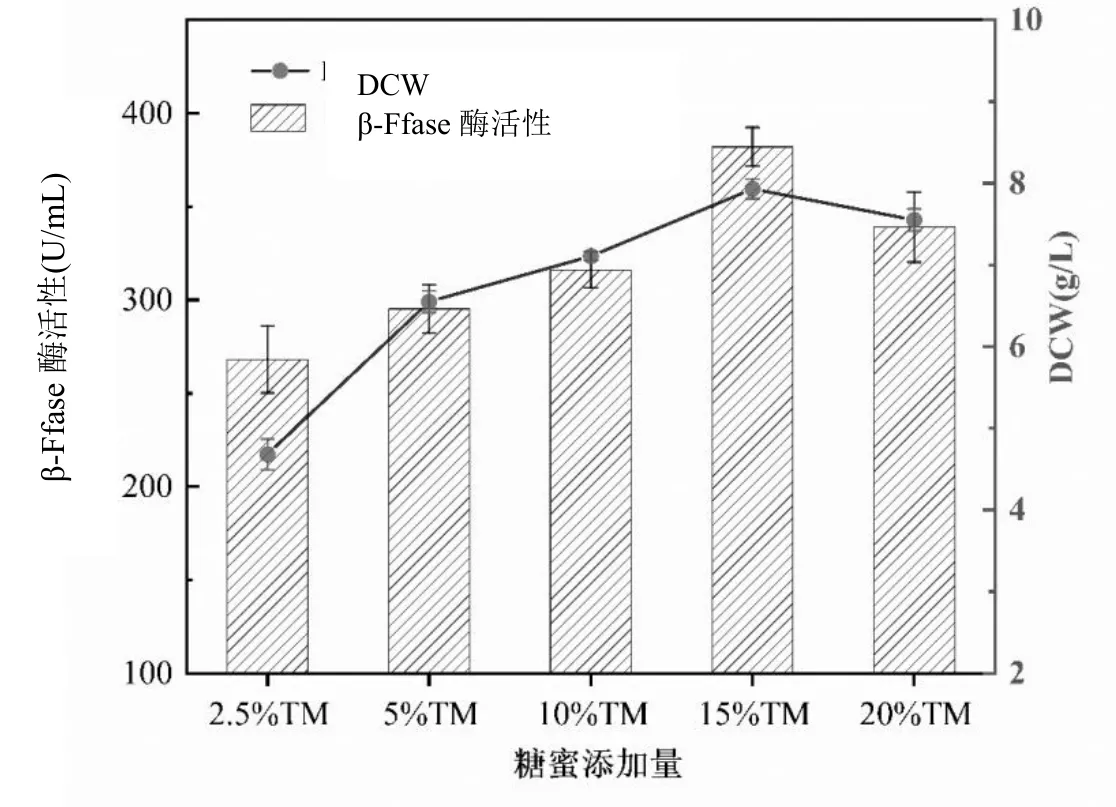
圖1 糖蜜添加量對黑曲霉菌株生長和產酶的影響
由圖1可知,不同糖蜜添加量對黑曲霉菌株產酶活性和菌絲體干重的影響呈現先上升后下降的趨勢。當糖蜜添加量由2.5%增加到15%時,β-Ffase酶活由268.10 U/mL增長到382.01 U/mL;菌絲體DCW由4.68 g/L增長到7.93 g/L,該階段黑曲霉菌株不斷利用糖蜜中的營養成分,生長旺盛的同時持續產酶,糖蜜培養基可有效提高菌株的生長量和產酶效果,而當糖蜜添加量繼續增大達到20%時,過多的糖蜜添加對菌絲體生長和產酶情況產生抑制作用,菌絲體酶活和DCW分別下降到338.86 U/mL和7.55 g/L,此后糖蜜量的增加不利于黑曲霉菌株生長和產酶。綜合考慮,以15%糖蜜添加量作為發酵培養基中的碳源,更適合黑曲霉菌株的糖蜜發酵生長,用于后續實驗。
2.2 溫度對菌株產β-Ffase的影響
黑曲霉對發酵溫度較敏感,之前有關黑曲霉菌株研究表明[5],黑曲霉菌株適合在25℃之間的環境下發酵生長產酶。當發酵培養溫度過高或過低時,菌株代謝活性都會受到影響,從而抑制黑曲霉菌株的生長和酶的合成分泌。因此,為了使得菌株生長旺盛并獲得較高的β-Ffase酶活性,需要探究黑曲霉菌株在糖蜜條件下生長的合適溫度。實驗以20℃、25℃、30℃、35℃和40℃來分析β-Ffase酶活和菌絲體DCW,將新鮮的黑曲霉孢子接種于糖蜜發酵培養基中,糖蜜添加量15%,氮源(酵母粉)添加量為10 g/L,孢子接種量7.5%,培養基pH 6.0,200 r/min條件下培養48 h,考察不同溫度對黑曲霉發酵產酶及菌株生長的影響。實驗結果如圖2所示。
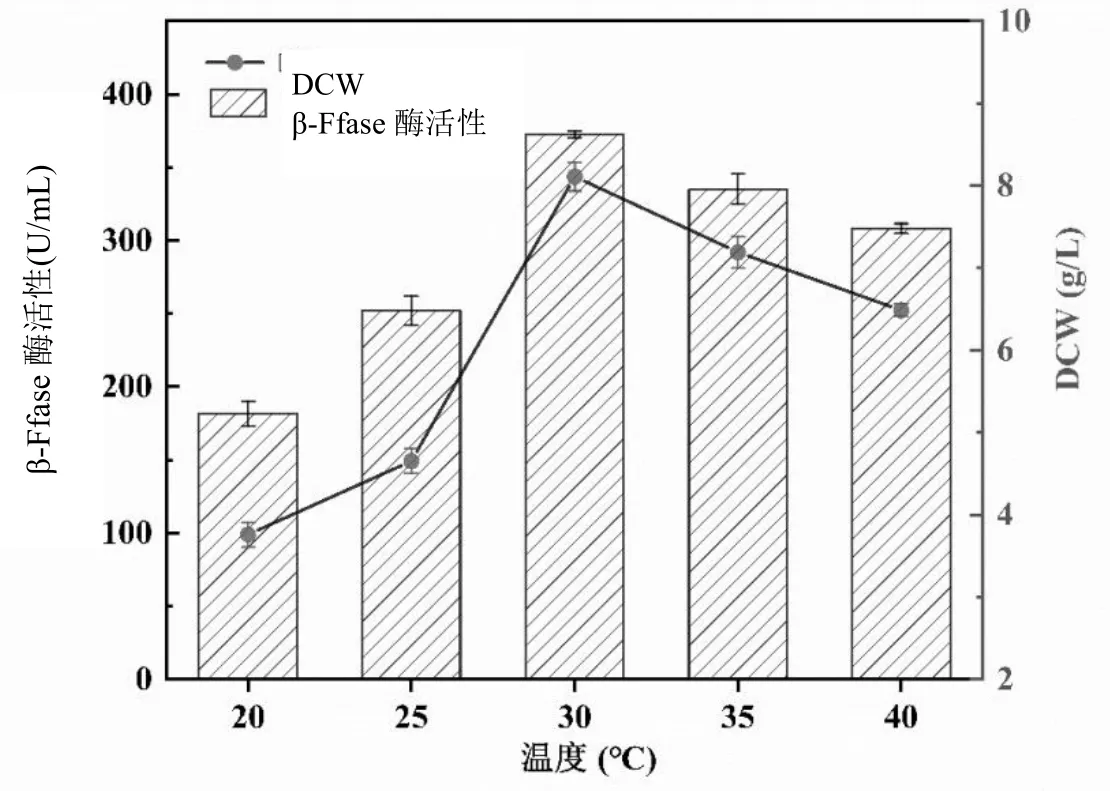
圖2 溫度對黑曲霉菌株生長和產酶的影響
從圖2可知,隨著溫度的升高,黑曲霉菌絲體的DCW和β-Ffase酶活呈先升高再降低的趨勢,由20℃上升到30℃之前,β-Ffase酶活和DCW隨著溫度的升高而增加,發酵溫度為30℃時,黑曲霉菌株產酶活性達到最大,β-Ffase酶活為372.43 U/mL,DCW為8.11 g/L;當溫度超過30℃后,黑曲霉菌株的酶活呈現下降趨勢,溫度升高到35℃時,菌株產酶活力有所下降,β-Ffase酶活降至335.18 U/mL;DCW為7.19 g/L,在40℃時,β-Ffase酶活只有308.15 U/mL,DCW為6.49 g/L。溫度過高,酶的產生受到抑制,黑曲霉菌株生物量減少,β-Ffase酶活力降低,影響發酵周期及產酶效率。由此,選定30℃為黑曲霉菌株在糖蜜發酵條件下最適的產酶溫度較為合適。
2.3 pH值對菌株產β-Ffase的影響
pH值是影響黑曲霉生長和代謝活性的重要因素之一,且黑曲霉菌株所分泌的果糖基轉移酶多為酸性酶(pH 5.0左右),pH值通過影響甘蔗糖蜜培養環境下,菌絲體對有效成分溶解后利用進程,發酵過程中的氧化還原反應和β-Ffase酶活性,對菌絲體生長和酶的積累有較大影響[6]。以pH 4.0、4.5、5.0、5.5、6.0、6.5和7.0分析β-Ffase酶活和菌絲體DCW,將新鮮的黑曲霉孢子接種于糖蜜發酵培養基中,糖蜜添加量15%,氮源(酵母粉)添加量為10 g/L,孢子接種量7.5%,發酵溫度30℃,200 r/min條件下培養48 h,考察不同pH值對黑曲霉發酵產酶及菌株生長的影響。實驗結果如圖3所示。
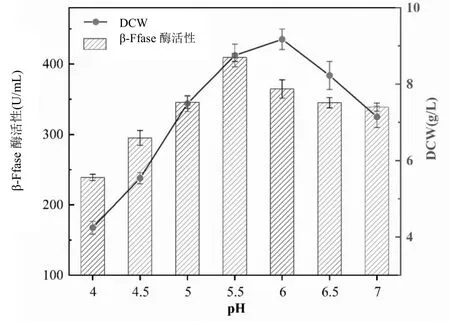
圖3 pH對黑曲霉菌株生長和產酶的影響
由圖3可見,糖蜜培養基中pH值對黑曲霉菌株生長和產酶有較大影響,在初始pH值由4不斷增大的過程中,DCW和β-Ffase酶活呈現增加的趨勢;當pH值為5.5時,β-Ffase酶活達到最大值,為409.30 U/mL,此時DCW為8.75 g/L,黑曲霉菌株生長良好,菌絲體適應在此偏酸性環境下繁殖和產酶;而隨著pH值繼續增加,pH值為6.0時菌株產酶活力有所下降,β-Ffase酶活降至364.60 U/mL,此時DCW為9.17 g/L;當pH值6.5時,β-Ffase酶活降至345.02 U/mL,此時DCW為8.23 g/L。糖蜜培養基環境中的氫離子濃度調節微生物的增殖和酶的合成,在中性至堿性環境下會分散質膜抑制酶活性和膜轉運蛋白,抑制黑曲霉菌絲體生長和產酶[7],由此,黑曲霉菌株在糖蜜培養基中最適合的生長產酶pH值為5.5。
2.4 氮源對菌株產β-Ffase的影響
以5、10、15、20和25 g/L酵母粉添加量分析β-Ffase酶活和菌絲體DCW,將新鮮的黑曲霉孢子接種于糖蜜發酵培養基中,糖蜜添加量15%,孢子接種量7.5%,培養基pH 5.5,發酵溫度30℃,200 r/min條件下培養48 h,考察酵母粉(氮源)添加量對黑曲霉發酵產酶及菌株生長的影響。實驗結果如圖4所示。
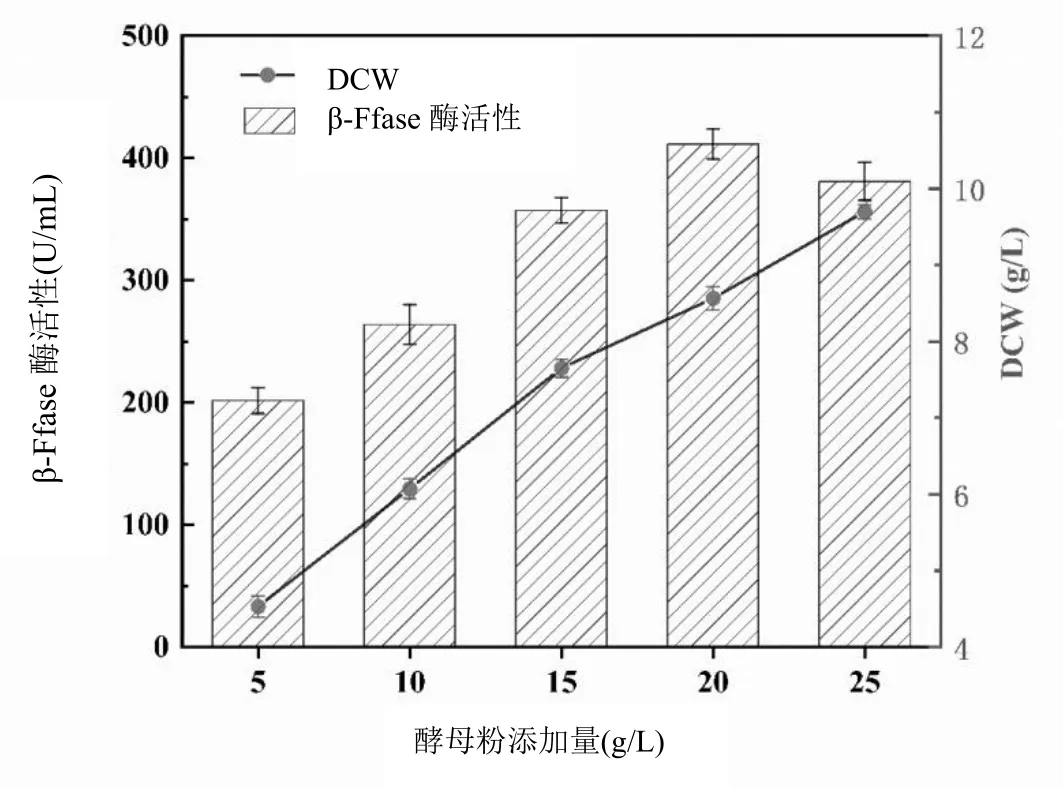
圖4 酵母粉添加量對黑曲霉菌株生長和產酶的影響
從圖4可知,隨著酵母粉添加量增加,菌絲體酶活呈現上升趨勢,當酵母粉的添加量為20 g/L時,β-Ffase酶活力最大,達到411.48 U/mL,菌絲體生長良好,DCW達到8.56 g/L。當酵母粉添加量達到25 g/L時,其菌絲體進一步生長,DCW達到9.69 g/L,而此時β-Ffase酶活卻下降,為380.99 U/mL,過量的氮和磷可能導致菌株的快速生長但不利于細胞產酶,限制了β-Ffase酶活力[8]。菌絲過度生長,培養基中營養物質多用于其他生命活動而產酶量減少,酶活性開始下降,由此確定最適的酵母粉添加量為20 g/L。
2.5 孢子接種量對菌株產β-Ffase的影響
以2.5%、5%、7.5%、10%、12.5%和15%孢子接種量分析β-Ffase酶活和菌絲體DCW,將新鮮的黑曲霉孢子接種于糖蜜發酵培養基中,糖蜜添加量15%,氮源(酵母粉)添加量為20 g/L,培養基pH 5.5,發酵溫度30℃,200 r/min條件下培養48 h,考察不同接種量對黑曲霉發酵產酶及菌株生長的影響。實驗結果如圖5所示。

圖5 孢子接種量對黑曲霉菌株生長產酶的影響
由圖5可見當孢子接種量由2.5%增長到10%時,黑曲霉菌株的β-Ffase酶活和DCW均呈現上升趨勢,該階段菌絲體生物量處于增長時期,且黑曲霉菌株生物量過少而不能有效的利用糖蜜發酵液中的營養成分,使得發酵周期滯后,不利于菌株分泌β-Ffase酶,從而影響了黑曲霉發酵甘蔗糖蜜的效率和產酶效果,因此需進一步增大接種量,黑曲霉菌株在短時間內快速繁殖且產酶活性良好的效果[9]。
當孢子接種量達到10% 時,β-Ffase酶活達到最高為414.82 U/mL,菌絲體DCW達到8.45 g/L。此后,接種量繼續增加時,β-Ffase酶活性出現下降趨勢,菌絲體卻在進一步生長。當接種量為12.5%時,β-Ffase酶活為386.67 U/mL,DCW達到9.23 g/L;因為孢子接種量過大,黑曲霉菌絲體迅速生長繁殖,糖蜜發酵液粘度增大而溶氧量不夠,不利于黑曲霉菌株分泌β-Ffase,菌株產酶受抑制;當接種量為15%時,菌株已過量生長,糖蜜中的營養物質大量消耗,菌絲體生長受限,β-Ffase酶活降至371.27 U/mL,DCW為8.91 g/L;這與前人研究黑曲霉的生長和產酶曲線隨著時間的推移,菌絲體的生長和產酶效率所呈現先增加而后減少的趨勢相一致[6]。因此,選取10%接種量作為黑曲霉產酶的最適孢子接種量,更利于黑曲霉菌株在糖蜜條件下生長和產酶。
3 討論與結論
實驗結果表明,黑曲霉菌株產β-Ffase酶的優化發酵條件為:采用預處理的甘蔗糖蜜,添加量為15%、有機氮源酵母粉20 g/L、pH 5.5、孢子接種量10%、溫度30℃;進一步加入0.3%表面活性劑吐溫-80,促進β-Ffase酶活性的表達;在優化條件下連續培養黑曲霉,菌株生長和產酶情況如圖6所示,菌株在此條件下生長良好。培養48 h后,與文獻[3-4]提供的培養基條件相比較,β-Ffase酶活達到463.87 U/mL,提高了1.6倍,菌絲體DCW為11.77 g/L,提高了1.48倍,提高菌株產酶活性和促進菌株生長的效果。
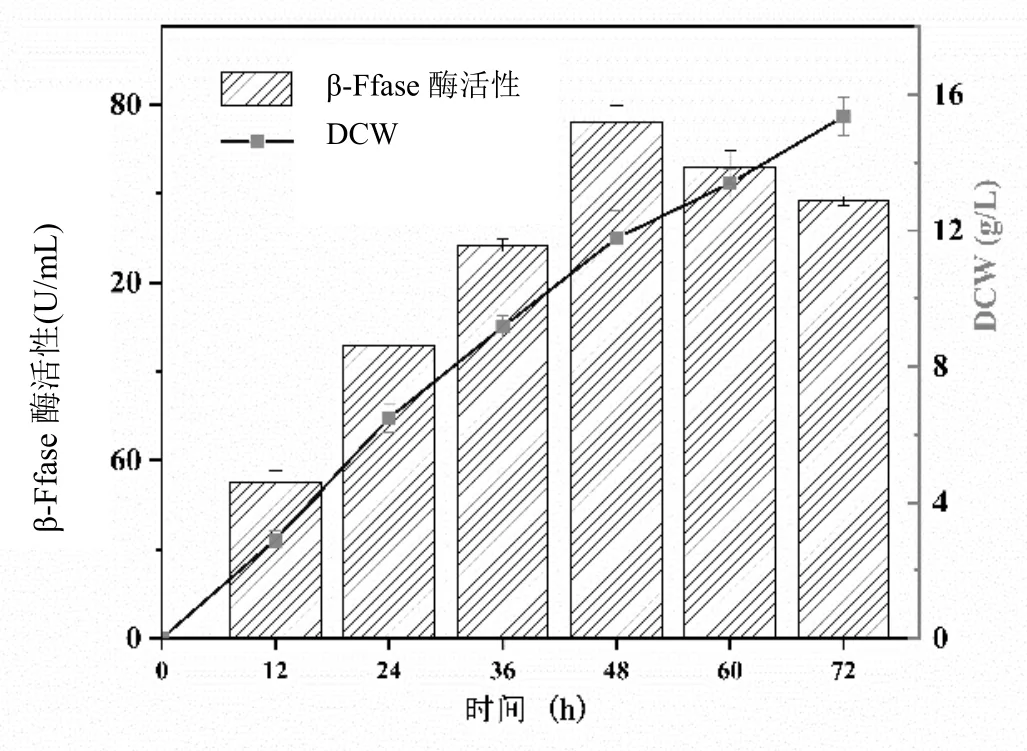
圖6 糖蜜培養基優化條件下的發酵過程
本研究提出黑曲霉菌株產β-Ffase酶的發酵條件,這將有助于探究甘蔗糖蜜發酵生產低聚果糖,促進其工業化利用。研究發現具有高β-Ffase酶活性的黑曲霉菌株能夠催化甘蔗糖蜜,高效地轉化為FOS,該過程避免了昂貴的酶純化程序的需要[10]。糖蜜作為催化底物,整個黑曲霉菌絲體作為生物催化劑,能大大降低工業上生產FOS的生產成本。因此,本研究中開發的用于FOS生產的黑曲霉菌株和生物工藝在FOS食品和飼料添加劑等生產中具有很高的應用潛力。

