水稻苗床α 萘乙酸藥害的生物修復
鄭晨曦 程鵬 丁偉
摘要
α萘乙酸廣泛用于水稻秧田調節根系生長,常因用量控制不當造成水稻根系畸形,生長被抑制,地上部葉片變黃等藥害大面積發生。從連續定量施用α萘乙酸的土壤中分離獲得6株菌株,確定其中2株菌株對α萘乙酸藥害具有明顯修復作用,經細菌16S?rDNA和真菌?rDNAITS鑒定,細菌1號為芽胞桿菌Bacillus?sp.,真菌2號為籃狀菌Talaromyces?sp.。細菌1號和真菌2號菌劑施用后21?d,對苗床土壤中α萘乙酸的降解率分別為56.15%和38.06%;細菌1號處理下,水稻4葉期株高、莖基部寬度、須根數及根系干重分別恢復至對照的84.1%、86.1%、97.7%和84.5%,葉片SOD和POD活性分別顯著提高36.4%和66.8%,MDA含量明顯降低20.5%;真菌2號處理下,水稻4葉期,株高、莖基部寬度、須根數及根系干物質分別恢復至對照的77.7%、81.6%、92.5%和80.4%。葉片SOD和POD活性分別提高11.1%和74.4%,MDA含量顯著降低10.6%。綜上,細菌1號和真菌2號對水稻苗床α萘乙酸藥害具有顯著修復效果。
關鍵詞
水稻;?α萘乙酸;?藥害;?降解;?生物修復
中圖分類號:
S?482.84;?S?481.8
文獻標識碼:?A
DOI:?10.16688/j.zwbh.2022084
Bioremediation?of?αnaphthylacetic?acid?damage?in?rice?seedbeds
ZHENG?Chenxi1,?CHENG?Peng2,?DING?Wei1*
(1.?College?of?Agriculture,?Northeast?Agricultural?University,?Harbin?150030,?China;
2.?Heilongjiang?Agricultural?Technology?Extension?Station,?Harbin?152500,?China)
Abstract
Alphanaphthalene?acetic?acid?is?widely?used?in?rice?seedling?fields?to?regulate?root?growth,?often?causing?root?deformities,?growth?inhibition?and?aboveground?leaf?yellowing?due?to?improper?dosage?control.?Six?microbial?strains?were?isolated?from?soil?under?continuous?quantitative?application?of?αnaphthylacetic?acid,?and?two?of?them?were?determined?to?have?significant?remediation?effect?on?αnaphthylacetic?acid?damage,?identified?by?16S?rDNA?and?rDNAITS?as?Bacillus?sp.?(Bacteria?1)?and?Talaromyces?sp.?(Fungus?2).?The?degradation?rate?of?αnaphthylacetic?acid?in?the?soil?of?the?seedbed?by?Bacteria?1?and?Fungus?2?was?56.15%?and?38.06%?21?days?after?applications,?respectively.?The?plant?height,?stem?basal?width,?fibrous?root?number?and?root?dry?weight?of?rice?at?the?4leaf?stage?recovered?to?84.1%,?86.1%,?97.7%?and?84.5%?of?the?control?under?Bacterial?1?treatment,?and?leaf?SOD?and?POD?activity?were?significantly?increased?by?36.4%?and?66.8%,?and?the?MDA?content?was?obviously?reduced?by?20.5%.?At?the?4leaf?stage?of?rice?under?Fungus?2?treatment,?plant?height,?stem?basal?width,?number?of?fibrous?roots?and?root?dry?matter?recovered?to?77.7%,?81.6%,?92.5%?and?80.4%?of?the?control,?respectively.?Leaf?SOD?and?POD?activities?were?increased?by?11.1%?and?74.4%,?respectively,?and?MDA?content?was?significantly?reduced?by?10.6%.?It?suggested?that?Bacteria?1?and?Fungus?2?had?significant?restoration?effect?on?αnaphthalene?acetic?acid?damage?in?rice?seedbeds.
Key?words
rice;?αnaphthylacetic?acid;?drug?damage;?degradation;?bioremediation
20世紀90年代以來,水稻旱育稀植技術在中國水稻產區開始大面積推廣應用。化控劑在促進水稻旱育秧苗根系生長、預防病害和改善水稻生理特性等方面發揮了重要作用[12]。α萘乙酸是一種人工合成的生長素類似物,在促進水稻秧苗根系生長方面發揮著重要的作用。由于其價格低廉,性質穩定,已被廣泛應用于水稻生產[3]。研究表明,α萘乙酸濃度在?0~0.01?mg/L范圍內,水稻根的伸長生長隨濃度增加而加快,不定根數量略有增加;當α萘乙酸濃度超過?0.1?mg/L后,根的伸長生長明顯受到抑制[4]。α萘乙酸應用于樹木扦插時也表現為低促高抑[5]。以?400~500?mg/kg?α萘乙酸溶液浸泡枝條,插條生根率可達到?83%以上;α萘乙酸濃度增加到600?mg/kg時雖然能明顯促進插條基部愈傷組織的形成,但其生根率反而下降。高濃度α萘乙酸處理的插條,由切口向上逐漸變褐、腐爛,只有部分插條能夠生根成活[6]。在水稻生產過程中,農戶對α萘乙酸用量控制不當,未按照說明書要求用量施用,習慣性加大用量來達到壯秧目的,但由于植物生長調節劑與除草劑等農藥不同,屬于超高活性藥劑,低濃度α萘乙酸可促進植物生根,而高濃度α萘乙酸則抑制植物生長[7]。苗床土壤中高濃度α萘乙酸導致秧苗根系畸形、葉片變黃,大部分秧苗因不能正常吸收水分和養分而死亡[8]。因此本研究以α萘乙酸在水稻育秧田中最適濃度的3倍量模擬高劑量α萘乙酸對水稻秧苗產生藥害進行生物修復探究。
農藥施用于植株,僅10%~20%農藥附著在植株上,剩余80%~90%中大部分落入土壤、小部分進入地下水及空氣中,而微生物對水和土壤中的農藥降解起主要作用[9]。α萘乙酸在土壤中的降解方式包括光解、水解和微生物降解[10]。對于殘留于土壤中的α萘乙酸,大多可以通過微生物降解的方式消除。因此,利用微生物降解作用修復其殘留藥害是操作簡便且不會產生二次污染的有效方法。目前國內外科研工作者多是對除草劑殘留的生物降解進行研究[1113],對水稻秧田過量施用α萘乙酸造成藥害的生物修復鮮有報道。本研究采集人跡罕至的林地土壤,室內連續定量添加α萘乙酸進行培養,篩選對α萘乙酸藥害修復效果較好的菌株。
對分離和鑒定的2株可降解α萘乙酸的優勢菌株,以過量施用α萘乙酸的藥害水稻秧苗作為指示植物,測定其對α萘乙酸的降解和對藥害水稻秧苗的修復效果,為解決水稻旱育秧過程中α萘乙酸藥害提供基礎數據。
1?材料與方法
1.1?試驗材料
供試水稻為?‘東富125,種子由東北農業大學農學院水稻育種室提供。供試土樣采自人跡罕至未施用任何農藥的林地內。98%?α萘乙酸粉劑,東北農業大學農學院農藥學科農藥生態安全實驗室提供。
馬丁氏培養基:蛋白胨?5?g,葡萄糖?10?g,磷酸二氫鉀?1?g,硫酸鎂?0.5?g,瓊脂?20?g,1/3?000孟加拉紅溶液?100?mL,蒸餾水定容至1?000?mL,氯霉素?0.1?g。
細菌培養基:牛肉膏?3?g,蛋白胨?10?g,NaCl?5?g,瓊脂?15~25?g,蒸餾水定容至1?000?mL,pH?7.4~7.6。
PDA培養基:馬鈴薯?200?g,葡萄糖?20?g,瓊脂?15~20?g,蒸餾水定容至1?000?mL,pH?7.3。
1.2?α萘乙酸降解菌的篩選與鑒定
1.2.1?α萘乙酸降解菌的富集與分離
取過篩林地土2?kg,分4次按劑量0.1、0.2、0.4、0.8?g/kg加入α萘乙酸;每次加入α萘乙酸后,于25~28℃恒溫培養箱中培養7?d,共計培養28?d。期間適量噴水,保持土壤濕潤。
取培養好的土樣1?g加入到9?mL?無菌水中,充分混合均勻后用無菌水依次稀釋成10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9的濃度梯度用于菌株分離。用滅菌接種環分別蘸取10-6、10-7、10-8、10-9濃度土壤溶液,涂布到細菌培養基和馬丁氏培養基平板上,3次重復,分別于37℃?和?28℃?培養箱中培養,待平板上出現單菌落后挑取單菌落進一步純化;將分離的菌株于試管斜面培養基中?4℃?保存。
1.2.2?菌株鑒定及發育樹的構建
將細菌1號菌株接種于LB液體培養基30℃培養12?h,采用BigDye?Teminator?V?3.1?Cycle?Sequencing?Kit(天根生化科技有限公司)提取細菌基因組DNA。采用細菌16S?rDNA通用引物對[14](27F:5′AGAGTTTGATCCTGGCTCAG3′;1492R:5′TACGGCTACCTTGTTACGACTT3′)擴增,片段大小為1?500?bp。PCR反應體系(20?μL):DNA?模板1?μL,Big?Dye?8?μL,正、反向引物(10?μg/L)各0.5?μL,dd?H2O?10?μL。PCR反應程序:96℃?預變性?5?min;96℃?變性?20?s,62℃?退火30?s,72℃?延伸30?s,35個循環;72℃延伸10?min。1%瓊脂糖凝膠電泳檢測PCR擴增產物。
真菌2號菌株活化后轉接到PDA平板中,待菌絲長滿培養皿后,采用Sangon生物有限公司的Ezup柱式真菌基因組DNA抽提試劑盒(Genomic?DNA?Purification?Kit)提取DNA。采用真菌rDNAITS通用引物對(ITS1:5′TCCGTAGGTGAACCTGCGG3′;ITS4:5′TCCTCCGCTTATTGATATGC3′)擴增,片段大小為500?bp。PCR反應體系(30?μL):Super?Mix?15?μL,?DNA模板1?μL,?ITS1(10?μg/L)1?μL,?ITS4(10?μg/L)1?μL,ddH2O補足至30?μL。PCR反應程序:96℃?預變性?5?min;96℃?變性?20?s,56℃?退火30?s,72℃?延伸30?s,35個循環;72℃延伸10?min。1%瓊脂糖凝膠電泳檢測PCR擴增產物。
使用PCR產物磁珠法純化試劑盒(上海碩美生物科技有限公司)純化PCR產物,純化產物送北京六合華大基因科技有限公司測序。測序結果上傳至NCBI數據庫,在GenBank中通過BLAST進行同源性比對,通過MEGA?X軟件進行系統發育分析,采用neighborjoining?法構建系統發育樹。
1.3?土壤中α萘乙酸與根長抑制率的關系曲線
采用生物測定法[15]建立標準曲線。將采集的土樣經自然風干,過篩去除雜質后備用。將供試水稻種子浸泡催芽,待種子露白后備用。將α萘乙酸均勻混入土樣中,配制成0、0.003?1、0.006?3、0.012?6、0.025?0、0.050?0、0.100?0?g/kg?(有效劑量)系列濃度梯度,將不同濃度藥土50?g裝入紙杯中,每紙杯播種10粒剛露白的水稻種子,以α萘乙酸濃度為0的處理作為對照,每處理重復3次。將紙杯放入晝/夜28.5℃/20℃,L∥D=12?h∥12?h的培養箱中培養,在培養后的第10天測量根長,計算根長抑制率,建立根長抑制率與α萘乙酸濃度之間的標準曲線。
根長抑制率=(對照根長-處理根長)/對照根長×100%。
1.4?α萘乙酸對水稻苗期生長的影響及菌劑對α萘乙酸的降解
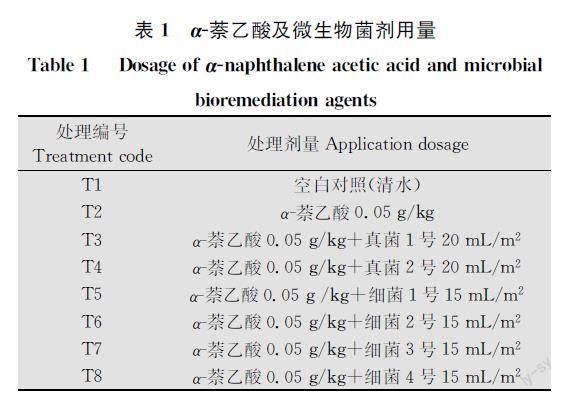
田間試驗在東北農業大學園藝站大棚內進行,4月-5月平均最高氣溫18.16℃。采用隨機區組設計,共設8個處理(表1),為防止肥料對菌劑修復效果產生干擾,試驗過程中未施入任何肥料。以α萘乙酸最適濃度的3倍濃度0.05?g/kg(有效劑量,下同)施用于育秧土中模擬水稻育秧過程中施用的過量濃度。將供試98%α萘乙酸與過篩育秧土均勻混合配制成藥土。澆透底水后播種,每處理6次重復,以不施藥和只施用α萘乙酸土壤做對照。水稻出苗后按表1施用分離菌株培養的菌劑,菌劑濃度為108?cfu/mL。
1.4.1?菌劑對α萘乙酸的降解
在施用菌劑后7、14、21、28?d分別取育秧土裝入紙杯,每紙杯播種10粒剛露白的水稻種子,按1.3的方法測定根長抑制率,根據標準曲線計算出土壤中α萘乙酸殘留,進而計算α萘乙酸的降解率。試驗重復3次。
α萘乙酸自然降解率=(α萘乙酸施用濃度-單施α萘乙酸處理組土壤殘留濃度)/α萘乙酸施用濃度×100%;
菌劑對α萘乙酸的降解率=(單施α萘乙酸處理組土壤殘留濃度-菌劑處理組土壤中α萘乙酸殘留濃度)/α萘乙酸施用濃度×100%。
1.4.2?菌劑對水稻苗期生理指標及干物質積累量的影響
田間水稻生長至2.5?葉期和?4?葉期時,分別測定水稻株高、須根數、莖基部寬度、百株地上部及根系干重。莖基部寬度采用游標卡尺測定,干重采用烘干法測定,105℃殺青30?min,60℃烘干至恒重。
1.4.3?菌劑對水稻秧苗SOD、POD活性和MDA含量的影響
取水稻2.5葉期和4葉期葉片,放入裝有冰袋的保溫箱立即帶回實驗室,測定抗逆酶活性和丙二醛(malondialdehyde,MDA)含量[16]。其中,超氧化物歧化酶(superoxide?dismutase,SOD)活性采用氮藍四唑光化還原法測定;過氧化物酶(peroxidase,POD)活性采用愈創木酚法測定;MDA含量采用硫代巴比妥酸比色法測定。
1.5?數據處理與分析
采用Excel?2019和SPSS?20軟件進行數據處理和統計分析,數據均為平均值±標準差,采用單因素和Duncan氏法進行5%水平下方差分析和多重比較。
2?結果與分析
2.1?微生物菌劑對水稻秧苗生理指標的影響
6個微生物菌劑施用后,與僅施用α萘乙酸的處理2相比,水稻株高、莖粗、須根數及根系干重均有不同程度的變化,其中以細菌1號處理的修復效果最佳,真菌2號處理次之。與未施用任何藥劑的處理1相比,細菌1號施用后,在水稻2.5葉期,株高、莖基部寬度、須根數分別恢復至對照的80.8%、78.3%和81.2%;4葉期,分別恢復至空白對照(T1)的84.1%、86.1%和97.7%;4葉期根系干重恢復至對照的84.5%。真菌2號處理,水稻2.5葉期,株高、莖基部寬度及須根數和根系干重分別恢復至空白對照(T1)的74.9%、73.7%、97.3%和78.6%;4葉期分別恢復至對照的77.7%、81.6%、92.5%和80.4%。真菌1號和其他細菌處理水稻秧苗均未能顯著恢復正常。結果表明:細菌1號與真菌2號可明顯修復α萘乙酸藥害下水稻秧苗的生長(表2和表3)。
2.2?微生物菌劑對水稻秧苗抗逆酶活性的影響
細菌1號處理,與單施α萘乙酸處理(T2)相比,4葉期水稻葉片SOD和POD活性分別顯著提高36.4%和66.8%,MDA含量明顯降低20.5%;真菌2號處理,與單施α萘乙酸處理(T2)相比,4葉期水稻葉片SOD和POD活性分別提高11.1%和74.4%,MDA含量顯著降低10.6%。真菌1號和其他細菌處理對水稻秧苗抗逆酶活性無顯著影響(圖1~3)。
2.3?微生物菌劑對α萘乙酸的降解
土壤中α萘乙酸的濃度與根長抑制率的關系可以用多項式模型很好地擬合出來(圖4)。施用微生物菌劑后7?d取樣測定結果表明:細菌1號和真菌2號對α萘乙酸的降解率分別為31.90%和12.53%,與單施α萘乙酸的處理2相比差異達顯著水平,其他菌劑與處理2相比差異不顯著;菌劑施用后21?d,細菌1號和真菌2號對α萘乙酸降解率分別為56.15%和38.06%,與處理2相比差異顯著,其他菌劑處理對α萘乙酸的降解率顯著低于處理2(圖5)。
2.4?α萘乙酸降解菌的分離與純化
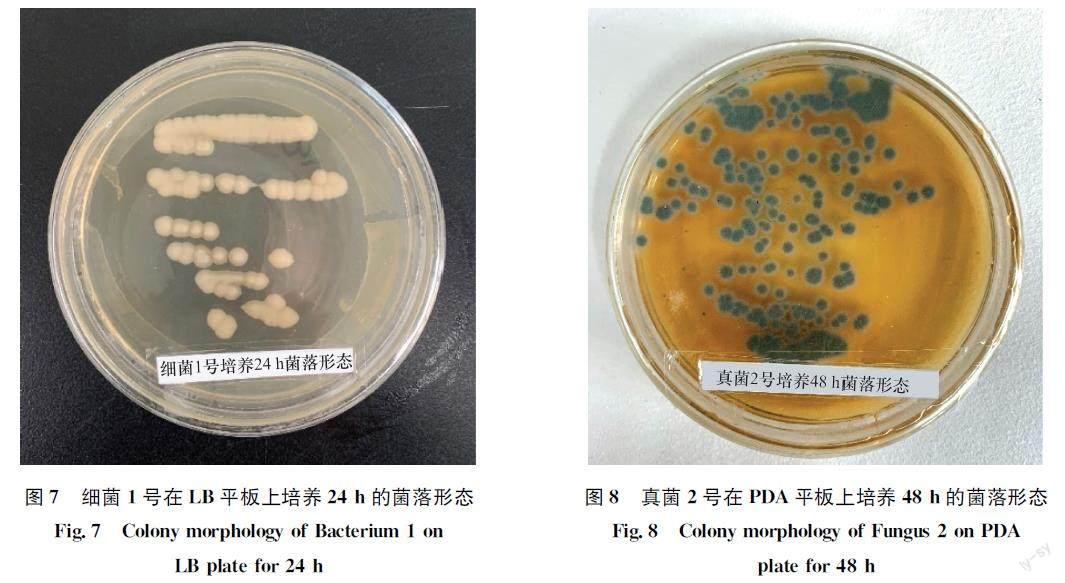
逐步提高土壤中α萘乙酸的施用量后,經過連續5次繼代培養,分離得到6株菌株,其中真菌2株,細菌4株,菌落形態見圖6。對篩選出的α萘乙酸降解效果好的兩株菌株細菌1號和真菌2號進一步連續純化培養3次后,細菌菌落呈黃色、圓形、隆起、不透明、邊緣整齊(圖7)。真菌菌落呈灰綠色,圓形,密氈狀(圖8)。
2.5?α萘乙酸降解菌的鑒定
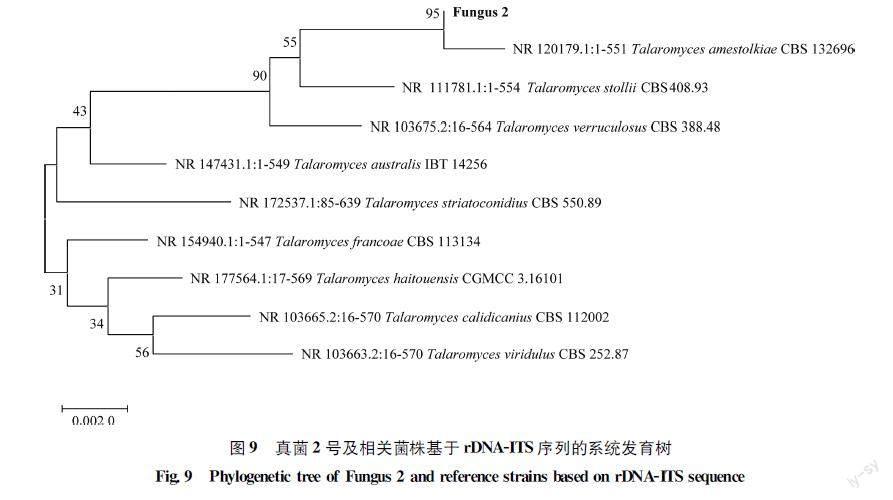
真菌2號和細菌1號菌株對α萘乙酸降解效果較好,分別對其進行rDNAITS和16S?rDNA分子鑒定,并將兩菌株的基因序列上傳至NCBI進行BLAST比對并構建系統發育樹,結果顯示,真菌2號與籃狀菌屬的尖海龍類共附生真菌Talaromyces?amestolkiae(NR120179)的rDNAITS的相似性較高,為95%,聚在同一個分支(圖9),因此,將真菌2號鑒定為籃狀菌Talaromyces?sp.。細菌1號與芽胞桿菌屬的太平洋芽胞桿菌Bacillus?pacificus(CP041979)的16S?rDNA序列的相似性較高,為90%,聚類于同一個分支(圖10),因此,將細菌1號鑒定為芽胞桿菌Bacillus?sp.。
3?結論與討論
α萘乙酸在水稻旱育秧田應用時,常因低溫條件和施用濃度人為增加而造成水稻秧苗藥害的發生。對于藥害較輕的田塊,可通過葉片沖洗,及時松土提高土壤通透性,結合灌水和適當施用一些速效肥料等恢復生長或利用其他生長調節劑緩解藥害[17]。然而,藥害較重的地塊上述方法很難達到藥害的修復效果。
利用微生物的降解作用可在藥害發生后快速降解藥劑,從而實現快速恢復藥害作物生長的實際效果。目前已經陸續分離出能夠降解各類植物生長調節劑的微生物菌株[18],且對降解細菌的研究較為深入[19]。現階段對微生物降解植物生長調節劑的研究主要是在培養基中的研究,培養基中發生的降解行為與土壤中仍有不同。本文通過分離可降解α萘乙酸的菌株來緩解其產生的藥害,細菌1號和真菌2號施用于水稻育秧田21?d后對α萘乙酸的降解率分別為56.15%和38.06%,貪銅菌Cupriavidus?sp.?CY1在含300?mg/L?2,4D的培養基中48?h內可降解100%的2,4D,在100?mg/kg?2,4D的土壤中,3?d內能降解90%的2,4D[20]。不同菌種對同一植物生長調節劑的降解也有差異。如在含100?mg/L多菌靈的液體培養基中,其他條件相似的情況下,紅球菌?Rhodococcus?sp.在48?h內可以降解74%的多菌靈[21],而短小芽胞桿菌?Bacillus?pumilus在24?h內就可以降解83.6%的多菌靈[22]。有關環境因素與農藥殘留量的相關性研究還較少。本研究對α萘乙酸在土壤中的降解微生物進行篩選和驗證,同時也進行了α萘乙酸降解菌株的降解效果初探,但尚缺乏培養基條件下降解菌株對α萘乙酸的降解試驗及探究其降解過程中的代謝產物等降解機制方面的研究。
此外,本研究分離的細菌1號和真菌2號
對過量施用α萘乙酸后的水稻株高、次生根條數、莖基部寬度及地上部、根系干物質積累等生理指標都表現出很好的修復效果。但是只對兩種微生物降解菌單獨施用進行了研究,且施用劑量未做濃度梯度處理,僅按照微生物菌株田間施用量進行試驗,雖有很好的修復效果,但未對水稻生長起到促進作用。并且農田生態系統具有多樣性、復雜性和不確定性,因此,還應進一步深入研究兩種菌株與環境條件互作下對α萘乙酸的降解效果,并明確兩種降解菌對水稻秧苗α萘乙酸藥害修復的最適濃度,為這兩種菌株合理應用提供更可行方案。
本研究分離獲得對α萘乙酸降解效果較好的尖海龍類共附生真菌和太平洋芽胞桿菌,對水稻α萘乙酸藥害具有明顯的修復效果。
參考文獻
[1]?崔海蘭,?朱延明,?齊洋.?Thidiazuron等植物生長調節劑對水稻(Oryza?sativa?L.)愈傷組織不定芽分化的影響[J].東北農業大學學報,?2003(1):?7276.
[2]?GRIENEISEN?V?A,?XU?Jian,?MARE?A?F?M,?et?al.?Auxin?transport?is?sufficient?to?generate?a?maximum?and?gradient?guiding?root?growth?[J].?Nature,?2007,?449(7165):?10081013.
[3]?邢興華,?徐澤俊,?齊玉軍,?等.?外源α萘乙酸對花期干旱大豆碳代謝的影響[J].應用生態學報,?2018,?29(4):?12151224.
[4]?劉擁海,?俞樂.?萘乙酸對水稻根、芽生長的影響[J].?廣西農業科學,?2004(3):?179180.
[5]?劉珩,?王濤,?孫守文,?等.?α萘乙酸處理對“密胡楊1號”插穗生根的影響[J].?防護林科技,?2015(3):?78.
[6]?王衛成,?韓富軍.?NAA不同濃度及浸泡時間處理對金森女貞扦插生根率的影響[J].?林業實用技術,?2010(12):?4849.
[7]?魏雪梅.?辣椒水培扦插繁殖技術研究[D].楊凌:?西北農林科技大學,?2019.
[8]?安之冬.?水稻育秧基質配施化肥與生長調節劑對秧苗素質及產量的影響[D].?合肥:?安徽農業大學,2021.
[9]?王新,?李兆興,?倪子鈞,?等.?白腐真菌降解農藥研究進展[J].?農藥學學報,?2020,?22(3):?405412.
[10]陳亮,?侯杰,?胡曉蕾,?等.?植物生長調節劑在土壤中的環境行為綜述[J].?環境科學,?2022,?43(1):?1125.
[11]陳澤鵬,?王靜,?萬樹青,?等.?煙區土壤殘留二氯喹啉酸的消解動態[J].?農藥,?2007(7):?479480.
[12]陳森,?韋德萍,?王歡,?等.?乙草胺降解菌系的分離鑒定及其生長降解特性研究[J].?基因組學與應用生物學,?2017,?36(11):?47074715.
[13]褚翠偉,?劉斌,?朱啟黎,?等.?殺草丹降解菌Bacillus?sp.?T2的篩選、鑒定及降解特性[J].?應用與環境生物學報,?2018,?24(4):?921927.

