黃芪-當歸6種活性成分配伍對大鼠血管外膜成纖維細胞合成細胞外基質的影響
徐順洲 陳凌波 閻卉芳 鄧常清
〔摘要〕 目的 觀察黃芪-當歸活性成分阿魏酸(ferulic acid, FA)、毛蕊異黃酮苷(calycosinglucoside, CG)、芒柄花素(formononetin, FMN)、黃芪皂苷Ⅰ(astragalosideⅠ, ASⅠ)、黃芪甲苷(astragaloside Ⅳ, AS Ⅳ)、毛蕊異黃酮(calycosin, CAL)配伍對血管緊張素Ⅱ(angiotensinⅡ, AngⅡ)誘導的大鼠血管外膜成纖維細胞(vascular adventitia fibroblasts, VAF)合成細胞外基質(extracellular matrix, ECM)的影響。方法 以AngⅡ誘導VAF增殖模型,采用目標成分“敲除/敲入”的方法,將細胞分為空白組、模型組、IC10配伍組、某一活性成分敲除組、某一活性成分敲入組,分別檢測細胞及培養液中纖維連接蛋白(fibronectin, FN)、層粘連蛋白(laminin, LN)、Ⅰ型膠原(collagen typeⅠ, COLⅠ)、Ⅲ型膠原(collagen typeⅢ, COLⅢ)含量,并檢測細胞基質金屬蛋白酶2(matrix metalloproteinase 2, MMP2)、基質金屬蛋白酶組織抑制劑2(tissue inhibitor of metalloproteinase 2, TIMP2)、轉化生長因子β1(transforming growth factor-β1, TGF-β1)蛋白表達,研究黃芪-當歸6種活性成分配伍對VAF合成ECM的影響。結果 黃芪-當歸6種活性成分配伍抑制VAF合成FN、LN、COLⅠ、COLⅢ(P<0.01)。FA、CG、FMN、ASⅠ敲入后抑制FN、LN合成的作用增強(P<0.05或P<0.01),FA、CAL、FMN、ASⅠ、AS Ⅳ敲入后抑制COLⅠ、COLⅢ合成的作用增強(P<0.05或P<0.01)。黃芪-當歸6種活性成分配伍促進MMP2、TIMP2的表達(P<0.01),FA、CG、FMN、AS Ⅳ、CAL敲入后促進MMP2表達的作用增強(P<0.05或P<0.01),FMN、AS Ⅳ、CAL敲入后促進TIMP2表達的作用增強(P<0.05或P<0.01);黃芪-當歸6種活性成分配伍抑制TGF-β1表達(P<0.05),FA、CG、FMN敲入后抑制TGF-β1表達的作用增強(P<0.05或P<0.01)。結論 黃芪-當歸6種活性成分配伍可抑制VAF合成ECM,其作用可能是通過調節TGF-β1、MMP2、TIMP2發揮的。
〔關鍵詞〕 黃芪;當歸;活性成分;血管外膜成纖維細胞;細胞外基質
〔中圖分類號〕R285.5 ? ? ? 〔文獻標志碼〕A ? ? ? ?〔文章編號〕doi:10.3969/j.issn.1674-070X.2023.04.001
Effects of compatibility of 6 active ingredients of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) on extracellular matrix synthesis by vascular adventitia fibroblasts in rats
XU Shunzhou1,2, CHEN Lingbo1, YAN Huifang1, DENG Changqing1*
1. School of Integrated Chinese and Western Medicine, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Department of Cardiology, The First Hospital of Hunan College of Chinese Medicine, Zhuzhou, Hunan 412000, China
〔Abstract〕 Objective To observe the effects of 6 active components of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis), namely ferulic acid (FA), calycosinglucoside (CG), formononetin (FMN), astragalosideⅠ (ASⅠ), astragalosideⅣ(ASⅣ) and calycosin (CAL), on the synthesis of extracellular matrix (ECM) by vascular adventitia fibroblasts (VAF) induced by angiotensinⅡ (AngⅡ) in rats. Methods By employing VAF proliferation model induced by AngⅡ, and the target component "knock-out/knock-in" method, the cells were divided into blank group, model group, 10% inhibitory concentration compatibility group, active component knock-out group, and active component knock-in group. Then, the content of fibronectin (FN), laminin (LN), collagen typeⅠ(COLⅠ), and collagen type Ⅲ(COLⅢ) in cells and culture medium were measured respectively. The expression levels of matrix metalloproteinase2 (MMP2), tissue inhibitor of matrix metalloproteinase2 (TIMP2), and transforming growth factor-β1 (TGF-β1) were detected. Based on the above, we studied the effects of compatibility of six active components of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) on extracellular matrix synthesis by vascular adventitia fibroblasts in rats. Results The compatibility of 6 active ingredients of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) can inhibit the synthesis of FN, LN, COLⅠ and COLⅢ by VAF (P<0.01); after the knock-in of FA, CG, FMN and AS I, the synthesis of FN and LN was more inhibited (P<0.05 or P<0.01); and after the knock-in of FA, CAL, FMN, AS I, and AS Ⅳ, the synthesis of COLI and COLⅢ was more inhibited (P<0.05 or P<0.01). The compatibility of 6 active ingredients of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) can promote the expression of MMP2 and TIMP2 (P<0.01); after the knock-in of FA, CG, FMN, ASⅣ and CAL, the expression of MMP2 was enhanced (P<0.05 or P<0.01), and after the knock-in of FMN, ASⅣ and CAL, the expression of TIMP2 was enhanced (P<0.05 or P<0.01); the compatibility of six active ingredients of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) can inhibit the expression of TGF-β1 (P<0.05); after the knock-in of FA, CG and FMN, the expression of TGF-β1 was more inhibited (P<0.05 or P<0.01). Conclusion The compatibility of six active ingredients of Huangqi (Radix Astragali)-Danggui (Radix Angelicae Sinensis) can inhibit the synthesis of ECM by VAF in rats, possibly by regulating TGF-β1, MMP2 and TIMP2.
〔Keywords〕 Huangqi (Radix Astragali); Danggui (Radix Angelicae Sinensis); active ingredients; vascular adventitia fibroblasts; extracellular matrix
病理性血管重構是諸多心血管疾病發生發展的共同病理基礎[1],是一個動態變化的過程,主要包括細胞增殖、遷移、凋亡以及細胞外基質(extracellular matrix, ECM)合成、降解和重新排列等。目前研究發現,血管外膜對損傷的反應最為靈敏,先于內膜及中膜,可能是介導內膜及中膜病變的始動因素和“主導者”[2]。ECM是血管壁的重要組成部分,研究發現,ECM對生理和病理刺激的反應是高度動態的[3]。外膜的膠原成分主要由血管外膜成纖維細胞(vascular adventitia fibroblasts, VAF)合成與分泌,因此,VAF決定了血管ECM的組成。當血管損傷時,血管壁細胞合成大量ECM,同時合成基質金屬蛋白酶(matrix metalloproteinase, MMP)增加,導致原有基質發生降解,被激活的細胞侵入病變區,膠原蛋白、纖維連接蛋白(fibronectin, FN)等沉積增加,最后形成膠原纖維交互連接,血管在ECM降解和新的基質成分沉積增加過程中發生重構[4-5]。因此,調節ECM成為改善血管重構治療的潛在靶點[6]。課題組前期研究表明,黃芪和當歸配伍可抑制血管內膜增生,改善局部血管炎癥反應,減輕ECM在血管壁的沉積,抑制血管平滑肌細胞(vascular smooth muscle cell, VSMC)表型轉化和增殖[7-11]。藥物吸收實驗表明,黃芪-當歸配伍活性成分阿魏酸(ferulic acid, FA)、毛蕊異黃酮苷(calycosin glycoside, CG)、芒柄花素(formononetin, FMN)、黃芪皂苷Ⅰ(astragalosideⅠ, ASⅠ)、黃芪甲苷(astragaloside Ⅳ, AS Ⅳ)、毛蕊異黃酮(calycosin, CAL)可吸收入血[12-13]。血管內皮細胞(vascular endothelial cell, VEC)氧化損傷模型相關研究發現,上述6種成分及配伍可減輕氧化低密度脂蛋白(oxidized low density lipoprotein, ox-LDL)誘導的VEC氧化損傷,促進VEC增殖,對VEC氧化損傷具有保護作用[14]。VSMC異常增殖模型研究發現,上述6種活性成分配伍可以抑制VSMC異常增殖[15]。因此,推測這些有效成分可以抑制VAF合成ECM。本研究用血管緊張素Ⅱ(angiotensinⅡ, AngⅡ)誘導VAF增殖模型,采用目標成分“敲除/敲入”的方法[16],研究黃芪-當歸6種活性成分配伍對ECM合成的影響。
1 材料與方法
1.1 ?細胞
大鼠VAF購自武漢普諾賽生命科技有限公司,批號:CP-R077。經鑒定,VAF標志物Vimentin表達陽性率>90%,符合VAF生物學特征。
1.2 ?試劑與藥物
ASⅠ(純度≥98%,批號:C10070259,上海麥克林生化科技有限公司);FA(純度>99%,批號:SF8030)、FMN(純度>98%,批號:SF8070)、AS Ⅳ(純度>98%,批號:SA8640)、CAL(純度>98%,批號:SC8040)、CG(純度>98%,批號:SC8050)、AngⅡ(批號:A9290)、二甲基亞砜(dimethyl sulfoxide, DMSO)(批號:1129E033)均購自北京索萊寶科技有限公司;DMEM高糖培養基(批號:AE29163339,美國HyClone公司);兔抗大鼠基質金屬蛋白酶抑制因子2(tissue inhibitor of metallo proteinase 2, TIMP2)多克隆抗體(武漢愛博泰克生物科技有限公司,批號:A1558);兔抗大鼠基質金屬蛋白酶2(matrix metalloproteinase 2, MMP2)單克隆抗體(批號:ab92536)、兔抗大鼠轉化生長因子-β1(transforming growth factor-β1, TGF-β1)單克隆抗體(批號:ab179695)均購自英國abcam公司;兔抗大鼠β-肌動蛋白(β-actin)多克隆抗體(批號:20536-1-AP)、HRP標記山羊抗兔IgG二抗(批號:SA00001-2)均購自武漢三鷹生物技術有限公司。
1.3 ?主要儀器
Heracell型CO2培養箱(德國Heraeus公司);SW-CJ-1FD型超凈工作臺(中國蘇州安泰公司);CYTATION5型ChemiDo C-XRS+化學發光成像分析儀、Synergy HT型多功能酶標成像系統儀(美國博騰儀器有限公司)。
1.4 ?方法
1.4.1 ?VAF培養 ?將VAF用含10%胎牛血清的DMEM制成細胞懸液,置于37 ℃無菌CO2培養箱中培養,每3天換液1次,每周傳代2次,第4代開始用于實驗。
1.4.2 ?各活性成分的制備 ?各活性成分以DMSO-DMEM溶解,制備成儲存液,使用時以基礎培養液稀釋,含藥培養基中DMSO終體積分數≤0.1%。
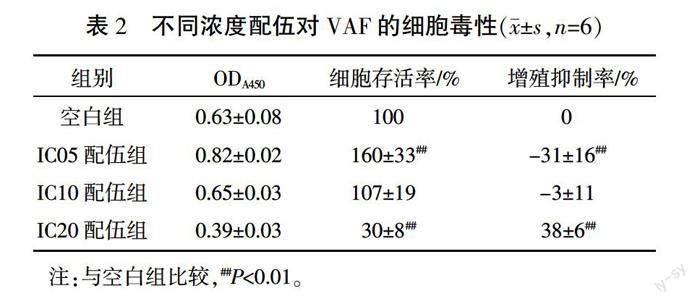
1.4.3 ?細胞毒性實驗 ?選擇各個成分,在對細胞有著相同抑制效應的5%、10%、20%抑制濃度(inhibiting concentration, IC)即IC05、IC10、IC20中進行配伍。取對數生長期VAF,以2500個/孔接種于96孔培養板。待細胞貼壁后,無血清培養基培養使細胞同步化于G0期。然后將細胞隨機分為空白組:加入基礎培養基;IC05配伍組:加入6種活性成分濃度均為IC05配伍的培養基;IC10配伍組:加入6種活性成分濃度均為IC10配伍的培養基;IC20配伍組:加入6種活性成分濃度均為IC20配伍的培養基。每組設6個復孔。藥物干預48 h后,每孔加入CCK-8試劑10 μL,37 ℃溫育1 h,應用酶標儀于450 nm波長處檢測各孔吸光度(A)。按下式計算細胞存活率和細胞增殖抑制率:細胞存活率=(實驗孔A-空白孔A)/(對照孔A-空白孔A)×100%;細胞增殖抑制率=(1-實驗孔A/對照孔A)×100%。
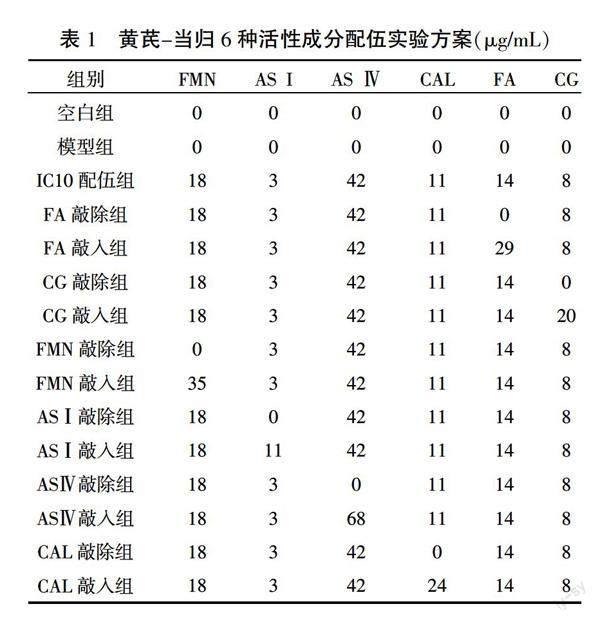
1.4.4 ?“敲除/敲入”法研究活性成分配伍對VAF合成ECM的影響 ?取對數生長期VAF,接種于6孔培養板。待細胞貼壁后,同步化于G0期。參考相關資料[16],將細胞隨機分為空白組、模型組(AngⅡ 10-6 mol/L[17])、IC10配伍組、某一成分敲除組、某一成分敲入組。IC10配伍組6種活性成分濃度均為IC10配伍,“敲除”是在各成分IC10配伍基礎上敲除某目標成分,“敲入”是在各成分IC10配伍基礎上將目標成分的劑量增加至IC20(FA:IC10 14 μg/mL,IC20 29 μg/mL;CG:IC10 8 μg/mL,IC20 20 μg/mL;FMN:IC10 18 μg/mL,IC20 35 μg/mL;ASⅠ:IC10 3 μg/mL,IC20 11 μg/mL;ASⅣ:IC10 42 μg/mL,IC20 68 μg/mL;CAL:IC10 11 μg/mL,IC20 24 μg/mL)。詳見表1。
1.4.5 ?ELISA法檢測細胞總FN、LN、COLⅠ、COLⅢ含量 ?各組細胞干預48 h后,同時收集培養液及細胞,采用超聲破碎儀破碎細胞,離心后取提取液,采用ELISA法檢測FN、LN、COLⅠ、COLⅢ含量,操作按說明書進行。
1.4.6 ?Western blot法檢測細胞MMP2、TIMP2、TGF-β1表達 ?各組細胞干預48 h后,收集細胞提取總蛋白,BCA法測定蛋白濃度,每孔上樣蛋白量20 μg,蛋白樣品經電泳及轉膜后,5%脫脂牛奶封閉1~2 h,分別加入抗TIMP2抗體(1∶2000)、抗TGF-β1抗體(1∶2000)、抗MMP2抗體(1∶3000)、抗β-actin抗體(1∶8000),4 ℃過夜,TBST清洗10 min×3次,加入HRP標記羊抗兔二抗(1∶8000),37 ℃孵育1 h,TBST清洗10 min×3次,顯影。采用Image Lab圖像分析軟件分析結果,以目的蛋白與β-actin光密度值的比值作為目的蛋白的相對表達量。
1.5 ?統計學處理
實驗數據以“x±s”表示,用SPSS 26.0統計軟件進行分析。多組比較采用單因素方差分析,組間兩兩比較時,方差齊者采用LSD檢驗,方差不齊者采用Dunne't s T3檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 ?黃芪-當歸6種活性成分配伍對VAF增殖的影響
與空白組比較,IC05配伍組細胞存活率顯著增加、增殖抑制率降低(為負值)(P<0.01),表明IC05配伍可促進VAF增殖;IC10配伍組細胞存活率和增殖抑制率差異均無統計學意義(P>0.05),說明IC10配伍對細胞增殖無明顯抑制作用;IC20配伍組細胞存活率顯著降低、增殖抑制率顯著增加(P<0.01),說明IC20配伍明顯抑制VAF增殖。以增殖抑制率<20%作為細胞的無毒性濃度,IC10配伍劑量無細胞毒性,IC20配伍劑量有細胞毒性,故選用IC10配伍劑量作為中點劑量,在此基礎上進行活性成分敲除/敲入實驗。詳見表2。
2.2 ?黃芪-當歸6種活性成分配伍對FN、LN、COLⅠ、COLⅢ的影響
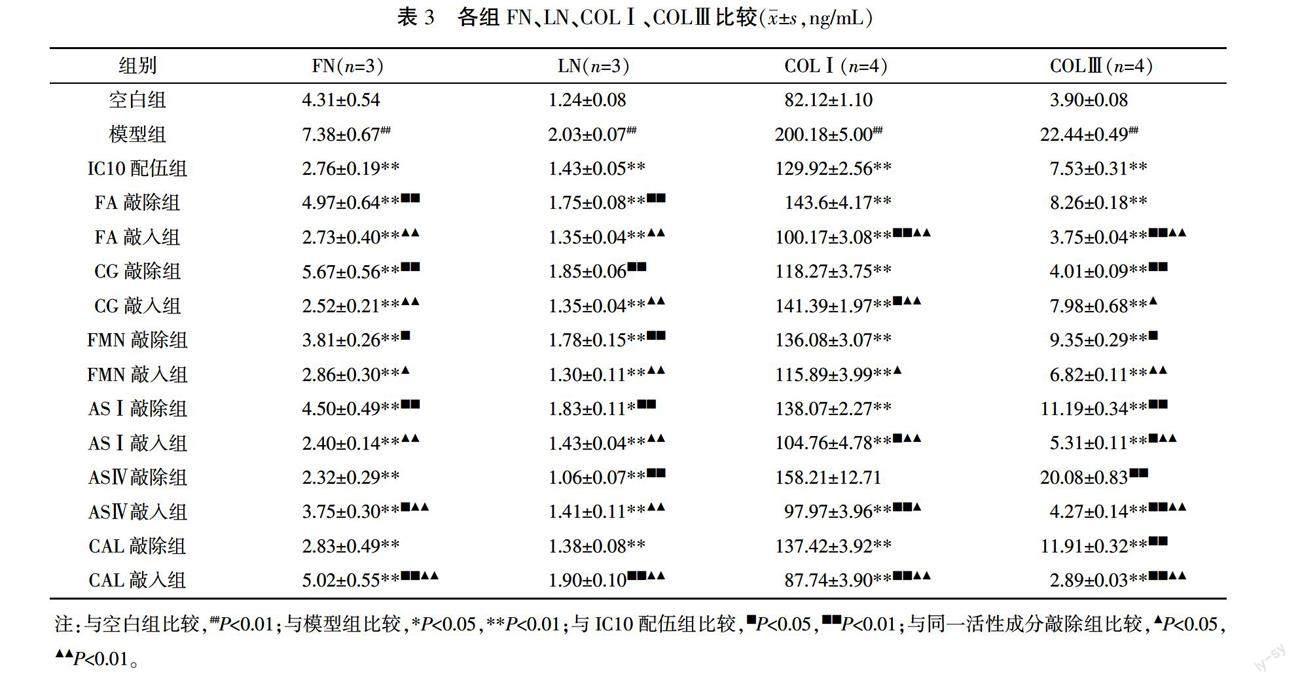
與空白組比較,模型組FN、LN、COLⅠ、COLⅢ含量顯著增加(P<0.01)。與模型組比較,IC10配伍組FN、LN、COLⅠ、COLⅢ顯著降低(P<0.01)。FA、CG、FMN、ASⅠ敲除組FN、LN含量顯著高于對應敲入組及IC10配伍組(P<0.05或P<0.01),AS Ⅳ、CAL敲入組FN、LN含量顯著高于對應敲除組(P<0.05或P<0.01)。FMN、FA、ASⅠ、AS Ⅳ、CAL敲入組COLⅠ、COLⅢ顯著低于對應敲除組(P<0.05或P<0.01),CG敲入組COLⅠ、COLⅢ顯著高于對應敲除組(P<0.05或P<0.01)。詳見表3。
2.3 ?黃芪-當歸6種活性成分配伍對MMP2、TIMP2、TGF-β的影響
與空白組比較,模型組MMP2表達顯著降低(P<0.01),TGF-β1表達顯著升高(P<0.01)。與模型組比較,IC10配伍組MMP2、TIMP2表達顯著升高(P<0.01),TGF-β1表達降低(P<0.05)。FA、CG、FMN、AS Ⅳ、CAL敲入組MMP2表達顯著高于對應敲除組及IC10配伍組(P<0.05或P<0.01),AS Ⅰ敲入組MMP2表達顯著低于對應敲除組(P<0.01),FA、FMN、AS Ⅳ、CAL敲入組TIMP2表達高于對應敲除組(P<0.05或P<0.01),FA、CG、FMN敲入組TGF-β1表達低于對應敲除組(P<0.05或P<0.01),CAL敲入組TGF-β1表達高于對應敲除組(P<0.05)。詳見圖1、表4。
3 討論
近年研究表明,血管損傷時,VAF最先被激活,激活后轉化為肌成纖維細胞,并分泌大量細胞生長因子,導致大量膠原在血管壁沉積及ECM重構[2,18-19]。TGF-β1是一種多功能的蛋白肽,為生長因子家族的重要成員,可促進ECM合成,抑制MMP的生成并減少膠原蛋白降解[20]。MMP可以降解ECM,MMP2在血管重構中發揮重要作用。TIMP是MMP的特異性內源抑制因子,其中TIMP2主要抑制MMP2,在正常血管中MMP/TIMP處于動態平衡,兩者的比例失衡是導致ECM降解減少的重要原因[5]。
氣虛血瘀是血管重構的基本病機,益氣活血是基本治則。黃芪和當歸是臨床常用的氣血雙補藥對,黃芪和當歸的配伍應用最有名的是黃芪與當歸比為5∶1的當歸補血湯,具有益氣活血之功效[21]。課題組前期研究表明,黃芪-當歸在一定比例范圍配伍時具有抑制血管內膜增生的作用,其中以黃芪-當歸1∶1配伍抗血管內膜增生的作用為佳[7]。其作用機制可能是兩藥配伍可抑制血管內皮受損后PI3K/Akt信號通路激活,進而抑制VSMC表型轉化和細胞增殖,從而發揮抗VSMC增殖的作用[9]。黃芪-當歸配伍可抑制血管內膜增生時血管壁ECM沉積[8]。黃芪-當歸6種主要活性成分及其配伍可以通過抑制氧化損傷及細胞凋亡,抑制VEC損傷[11]。
為了驗證黃芪-當歸活性成分配伍能否通過調節ECM合成改善病理性血管重構,本研究以AngⅡ誘導VAF增殖模型,探討了黃芪-當歸活性成分配伍對VAF合成ECM的影響。結果顯示,AngⅡ誘導VAF后,細胞合成FN、LN、COLⅠ、COLⅢ的能力增強,TGF-β1表達升高,MMP2、TIMP2表達降低。表明AngⅡ可使VAF合成ECM的能力增強。6種活性成分配伍可降低細胞FN、LN、COLⅠ、COLⅢ合成。在本研究使用的劑量范圍內,FA、CG、FMN、ASⅠ可抑制FN、LN合成,FA、FMN、ASⅠ、AS Ⅳ、CAL可抑制COLⅠ、COLⅢ合成。
6種活性成分配伍可促進MMP2的表達,其中FA、CG、FMN、AS Ⅳ、CAL有促進MMP2表達的作用,ASⅠ有抑制MMP2表達的作用。6種活性成分配伍可促進TIMP2的表達,其中FA、FMN、AS Ⅳ、CAL可促進TIMP2表達,CG、ASⅠ對TIMP2表達的作用無明顯影響。6種活性成分配伍可以抑制TGF-β1表達,其中FA、CG、FMN可抑制TGF-β1表達,AS Ⅳ、CAL可促進TGF-β1表達,而ASⅠ對TGF-β的表達無明顯影響。提示黃芪和當歸的活性成分及其配伍可能通過抑制TGF-β1促ECM合成,發揮抑制VAF合成ECM的作用。黃芪和當歸的活性成分及其配伍可以促進MMP2、TIMP2表達,其機制可能是使MMP2、TIMP2在一個新的水平上達到平衡,從而有利于調節ECM合成與重構。
綜上所述,黃芪-當歸6種活性成分配伍可以抑制AngⅡ誘導的VAF合成ECM成分FN、LN、COLⅠ、COLⅢ。其機制可能與抑制TGF-β1信號通路,調節MMP2、TIMP2的表達有關。6種活性成分配伍對ECM合成的調節作用十分復雜,并不只是單個成分藥效之間的疊加,而是存在相互作用關系。調整其中某一成分劑量都可能對藥物效應產生影響,可能與多種成分對多途徑、多靶點發揮作用有關。
參考文獻
[1] 張 ?偉,鄧常清.從氣血理論探討病理性血管重構的研究思路[J].中華中醫藥雜志,2019,34(10):4713-4717.
[2] TINAJERO M G, GOTLIEB A I. Recent developments in vascular adventitial pathobiology: The dynamic adventitia as a complex regulator of vascular disease[J]. The American Journal of Pathology, 2020, 190(3): 520-534.
[3] MA Z H, MAO C F, JIA Y T, et al. Extracellular matrix dynamics in vascular remodeling[J]. American Journal of Physiology Cell Physiology, 2020, 319(3): C481-C499.
[4] OLEJARZ W, ACHETA D, KUBIAK-TOMASZEWSKA G. Matrix metalloproteinases as biomarkers of atherosclerotic plaque instability[J]. International Journal of Molecular Sciences, 2020, 21(11): 3946.
[5] SIM ES G, PEREIRA T, CASEIRO A. Matrix metaloproteinases in vascular pathology[J]. Microvascular Research, 2022, 143: 104398.
[6] KARAMANOS N K, THEOCHARIS A D, PIPERIGKOU Z, et al. A guide to the composition and functions of the extracellular matrix[J]. The FEBS Journal, 2021, 288(24): 6850-6912.
[7] 彭熙煒,閻卉芳,黃 ?娟,等.黃芪-當歸不同配伍比例對大鼠血管內膜增生的影響[J].中國中醫藥信息雜志,2017,24(6):56-59.
[8] 彭熙煒,閻卉芳,黃 ?娟,等.黃芪-當歸配伍對大鼠血管內膜增生模型細胞外基質的影響[J].湖南中醫藥大學學報,2018,38(6):629-634.
[9] 閻卉芳,徐 ?昊,彭熙煒,等.黃芪和當歸配伍對大鼠血管內膜增生血管平滑肌細胞增殖的影響[J].中國臨床藥理學與治療學,2018,23(4):361-369.
[10] 彭熙煒,閻卉芳,黃 ?娟,等.黃芪-當歸配伍對大鼠血管內膜增生模型炎性反應的影響[J].中華中醫藥雜志,2019,34(2):580-584.
[11] 譚媖子,劉彩霞,朱秋燕,等.黃芪當歸主要活性成分配伍對人臍靜脈內皮細胞氧化損傷的保護作用研究[J].中西醫結合心腦血管病雜志,2020,18(24):4141-4148.
[12] WEN X D, QI L W, LI P, et al. Simultaneous determination of calycosin-7-O-beta-D-glucoside, ononin, astragaloside IV, astragaloside I and ferulic acid in rat plasma after oral administration of Danggui Buxue Tang extract for their pharmacokinetic studies by liquid chromatography-mass spectrometry[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2008, 865(1/2): 99-105.
[13] 唐 ?蓉,張依人,陳葉童,等.不同劑量配伍對黃芪-當歸中5種化學成分的影響[J].中國實驗方劑學雜志,2016,22(23):1-5.
[14] LIU C X, TAN Y Z, DENG C Q. Main active components and cell cycle regulation mechanism of astragali Radix and angelicae Sinensis radix in the treatment of ox-LDL-induced HUVECs injury and inhibition of their cell cycle[J]. Evidence-Based Complementary and Alternative Medicine, 2021, 2021: 8087183.
[15] 陳凌波,任芮彬,閻卉芳,等.基于均勻試驗設計的黃芪-當歸主要化學成分劑量配伍對血管平滑肌細胞增殖的影響[J].中國實驗方劑學雜志,2023,29(3):143-151.
[16] 崔文博,李愛平,崔 ?婷,等.基于目標成分敲除/敲入技術辨識中藥藥效物質基礎研究進展[J].中國中藥雜志,2020,45(6):1279-1286.
[17] GUO Y T, LU Y Y, LU X, et al. Krüppel-like factor 15/interleukin 11 axis-mediated adventitial remodeling depends on extracellular signal-regulated kinases 1 and 2 activation in angiotensin II-induced hypertension[J]. Journal of the American Heart Association, 2021, 10(16): e020554.
[18] LI X D, HONG M N, CHEN J, et al. Adventitial fibroblast-derived vascular endothelial growth factor promotes vasa vasorum-associated neointima formation and macrophage recruitment[J]. Cardiovascular Research, 2020, 116(3): 708-720.
[19] MACKAY C D A, JADLI A S, FEDAK P W M, et al. Adventitial fibroblasts in aortic aneurysm: Unraveling pathogenic contributions to vascular disease[J]. Diagnostics, 2022, 12(4): 871.
[20] TZAVLAKI K, MOUSTAKAS A. TGF-β signaling[J]. Biomolecules, 2020, 10(3): 487.
[21] 劉彩霞,鄧常清.中藥及復方改善血管內皮細胞氧化應激損傷的研究進展[J].湖南中醫藥大學學報,2021,41(1):151-158.
〔收稿日期〕2022-06-13
〔基金項目〕國家自然科學基金項目(81874406);湖南省教育廳科學研究項目(18B245)。
〔第一作者〕徐順洲,男,碩士研究生,主治醫師,研究方向:中醫藥防治心血管疾病。
〔通信作者〕*鄧常清,男,博士,教授,博士研究生導師,E-mail:dchangq@sohu.com。

