侵染假酸漿的泰國(guó)番茄黃化曲葉病毒全基因組結(jié)構(gòu)特征
張水英 趙麗玲 鐘靜 李婷婷 丁銘


摘要 為明確假酸漿Nicandra physalodes葉片黃化、皺縮癥狀是否由菜豆金色花葉病毒屬病毒侵染引起,本研究利用分子檢測(cè)方法和生物信息學(xué)技術(shù)鑒定了假酸漿樣品中的病毒種類。從采集的病樣中克隆并獲得了2條菜豆金色花葉病毒屬病毒DNA-A全序列和1條beta衛(wèi)星全序列,經(jīng)全序列分析發(fā)現(xiàn),該雙生病毒的兩條DNA-A全序列與泰國(guó)番茄黃化曲葉病毒(tomato yellow leaf curl Thailand virus, TYLCTHV)云南分離物TYLCTHV-YN1732一致性最高,達(dá)99.3%,親緣關(guān)系較近;beta衛(wèi)星的全序列與云南番茄曲葉beta衛(wèi)星(tomato leaf curl Yunnan betasatellite, TLCYnB)的分離物YN5230一致性最高,達(dá)99.3%,親緣關(guān)系較近。重組分析顯示,假酸漿上分離的TYLCTHV-YN5735-12是一個(gè)重組病毒,有兩個(gè)重組事件,一個(gè)主要發(fā)生在AV1的編碼區(qū),由中國(guó)番茄黃化曲葉病毒(tomato yellow leaf curl China virus, TYLCCNV)和廣西大戟曲葉病毒(euphorbia leaf curl Guangxi virus, EuLCGXV) 重組形成,另一個(gè)重組事件主要發(fā)生在基因間隔區(qū)(IR區(qū)),由泰國(guó)煙草卷葉病毒(tobacco leaf curl Thailand virus, TbLCTHV)和TYLCTHV重組形成。研究結(jié)果表明,假酸漿是TYLCTHV的新寄主,這是單組分菜豆金色花葉病毒屬病毒及其伴隨beta衛(wèi)星侵染假酸漿的首次報(bào)道。
關(guān)鍵詞 假酸漿;?泰國(guó)番茄黃化曲葉病毒;?基因組特征;?重組
中圖分類號(hào): S 432.1
文獻(xiàn)標(biāo)識(shí)碼:?A
DOI:?10.16688/j.zwbh.2021666
Abstract Molecular detection and bioinformatics analysis were performed to determine whether Nicandra physalodes plants in Yunnan province displaying yellow and crumple symptoms were associated with begomovirus infections. Two complete begomovirus DNA-A molecules and one betasatellite molecule were obtained from infected samples. Sequence comparison revealed that the two DNA-A sequences shared the highest identity (99.3%) with the tomato yellow leaf curl Thailand virus (TYLCTHV) isolate TYLCTHV-YN1732, while the betasatellite shared the highest sequence identity (99.3%) with the tomato leaf curl Yunnan betasatellite (TLCYnB) isolate YN5230. Recombination analysis revealed that the begomovirus infecting Nicandra physalodes was a recombinant virus derived from two potential recombinant events. One recombination event was detected in the coding region of AV1, contributed by tomato yellow leaf curl China virus (TYLCCNV) and euphorbia leaf curl Guangxi virus (EuLCGXV). The other recombination event occurred mainly in the intergenic region (IR), with the two parents being tobacco leaf curl Thailand virus (TbLCTHV) and TYLCTHV. This study recorded Nicandra physalodes as a new host for TYLCTHV. This is the first report of a monopartite begomovirus in association with a betasatellite infecting Nicandra physalodes.
Key words Nicandra physalodes;?tomato yellow leaf curl Thailand virus;?genome organization;?recombination
煙粉虱Bemisia tabaci傳播的菜豆金色花葉病毒屬Begomovirus病毒是雙生病毒科Geminiviridae中種類最多、分布最廣、造成危害最嚴(yán)重的一類病毒[1]。按基因組結(jié)構(gòu)分為雙組分病毒和單組分病毒。雙組分病毒由兩條大小2.5~2.8 kb的DNA-A和DNA-B組成,單組分病毒只含有1條大小約為2.7 kb的基因組(DNA-A)。其全基因組含有6個(gè)開放閱讀框,正義鏈上的AV1和AV2基因分別編碼CP蛋白和Pre-CP蛋白,反義鏈上的AC1、AC2、AC3和AC4基因分別編碼Rep、TrAP、REn和參與病毒系統(tǒng)運(yùn)動(dòng)的蛋白[2]。單組分病毒通常與beta衛(wèi)星或與beta衛(wèi)星和alpha衛(wèi)星相伴隨復(fù)合侵染植物[3-4]。
Beta衛(wèi)星的基因組(DNAbeta)大小約為1.35 kb,是其輔助的病毒基因組大小的一半左右。DNAbeta保守區(qū)含有保守的9堿基序列“TAATATT↓AC”[5-6]。DNAbeta的一個(gè)開放閱讀框編碼βC1蛋白。βC1蛋白能夠引起典型的病毒侵染癥狀,并能提高所輔助病毒在寄主植物中的積累量[7]。2020年Hu 等[8]研究發(fā)現(xiàn),很多beta衛(wèi)星的病毒鏈還可編碼βV1蛋白,βV1蛋白有助于病毒的侵染。
泰國(guó)番茄黃化曲葉病毒(tomato yellow leaf curl Thailand virus, TYLCTHV)于1990年首次發(fā)現(xiàn)于泰國(guó)田間的番茄上[9]。其基因組由兩條大小均約為2.8 kb的DNA-A和DNA-B組成,是一種雙組分菜豆金色花葉病毒屬病毒[10-11]。2004年Li等在云南從表現(xiàn)為卷葉的番茄上發(fā)現(xiàn)的TYLCTHV是單組分病毒,有3個(gè)樣品還檢測(cè)到DNAbeta序列[12]。2007年Jan等首次在臺(tái)灣番茄上發(fā)現(xiàn)的TYLCTHV是雙組分病毒,但并未發(fā)現(xiàn)有衛(wèi)星DNA[13]。2009年Guo等在云南保山番茄上分離到的TYLCTHV是一種單組分病毒,并伴隨有beta衛(wèi)星[14]。2010年Shih等在臺(tái)灣從表現(xiàn)為卷葉、小泡、畸形、葉脈黃化和萎縮的辣椒上首次發(fā)現(xiàn)的TYLCTHV是雙組分病毒,但并未檢測(cè)到DNAbeta[15]。
假酸漿 Nicandra physalodes (L.) Gaertner 又名大千生、田珠、冰粉、水晶涼粉、藍(lán)花天仙子、鞭打繡球等,屬茄科Solanaceae假酸漿屬Nicandra。假酸漿原產(chǎn)于南美洲,在我國(guó)作為藥用或觀賞植物栽培,四川、云南、廣西等地均有分布,生于田邊、荒地、籬笆邊、屋院周圍,其全草可藥用,有鎮(zhèn)靜、祛痰、清熱解毒之效[16]。目前假酸漿上報(bào)道的病毒有番茄嚴(yán)重皺紋病毒(tomato severe rugose virus, ToSRV)[17]、馬鈴薯A病毒(potato virus A, PVA)[18]和苜蓿花葉病毒(alfalfa mosaic virus, AMV)[19],還未見其他病毒的報(bào)道。本研究采集了表現(xiàn)葉片黃化和皺縮的假酸漿病株,從中分離、鑒定出了菜豆金色花葉病毒屬病毒,并對(duì)分離到的病毒核苷酸序列進(jìn)行了比對(duì)和進(jìn)化重組分析。
1?材料與方法
1.1?樣品采集和DNA提取
2016年9月,在保山隴川縣戶撒阿昌族鄉(xiāng)對(duì)田間雙生病毒病害進(jìn)行調(diào)查時(shí)發(fā)現(xiàn),田間部分假酸漿植株表現(xiàn)出葉片黃化、皺縮等疑似雙生病毒侵染引起的典型癥狀(圖1),隨機(jī)采集病株的葉片編號(hào)為YN5735,采用CTAB法[20]提取病株葉片的總DNA。
1.2?假酸漿病樣的PCR檢測(cè)
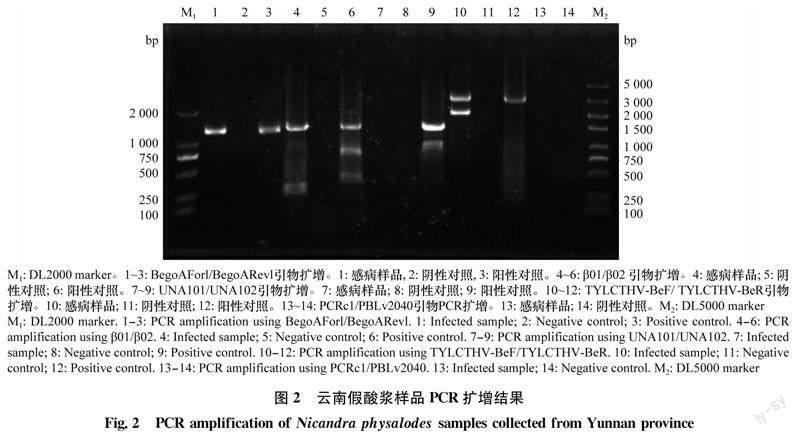
為了檢測(cè)病葉中是否含有菜豆金色花葉病毒屬病毒,分別利用該屬病毒DNA-A基因組部分序列的通用簡(jiǎn)并引物BegoAForl/BegoARevl[21]以及DNA-B通用簡(jiǎn)并引物PCRc1/PBLv2040[22]對(duì)假酸漿總DNA進(jìn)行PCR檢測(cè),同時(shí)利用beta和alpha衛(wèi)星DNA通用引物β01/β02[23]和UNA101/UNA102[24](表1)分別檢測(cè)是否含有病毒伴隨的衛(wèi)星DNA。
PCR反應(yīng)體系:10×PCR反應(yīng)緩沖液(含 Mg2+)2.5 μL,dNTPs(2.5 μmol/L)2 μL,上、下游引物(20 μmol/L)各0.5 μL,Taq Plus DNA 聚合酶(5 U/μL,上海申能博彩生物科技有限公司)0.5 μL,約100 ng總DNA,加雙蒸水至25 μL。擴(kuò)增條件:94℃預(yù)變性2 min;94℃變性45 s,50℃退火45 s,72℃延伸2 min,30個(gè)循環(huán);最后72℃延伸10 min。PCR產(chǎn)物經(jīng)1.0%瓊脂糖凝膠電泳檢測(cè)后割取目的片段,利用Axygen DNA凝膠回收試劑盒分離純化,回收PCR產(chǎn)物連接至pGEM-T Easy載體,再轉(zhuǎn)入大腸桿菌DH5α中,挑選陽(yáng)性克隆,送上海立菲生物技術(shù)有限公司測(cè)序。
1.3?假酸漿中菜豆金色花葉病毒屬病毒基因組克隆
為獲得高純度的菜豆金色花葉病毒屬病毒及其衛(wèi)星的基因組,采用Templiphi TM Kit(GE Healthcare)對(duì)假酸漿病樣總DNA進(jìn)行了滾環(huán)擴(kuò)增(rolling circle amplification,RCA)。具體步驟為:將1 μL植物總DNA樣品(約50 ng)加入到5 μL樣品緩沖液中,均勻混合后95℃變性3 min,立刻轉(zhuǎn)至冰上放置10 min;然后加入5 μL反應(yīng)緩沖液和0.2 μL酶(phi29 DNA聚合酶),30℃反應(yīng)18 h;最后65℃加熱10 min終止反應(yīng)。
根據(jù)測(cè)序后獲得的部分DNA-A序列,設(shè)計(jì)全長(zhǎng)引物TYLCTHV-BeF/TYLCTHV-BeR(表1)擴(kuò)增該病毒DNA-A基因組全長(zhǎng)序列。PCR反應(yīng)體系:2×PCR反應(yīng)緩沖液(含Mg2+)25 μL,dNTPs(2 μmol/L)10 μL,上、下游引物(20 μmol/L)各1 μL,KOD FX DNA聚合酶(1 U/μL,日本東洋紡)2 μL,RCA產(chǎn)物0.8 μL,加雙蒸水至50 μL。擴(kuò)增條件:94℃預(yù)變性2 min;94℃變性45 s,62℃退火45 s,72℃延伸3 min,30個(gè)循環(huán);72℃延伸10 min。按 1.2 中的方法進(jìn)行克隆測(cè)序。
1.4?假酸漿中病毒分離物基因組序列分析
采用DNASTAR Lasergene 7.1 對(duì)假酸漿中分離到的DNA-A及衛(wèi)星DNA的核苷酸序列進(jìn)行病毒基因組全序列拼接,利用DNAMAN 5.22 (Lynnon Biosoft, Quebec, Canada)和DNASTAR Lasergene 7.1 確定開放閱讀框(ORF)。獲得的全基因組序列采用BLAST(https:∥blast.ncbi.nlm.nih.gov/Blast)進(jìn)行核苷酸序列比較,選擇親緣關(guān)系較近、同屬代表種序列,利用SDT軟件進(jìn)一步進(jìn)行比較分析,根據(jù)SDT比較結(jié)果確定所分離病毒的分類地位[25],運(yùn)用MEGA 6軟件中的Clustal W方法進(jìn)行深入比對(duì)。采用MEGA 6軟件中的鄰近法(neighbor-joining)構(gòu)建進(jìn)化樹,可信度使用1 000次自導(dǎo)復(fù)制驗(yàn)證[26]。采用RDP 4.46軟件的默認(rèn)設(shè)置進(jìn)行序列的重組分析[27]。
2?結(jié)果與分析
2.1?假酸漿中菜豆金色花葉病毒屬病毒PCR檢測(cè)
利用DNA-B的簡(jiǎn)并引物PCRc1/PBLv2040對(duì)YN5735樣品進(jìn)行PCR擴(kuò)增,樣品中未擴(kuò)增到相應(yīng)條帶。以BegoAForl/BegoARevl為引物從YN5735樣品中擴(kuò)增到約1 200 bp的目的片段(圖2),將獲得的目的條帶進(jìn)行克隆,并選取2個(gè)陽(yáng)性克隆(YN5735-1、YN5735-6)測(cè)序。結(jié)果顯示:分離物序列與泰國(guó)番茄黃化曲葉病毒分離物的序列一致性高達(dá)99.2%,推測(cè)YN5735樣品被菜豆金色花葉病毒屬病毒侵染。
2.2?假酸漿中菜豆金色花葉病毒屬病毒全基因組結(jié)構(gòu)分析
2.2.1?TYLCTHV的鑒定及基因組結(jié)構(gòu)
以YN5735樣品的DNA為模板進(jìn)行RCA擴(kuò)增,再以RCA擴(kuò)增產(chǎn)物作為模板,利用TYLCTHV-BeF/TYLCTHV-BeR擴(kuò)增病毒全長(zhǎng)序列,篩選獲得2個(gè)陽(yáng)性克隆YN5735-12和YN5735-15,經(jīng)測(cè)序、分析發(fā)現(xiàn)2個(gè)克隆的基因組序列一致性為100%,選擇YN5735-12進(jìn)行進(jìn)一步分析。
基因組結(jié)構(gòu)分析顯示:TYLCTHV-YN5735-12(GenBank 登錄號(hào):MF040760)全長(zhǎng)2 738 bp,其基因組結(jié)構(gòu)具有典型的單組分雙生病毒結(jié)構(gòu),編碼6個(gè)開放閱讀框,其AV1(293—1 063 nt)、AV2(133—471 nt)、AC1(1 512—2 597 nt)、AC2(1 205—1 609 nt)、AC3(1 060—1 464 nt)和AC4(2 147—2 446 nt),其基因間隔區(qū)(intergenic region,IR)包含273 bp(2 598—132 nt),在該區(qū)域內(nèi)含有菜豆金色花葉病毒屬病毒復(fù)制和轉(zhuǎn)錄所必需的相關(guān)結(jié)構(gòu)。
2.2.2?TYLCTHV全基因組相似性比較
運(yùn)用SDT軟件進(jìn)行相似性分析,發(fā)現(xiàn)TYLCTHV-YN5735-12分離物的DNA-A全長(zhǎng)序列與參與比對(duì)的TYLCTHV分離物的一致性均在91.0%以上,并且與云南分離物TYLCTHV-YN1732(登錄號(hào):KX290922)的一致性達(dá)到99.3%(表2)。
根據(jù)菜豆金色花葉病毒屬病毒的分類標(biāo)準(zhǔn):DNA-A的核苷酸一致性大于91.0%則認(rèn)為是同種病毒,同種成員間的核苷酸一致性小于94.0%則表示這些成員屬于不同的株系,大于94.0%則屬于同一株系[28]。因此,假酸漿樣品中分離到的菜豆金色花葉病毒屬病毒是泰國(guó)番茄黃化曲葉病毒的一個(gè)分離物(TYLCTHV-YN5735-12)。與TYLCTHV-YN1732為同一株系。運(yùn)用MegAlign軟件進(jìn)一步分析TYLCTHV-YN5735-12分離物DNA-A序列與其他菜豆金色花葉病毒屬病毒的相似性,發(fā)現(xiàn)TYLCTHV-YN5735-12的編碼區(qū)和非編碼區(qū),除AV2的氨基酸序列外,IR區(qū)、AV1、AC1、AC2、AC3和AC4的核苷酸和氨基酸序列均與TYLCTHV-YN1732的一致性最高,達(dá)97.1%~100.0%(表2)。
2.2.3?TYLCTHV全基因組進(jìn)化與重組分析
選擇與TYLCTHV-YN5735-12一致性較高的菜豆金色花葉病毒屬病毒序列進(jìn)行系統(tǒng)進(jìn)化分析,發(fā)現(xiàn)所有TYLCTHV的DNA-A分離物都聚為1個(gè)大分支,TYLCTHV-YN5735-12與云南分離物TYLCTHV-YN1732聚為一個(gè)小分支,與緬甸分離物TYLCTHV-TLCV-MM聚于一個(gè)稍大的分支,表明本研究分離到的分離物與TYLCTHV-YN1732和TYLCTHV-TLCV-MM親緣關(guān)系較近(圖3)。
重組分析顯示,RDP、GENECONV、BootScan、MaxChi、Chimaera、SiScan和3Seq 7種分析方法都能檢測(cè)到兩個(gè)重組事件發(fā)生,一個(gè)重組事件主要發(fā)生在AV1編碼區(qū),起始位置為510 nt,結(jié)束位置為1 056 nt,其主要親本為TYLCCNV-Y11,次要親本為EuLCGXV-G35-1(RDP 值:3.44×10-15;GENECONV值:2.754×10-8;BootScan值:4.687×10-14;MaxChi值:6.055×10-12;Chimaera值:3.162×10-11;SiScan值:9.520×10-11;3Seq值:1.414×10-13)。另一個(gè)重組事件主要發(fā)生在基因間隔區(qū)(IR區(qū)),起始位置為2 704 nt,結(jié)束位置為58 nt,其主要親本為 TbLCTHV-KKN-13G,次要親本為TYLCTHV-WF-SPN-Tom2015(RDP 值:2.289×10-12;GENECONV值:3.765×10-14;BootScan值:1.430×10-5;MaxChi值:3.157×10-5;Chimaera值:1.258×10-3;SiScan值:2.762×10-10;3Seq值:2.602×10-7)。根據(jù)RDP分析方法的判斷標(biāo)準(zhǔn),為了保證RDP分析結(jié)果的可靠性,每個(gè)方法所得P值需小于0.05且至少有3個(gè)方法都檢測(cè)到同一重組事件才認(rèn)為有重組事件發(fā)生[27,29],由此可見,TYLCTHV-YN5735-12是一個(gè)重組病毒。
2.3?病毒伴隨的衛(wèi)星DNA分子結(jié)構(gòu)及其進(jìn)化重組分析
alpha衛(wèi)星DNA通用引物UNA101/UNA102(表1)未能從YN5735樣品中擴(kuò)增到相應(yīng)條帶。利用beta衛(wèi)星DNA通用引物β01/β02(表1)擴(kuò)增到約1 300 bp的目的片段。經(jīng)克隆測(cè)序后得到一條beta衛(wèi)星序列(YN5735-42),其具有典型的單組分病毒伴隨性beta衛(wèi)星的基因組結(jié)構(gòu):在反義鏈的212—592 nt位置編碼一個(gè)βC1蛋白,包含一個(gè)衛(wèi)星保守區(qū)(satellite conserved region,SCR),位于1 221—1 360 nt,1—10 nt,一個(gè)A富含區(qū)(A-rich),位于891—977 nt,A含量達(dá)67.8%。
經(jīng)SDT比對(duì),YN5735-42與云南番茄曲葉beta衛(wèi)星分離物TLCYnB-YN5230(登錄號(hào):MF461727)一致性最高,達(dá)99.3%,與其他云南番茄曲葉beta衛(wèi)星分離物的一致性在92.3%以上,與其他病毒beta衛(wèi)星分離物的一致性在78.0%以下(表3)。根據(jù)ICTV beta衛(wèi)星分子的分類標(biāo)準(zhǔn):全序列核苷酸一致性小于78.0%則認(rèn)為是新beta衛(wèi)星,大于78.0%則認(rèn)為屬于同一種beta衛(wèi)星[30]。上述結(jié)果表明假酸漿上分離得到的beta衛(wèi)星DNA屬于TLCYnB,命名為TLCYnB-YN5735-42。
系統(tǒng)進(jìn)化樹分析表明,YN5735-42與TLCYnB的其他幾個(gè)分離物均聚在一個(gè)較小的分支上,親緣關(guān)系較近,且這些beta衛(wèi)星DNA都是從云南分離獲得的(圖4),具有明顯的地理分布特征。表明保山隴川假酸漿上分離得到的TYLCTHV有beta衛(wèi)星伴隨。
重組分析發(fā)現(xiàn),TLCYnB-YN5735-42有兩個(gè)重組事件,一個(gè)重組事件的起始位置為418 nt,結(jié)束位置為558 nt,其主要親本為CLCuMuB-BH12,次要親本為CLCuBuB-LG-RCA-bI-r(GENECONV值:2.904×10-8;MaxChi值:6.289×10-3;SiScan值:2.292×10-19)。另一個(gè)重組事件的起始位置為906 nt,結(jié)束位置為1 322 nt,其主要親本為TYLCCNB-G32,次要親本為CLCuBuB-C-32(RDP 值:4.300×10-11;MaxChi值:2.582×10-5;Chimaera值:3.687×10-5;SiScan值:9.420×10-18;3Seq值:1.239×10-4)。根據(jù)RDP分析方法的判斷標(biāo)準(zhǔn)[27],TLCYnB-YN5735-42是一個(gè)重組beta衛(wèi)星。
3?結(jié)論與討論
本研究從表現(xiàn)黃化、皺縮的假酸漿樣品中分離到泰國(guó)番茄黃化曲葉病毒,利用分子檢測(cè)方法和生物信息學(xué)技術(shù)對(duì)該病毒進(jìn)行分析,結(jié)果表明,該病毒與云南番茄曲葉beta衛(wèi)星相伴隨,這是假酸漿上泰國(guó)番茄黃化曲葉病毒伴隨云南番茄曲葉beta衛(wèi)星的首次報(bào)道。
TYLCTHV剛發(fā)現(xiàn)時(shí)被認(rèn)為是一種雙組分病毒[10-11],后來(lái)發(fā)現(xiàn),TYLCTHV既是一種單組分病毒,也是一種雙組分病毒,單組分TYLCTHV主要在中國(guó)云南[12,14]和緬甸的番茄上發(fā)現(xiàn)[31-32],雙組分TYLCTHV主要在泰國(guó)、中國(guó)南部[33]、越南、柬埔寨和中國(guó)臺(tái)灣[13]一些地區(qū)的番茄、辣椒、甜椒[15]和煙粉虱[34]上發(fā)現(xiàn)。在研究雙組分病毒斯里蘭卡木薯花葉病毒(Sri Lankan cassava mosaic virus, SLCMV)時(shí),發(fā)現(xiàn)其DNA-A具有單組分begomovirus病毒的生物學(xué)特征,其DNA-B可能是從與其共同侵染木薯的印度木薯花葉病毒(Indian cassava mosaic virus, ICMV)中獲得的DNA-B組分進(jìn)化而來(lái),因此SLCMV被認(rèn)為是從單組分到雙組分病毒進(jìn)化的中間體[35-36]。綜上所述,一些單組分雙生病毒在田間具有捕獲DNA-B組分的能力,從而變成雙組分雙生病毒。2009年Guo等[14]研究表明,泰國(guó)的TYLCTHV DNAbeta是由單組分病毒從另一個(gè)雙組分begomovirus病毒中獲取DNA-B進(jìn)化而來(lái)的。TYLCTHV可能代表了介于多數(shù)類型和少數(shù)類型之間的進(jìn)化中間體[14]。
突變和重組是菜豆金色花葉病毒屬病毒進(jìn)化的主要?jiǎng)恿Γ亟M能夠?qū)е虏硕菇鹕ㄈ~病毒屬病毒產(chǎn)生新種和新分離物[29]。菜豆金色花葉病毒屬病毒復(fù)合侵染容易造成該屬病毒之間重組,從而可能擴(kuò)大寄主范圍,造成更加嚴(yán)重的危害[37]。之前對(duì)雙生病毒重組熱點(diǎn)的研究發(fā)現(xiàn),病毒重組通常發(fā)生于IR區(qū),但也有報(bào)道CP、AV2、AC1、AC4和BC1基因也存在潛在的重組位點(diǎn)[38-39]。本研究發(fā)現(xiàn)的TYLCTHV-YN5735-12分離物有兩個(gè)重組區(qū)域,一個(gè)主要發(fā)生在IR區(qū)(2 704—58 nt),其主要親本為在泰國(guó)辣椒上分離得到的TbLCTHV-KKN-13G,次要親本為在泰國(guó)煙粉虱上分離得到的TYLCTHV-WF-SPN-Tom2015,說(shuō)明本研究分離得到的TYLCTHV很有可能是由泰國(guó)的煙粉虱傳過(guò)來(lái)的。另一個(gè)重組事件主要發(fā)生在AV1編碼區(qū)(510—1 056 nt),其主要親本為中國(guó)云南煙草上分離得到的TYLCCNV-Y11,次要親本為中國(guó)廣西一品紅上分離得到的EuLCGXV-G35-1,由此可以看出,本研究分離得到的TYLCTHV-YN5735-12的重組親本可能與地理位置有一定的關(guān)系。本研究獲得的TLCYnB-YN5735-42分離物有兩個(gè)重組事件,一個(gè)位于βC1的編碼區(qū)(418—558 nt),其主要親本為在巴基斯坦旁遮普棉花上分離得到的CLCuMuB-BH12,次要親本為在印度旁遮普棉花上分離到的CLCuBuB-LG-RCA-bI-r;另一個(gè)位于SCR區(qū)及A-rich區(qū)(906—1 322 nt),其主要親本為在中國(guó)廣西番茄上分離到的TYLCCNB-G32,次要親本為在巴基斯坦費(fèi)薩拉巴德棉花上分離到的CLCuBuB-C-32。
目前泰國(guó)番茄黃化曲葉病毒的寄主主要有番茄、辣椒、甜椒和煙粉虱,暫還未有其他寄主的報(bào)道。目前假酸漿上分離的病毒很少,尤其是雙生病毒只有番茄嚴(yán)重皺紋病毒,此病毒是一種雙組分雙生病毒[18],本研究發(fā)現(xiàn)的TYLCTHV是一種單組分病毒,說(shuō)明單組分和雙組分菜豆金色花葉病毒屬病毒均可侵染假酸漿。因此我們還應(yīng)該擴(kuò)大雙生病毒在觀賞植物和藥用植物上的監(jiān)測(cè),這樣才能更有效地預(yù)防雙生病毒病的危害。
參考文獻(xiàn)
[1]?VARMA A, MALATHI V G. Emerging geminivirus problems: a serious threat to crop production [J]. Annals of Applied Biology, 2015, 142(2): 145-164.
[2]?楊秀玲.中國(guó)番茄黃曲葉病毒抵御RNA沉默的機(jī)制和番茄黃曲葉病毒的分子變異研究[D]. 杭州: 浙江大學(xué), 2011.
[3]?ZHAO Liling, ZHONG Jing, ZHANG Xiaoyun, et al. Two distinct begomoviruses associated with an alphasatellite coinfecting Emilia sonchifolia in Thailand [J]. Archives of Virology, 2018, 163(6):1695-1699.
[4]?TAHIR M N, HAMEED A, AMIN I, et al. Characterization of a begomovirus-betasatellite complex, producing defective molecules in spinach (Spinacia Oleracea L.), a new host for begomovirus and betasatellite complex in Pakistan [J]. The Plant Pathology Journal, 2017, 33(5): 514-521.
[5]?CUI Xiaofeng, TAO Xiaorong, XIE Yan, et al. A DNAβ associated with tomato yellow leaf curl China virus is required for symptom induction [J]. Journal of Virology, 2004, 78(24): 13966-13974.
[6]?ZHOU Xueping, XIE Yan, TAO Xiaorong, et al. Characterization of DNAβ associated with begomoviruses in China and evidence for co-evolution with their cognate viral DNA-A [J]. Journal of General Virology, 2003, 84(1): 237-247.
[7]?TAHIR M N, MANSOOR S. βC1 of chili leaf curl betasatellite is a pathogenicity determinant [J/OL]. Virology Journal, 2011, 8(1): 509. DOI: 10.1186/1743-422X-8-509.
[8]?HU Tao, SONG Yu, WANG Yaqing, et al. Functional analysis of a novel βV1 gene identified in a geminivirus betasatellite [J]. Science China Life Sciences, 2020, 63(5): 688-696.
[9]?ATTATHOM S, CHIEMSOMBAT P, SUTABUTRA T, et al. Characterization of nucleic acid of tomato yellow leaf curl virus [J]. Kasetsart Journal, Natural Sciences, 1990, 24 (5): 1-5.
[10]ATTATHOM S, CHIEMSOMBAT P, KOSITRATANA W, et al. Complete nucleotide sequence and genome analysis of bipartite tomato yellow leaf curl virus in Thailand [J]. Kasetsart Journal, Natural Sciences, 1994, 28(4): 632-639.
[11]ROCHESTER D E, DEPAULO J J, FAUQUET C M, et al. Complete nucleotide sequence of the geminivirus tomato yellow leaf curl virus, Thailand isolate [J]. Journal of General Virology, 1994, 75(3): 477-485.
[12]LI Zhenghe, ZHOU Xueping, ZHANG Xiongwen, et al. Molecular characterization of tomato-infecting begomoviruses in Yunnan, China [J]. Archives of Virology, 2004, 149(9): 1721-1732.
[13]JAN F J, GREEN S K, SHIH S L, et al. First report of tomato yellow leaf curl Thailand virus in Taiwan [J]. Plant Disease, 2007, 91(10): 1363.
[14]GUO Wei, YANG Xiuling, XIE Yan, et al. Tomato yellow leaf curl Thailand virus-[Y72]from Yunnan is a monopartite begomovirus associated with DNAbeta [J]. Virus Genes, 2009, 38(2): 328-333.
[15]SHIH S L, TSAI W S, LEE L M, et al. First report of tomato yellow leaf curl Thailand virus associated with pepper leaf curl disease in Taiwan [J]. Plant Disease, 2010, 94(5): 637.
[16]中國(guó)科學(xué)院中國(guó)植物志編輯委員會(huì). 中國(guó)植物志: 第67卷第一分冊(cè)[M]. 北京: 科學(xué)出版社, 1978: 6-8.
[17]BARBOSA J C, BARRETO S S, INOUE-NAGATA A K, et al. Natural infection of Nicandra physaloides by tomato severe rugose virus in Brazil [J]. Journal of General Plant Pathology, 2009, 75(6): 440-443.
[18]RAJAMAEKI M L, VALKONEN J. The 6K2 protein and the VPg of potato virus A are determinants of systemic infection in Nicandra physaloides [J]. Molecular Plant Microbe Interaction, 1999, 12(12): 1074-1081.
[19]GALLO J, CIAMPOR F. Transmission of alfalfa mosaic virus through Nicandra physaloides seeds and its localization in embryo cotyledons [J]. Acta Virologica, 1977, 21(4): 344-346.
[20]DOYLE J J, DOYLE J L, DOYLE J A, et al. A rapid DNA isolation procedure for small quantities of fresh leaf tissue [J]. Phytochemical Bulletin, 1987, 19(1): 11-15.
[21]HA C, COOMBS S, REVILL P, et al. Corchorus yellow vein virus, a New World geminivirus from the Old World [J]. Journal of General Virology, 2006, 87(4): 997-1003.
[22]ROJAS M R, GILBERTSON G L, RUSSELL D R, et al. Use of degenerate primers in the polymerase chain reaction to detect whitefly-transmitted geminiviruses [J]. Plant Disease, 1993, 77(4): 340-347.
[23]BRIDDON R W, BULL S E, MANSOOR S, et al. Universal primers for the PCR-mediated amplification of DNAβ a molecule associated with some monopartite begomoviruses [J]. Molecular Biotechnology, 2002, 20(3): 315-318.
[24]BULL S E, BRIDDON R W, MARKHAM P G. Universal primers for the PCR-mediated amplification of DNA 1: a satellite-like molecule associated with begomovirus-DNAβ complexes [J]. Molecular Biotechnology, 2003, 23(1): 83-86.
[25]MUHIRE B M, VARSANI A, MARTIN D P. SDT: a virus classification tool based on pairwise sequence alignment and identity calculation [J/OL]. PLoS ONE, 2014, 9(9): e108277. DOI:10.1371/journal.pone.0108277.
[26]TAMURA K, STECHER G, PETERSON D, et al. MEGA 6: molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 2013, 30(12): 2725-2729.
[27]MARTIN D P, LEMEY P, LOTT M, et al. RDP 3: a flexible and fast computer program for analyzing recombination [J]. Bioinformatics, 2010, 26(19): 2462-2463.
[28]BROWN J K, ZERBINI F M, NAVAS-CASTILLO J, et al. Revision of begomovirus taxonomy based on pairwise sequence comparisons [J]. Archives of Virology, 2015, 160(6): 1593-1619.
[29]趙麗玲, 施章吉, 李婷婷, 等. 野茼蒿黃脈病毒的田間寄主范圍及其基因多樣性特征[J]. 植物保護(hù)學(xué)報(bào), 2020, 47(3): 647-656.
[30]BROWN J K, FAUQUET C M, BRIDDON R W, et al. Virus taxonomy: Ninth report of the international committee on taxonomy of viruses [M]. San Diego: Elsevier Academic Press, 2012: 351-373.
[31]GREEN S K, TSAI W S, SHIH S L, et al. Molecular characterization of begomoviruses associated with leaf curl diseases of tomato in Bangladesh, Laos, Malaysia, Myanmar, and Vietnam [J]. Plant Disease, 2001, 85(12): 1286.
[32]KENYON L, TSAI W S, SHIH S L, et al. Emergence and diversity of begomoviruses infecting solanaceous crops in East and Southeast Asia [J]. Virus Research, 2014, 186: 104-113.
[33]SEEPIBAN C, CHAROENVILAISIRI S, WARIN N. Development and application of triple antibody sandwich enzyme-linked immunosorbent assays for begomovirus detection using monoclonal antibodies against tomato yellow leaf curl Thailand virus [J/OL]. Virology Journal, 2017, 14(1): 99. DOI: 10.1186/s12985-017-0763-2.
[34]YULE S, CHIEMSOMBAT P, SRINIVASAN R. Detection of tomato yellow leaf curl Thailand virus transmitted by Bemisia tabaci Asia I in tomato and pepper [J]. Phytoparasitica, 2019, 47(5): 143-153.
[35]BLAWID R, VAN D T, MAISS E. Transreplication of a tomato yellow leaf curl Thailand virus DNA-B and replication of a DNA component by tomato leaf curl Vietnam virus and tomato yellow leaf curl Vietnam virus [J]. Virus Research, 2008, 136(1/2): 107-117.
[36]SAUNDERS K, SALIM N, MALI V R, et al. Characterisation of Sri Lankan cassava mosaic virus and Indian cassava mosaic virus: evidence for acquisition of a DNA B component by a monopartite begomovirus [J]. Virology, 2002, 293(1): 63-74.
[37]趙麗玲, 鐘靜, 施章吉, 等. 復(fù)合侵染水茄的兩種菜豆金色花葉病毒屬病毒基因組結(jié)構(gòu)特征分析[J]. 植物保護(hù)學(xué)報(bào), 2020, 47(2): 355-364.
[38]郭維. 三種雙生病毒及其伴隨衛(wèi)星DNA的致病性研究[D]. 杭州: 浙江大學(xué), 2008.
[39]鐘靜, 趙麗玲, 尹躍艷, 等. 一種侵染鱧腸的雙生病毒基因組特征[J]. 植物病理學(xué)報(bào), 2017, 47(4): 479-486.
(責(zé)任編輯:楊明麗)

