枯草芽胞桿菌GB519在水稻植株中的定殖及對稻瘟病田間防效
祁山顏 朱峰 王繼春 田成麗 王東元 歐玉蘋 劉曉梅 李莉 姜兆遠
摘要 枯草芽胞桿菌GB519是一株具有廣譜抑菌活性的生防菌株。本研究利用綠色熒光蛋白標記的菌株GB519-GFP處理水稻種子、根和葉片,結合激光共聚焦顯微鏡觀察和抗生素平板回收檢測的方法,探究其在水稻根莖葉中的定殖動態。結果顯示:經GB519-GFP發酵液處理水稻種子、根和葉片后,菌株均可內生定殖于植株的表皮、皮層和維管束中,表明其可在水稻植株內遷移和定殖。GB519-GFP在處理部位的定殖量通常呈現先減少后增多的趨勢,非處理部位3~5 d后即可檢測到標記菌株。浸種處理,3 d后在幼芽中可檢測到標記菌株;20 d后在根中的菌量最多,達5.7×105 cfu/g。灌根處理,1 d后根中菌量為5.4×105 cfu/g;20 d后根、莖和葉中菌量均達到最大值;處理80 d后,根中定殖數量仍達1.9×105 cfu/g。葉面噴施處理,1 d后葉片菌量為4.2×105 cfu/g;20 d后葉片菌量達4.4×105 cfu/g。不同處理方法在各部位的定殖量幾乎均在處理20 d后達到峰值。采用葉面噴施GB519對稻瘟病穗頸瘟的田間防效達73.9%,表明葉面噴施GB519能夠起到防控稻瘟病的作用。本研究為使用枯草芽胞桿菌GB519防控水稻稻瘟病提供指導。
關鍵詞 枯草芽胞桿菌GB519;?GFP;?定殖動態;?稻瘟病;?防效
中圖分類號: S 476
文獻標識碼:?A
DOI:?10.16688/j.zwbh.2021719
Abstract Bacillus subtilis GB519 displays antimicrobial activity in a broad spectrum. In this study, the GFP-labeled strain, GB519-GFP was used to explore its colonization dynamics in rice plants via both the laser confocal microscope observation and antibiotic plate recovery. The strain GB519-GFP could colonize the epidermis, cortex and vascular bundle after seed-soaking, root-irrigating or foliar-spray with the fermentation broth. These results indicated that it could migrate and colonize in rice plants. In general, the colonization quantity of GB519-GFP first decreased and then increased in the treated part, and it could be detected in the untreated part after 3-5 days. The GFP-labeled strain was detected in the bud three days after seed-soaking and the maximum amount of colonization reached 5.7×105 cfu/g in the root after 20 d. The amount of colonization in the root was 5.4×105 cfu/g one day after root-irrigating. The amount reached the maximum value in the root, stem and leaf after 20 d, and remained at 1.9×105 cfu/g in the root after 80 d. The colonization was 4.2×105 cfu/g in the leaves one day after foliar-spray, and reached 4.4×105 cfu/g after 20 d. The amounts of colonization in different tissues reached the peak 20 d after treated. The control efficacy of GB519 against rice blast was 73.9% in the field by foliar-spray. It indicated that foliar spraying with GB519 could play a role in preventing rice blast. This study provides a guidance for the control of rice blast by B.subtilis GB519.
Key words Bacillus subtilis GB519;?GFP;?colonization dynamics;?rice blast;?control efficacy
隨著人們生活品質的提高,對糧食質量愈發關注,綠色有機食品成為大眾的廣泛需求,而環保、低毒的生物防治方法成為生產綠色有機食品的重要措施[1]。枯草芽胞桿菌Bacillus subtilis是研究與應用較為廣泛的生防菌之一,能促進植物生長和防治植物病害,提高養分利用率和改變植物激素水平,產生抗菌物質和觸發誘導抗性等[2]。同時,枯草芽胞桿菌具有持久高效的活性,能夠形成抗逆性強的芽胞,有利于制劑的研發和保存,是生防菌劑開發利用的重要組成部分[3]。
生防菌能否定殖決定了其生防效果,研究生防菌的定殖模式不僅可以揭示它的微生態特征,也有助于評估其適應性和活性的穩定性[4]。生防菌防效的優劣與其能否定殖及定殖能力強弱呈正相關[5-6]。因此,科學地施用生防菌,對提高其在植物中的定殖能力和防效具有重要意義[7]。利用抗生素標記菌株是探究生防菌定殖的最早方法,但該標記法不能區分出抗性相同的其他微生物[8]。綠色熒光蛋白(GFP)標記的菌株因其易于檢測、靈敏度高、穩定性好且可以精準定位,相關的研究越來越多[9]。Liu等[10]研究發現枯草芽胞桿菌定殖位點較集中,主要聚集在水稻表皮、外皮層和維管束中。沙月霞等[11]將貝萊斯芽胞桿菌Bacillus velezensis E69菌懸液噴施于水稻,發現其能夠從表皮進入水稻, 向薄壁組織和中央維管束擴展。
東北大米晶瑩剔透、入口潤甜,深受國人喜愛,但北方水稻稻瘟病防控中化學藥劑仍然占主導地位,低毒綠色防控替代品一直在探索中。水稻稻瘟病菌通常以菌絲體或分生孢子在感病稻草上越冬,次年在溫濕度適宜時產生分生孢子,分生孢子借風傳播侵染植株葉片和穗頸部位,發生稻瘟病造成危害。GB519菌株是從吉林省稻區分離獲得的一株枯草芽胞桿菌,經過試驗證實對稻瘟病等多種植物病原菌表現出抑菌效果[12-13]。為了為實踐應用提供有效的使用方式,本研究檢測了綠色熒光蛋白標記的菌株GB519-GFP在不同處理水稻植株中的定殖動態,明確其定殖能力;并結合稻瘟病菌侵染時期和方式,采用葉面噴施GB519開展防控水稻稻瘟病試驗。本研究可為闡釋枯草芽胞桿菌 GB519 在水稻植株中的定殖規律和指導防控提供依據。
1?材料與方法
1.1?試驗材料
枯草芽胞桿菌Bacillus subtilis GB519和GB519-GFP由吉林省農業科學院植物保護研究所水稻病害綜合防控團隊篩選、鑒定、構建并保存。供試水稻品種為‘吉粳88,種子由吉林省農業科學院水稻研究所提供。
LB培養基:酵母粉5.0 g,蛋白胨10.0 g,NaCl 10.0 g,補水至1 000 mL,調pH 7.0~7.2。固體培養基在LB基礎上添加20.0 g瓊脂粉。
對照藥劑:75%肟菌·戊唑醇水分散粒劑(WG),由拜耳作物科學(中國)有限公司生產。
1.2?菌株GB519/GB519-GFP發酵液制備
超低溫保存的GB519和GB519-GFP菌株經平板活化后,挑取單菌落于50 mL的LB培養液中,37℃、150 r/min培養12 h,再按5%接種量接種到LB培養液中(150 mL/500 mL三角瓶),30℃、150 r/min培養48 h后備用。
1.3?激光共聚焦顯微觀察與菌株GB519-GFP的菌落數量測定
將水稻目標組織制成臨時切片,用激光共聚焦顯微鏡(Leica TCS SP8)在波長488 nm處觀察菌株GB519-GFP在水稻組織中的定殖位點和擴展遷移方向。
菌株GB519-GFP的菌落數量測定參考Sorokan等[14]的方法。樣品先在75%乙醇中浸泡3 min,再用蒸餾水沖洗3~5次,分別稱取1 g根、莖、葉片組織,用預冷研缽研磨成勻漿,并加入100 mL無菌水,稀釋10倍后,分別吸取100 μL稀釋液均勻涂布于LB平板(含5 μg/mL氯霉素),無菌水作為對照,48 h后統計菌落數量。在激光共聚焦顯微鏡下觀察菌落是否出現綠色熒光,出現綠色熒光的為GB519-GFP菌株。
1.4?菌株GB519-GFP處理在水稻根、莖、葉部的定殖動態
1.4.1?GB519-GFP浸種處理
根據Wang等[4]的方法,水稻種子經表面消毒后置于濾紙保濕的培養皿中,30℃催芽40 h至露白。將露白的種子置于新培養的GB519-GFP發酵液(1×108 cfu/mL)中浸泡24 h后播種于直徑10 cm的營養缽(自然黑土占67%,草炭基質占33%)中,每缽播種50粒種子。以培養液浸泡的種子為對照。置于溫室中培養。分別于浸種處理后第1、3、5、7、14、20、30、40、60天和第80天,從每缽中隨機取5株植株,共25株作為1個重復,3次重復。采用非丟棄取樣法,將25株植株的根、莖、葉片組織分別混合后,進行激光共聚焦顯微觀察和統計菌株GB519-GFP的菌落數量,處理方法同1.3。
1.4.2?GB519-GFP灌根處理
參照楊珍福等[15]的方法。水稻種子經表面消毒后播種于直徑10 cm的營養缽(自然黑土占67%,草炭基質占33%)中,每缽播種50粒種子。播種14 d后,用GB519-GFP發酵液(1×108 cfu/mL)灌根處理(5 mL發酵液/株),以培養液灌根作為對照。分別在處理后第1、3、5、7、14、20、30、40、60天和第80天,采用非丟棄取樣法,將25株植株的根、莖、葉片組織分別混合后,進行熒光檢測和涂板檢測菌落數量,處理方法同1.3。
1.4.3?GB519-GFP噴施葉面處理
參照Sha等[16]的方法,水稻種子經表面消毒后,播種于直徑10 cm的營養缽(自然黑土占67%,草炭基質占33%)中,每缽播種50粒種子。在播種后45 d,將葉片以下組織及營養缽用保鮮膜包裹,使植株呈倒立狀,再將GB519-GFP發酵液(1×108 cfu/mL)均勻噴施葉片(20 mL發酵液/缽),以噴施培養液作為對照。分別在處理后第1、3、5、7、14、20、30、40、60天和第80天,采用非丟棄取樣法,將25株植株的根、莖、葉片組織分別混合后,進行熒光檢測和涂板檢測菌落數量,處理方法同1.3。
1.5?菌株GB519葉面噴施防控稻瘟病
在吉林省梨樹縣試驗地連續2年(2020年和2021年)進行田間試驗,該地為水稻病害常發區。水稻品種為‘吉粳88。設菌株GB519(1×108 cfu/mL)、75%肟菌·戊唑醇WG (15 g/667 m2)和清水對照3個處理,每667 m2按50 L水量均勻噴霧。小區處理面積100 m2,每處理5次重復,小區隨機排列。在水稻抽穗前7月25日和齊穗期8月10日各施藥1次。9月中旬調查穗莖瘟,每小區5點取樣法,每點20穴,共100穴。穗莖瘟級別參照Meng等[17]的方法,病情指數和防治效果按下列公式計算。
病情指數=∑(各級發病數×各級代表值)/(調查總穗數×最高級代表值)×100;
防治效果=[(對照病情指數-處理病情指數)/對照病情指數)]×100%。
1.6?數據統計與分析
采用軟件SPSS 26中單因素方差分析檢驗處理間是否存在顯著性差異,采用Duncan氏新復極差法進行多重比較。顯著水平設為α=0.05。
2?結果與分析
2.1?浸種處理后GB519-GFP在水稻植株中的定殖
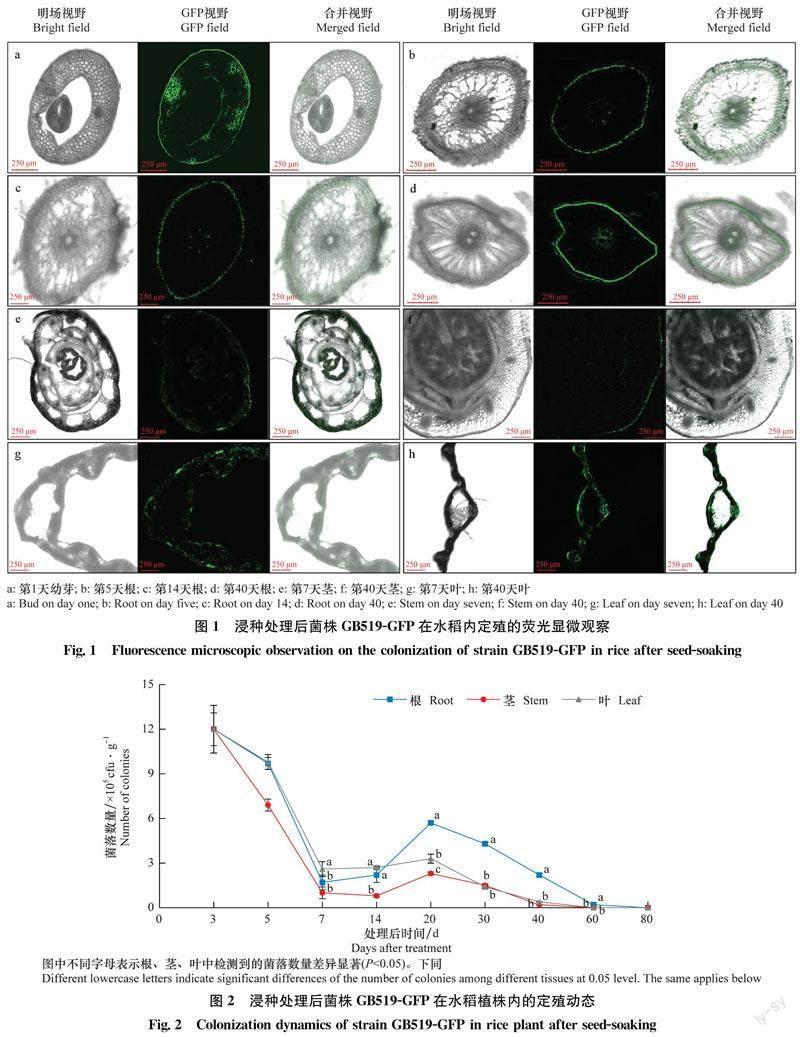
GB519-GFP發酵液浸種處理后1 d,從水稻種子未分化的嫩芽中就可以檢測到明顯的綠色熒光,均勻地分布于表皮和海綿薄壁組織的細胞間隙中(圖1a)。處理后5、14 d和40 d,從根的表皮、皮層和維管束中可分別檢測到明顯的綠色熒光(圖1b, c, d)。處理后7 d和40 d,從莖和葉中均能檢測到綠色熒光(圖1e, f, g, h),說明浸種處理的標記菌株已經在不同部位定殖。
菌株GB519-GFP浸種處理后,其在水稻植株中定殖數量的變化情況如圖2所示。處理后20 d,根中定殖的菌株GB519-GFP的數量極顯著高于莖和葉中的數量。處理后3 d,幼芽中檢測到菌落數量為12.0×105 cfu/g,說明通過浸種處理有大量標記菌株進入水稻種子中。隨著植株生長發育,菌株通過遷移擴展定殖于新生組織中,7~20 d各部位菌落數量的變化均趨于平緩。20 d時各部位菌落數量達到最高峰,其中根中的含菌量最多,為5.7×105 cfu/g。20~80 d各部位定殖量呈現遞減趨勢,處理后60 d,根中的定殖數量為0.2×105 cfu/g,莖和葉中未檢測到菌株;80 d在各個部位都沒有檢測到菌株存在。
2.2?灌根處理后GB519-GFP在水稻植株中的定殖
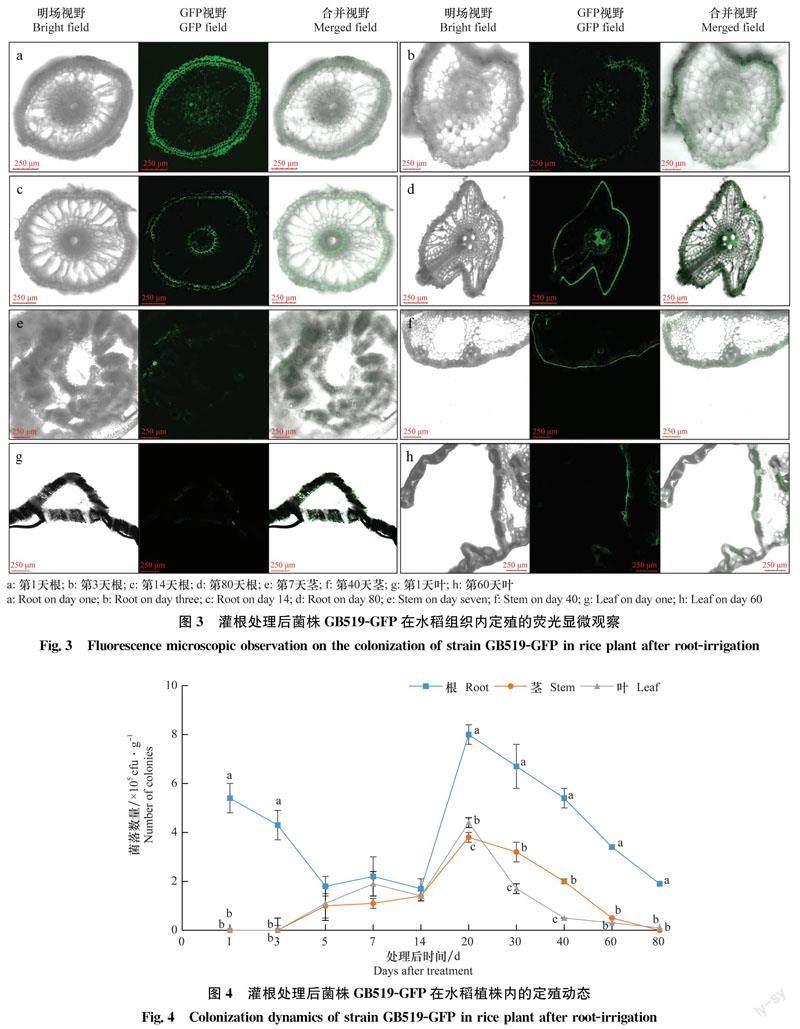
用GB519-GFP發酵液灌根處理后1 d,僅從根的外表皮細胞間隙中檢測到綠色熒光(圖3a);處理后3 d和14 d,從維管束、中柱鞘及內皮層中檢測到綠色熒光(圖3b, c);處理后80 d,從根部仍能檢測到明顯的綠色熒光(圖3d)。處理后7 d和40 d,從莖部檢測到綠色熒光(圖3e, f)。處理后1 d和60 d,葉部的泡狀細胞、葉肉細胞中分別檢測到了綠色熒光(圖3g, h)。說明灌根處理標記菌株可定殖于植株各部位。
灌根處理后,GB519-GFP在水稻植株中定殖數量的變化情況如圖4所示。根中定殖的菌株GB519-GFP的數量普遍高于莖和葉中的數量。灌根處理后1 d,從水稻根部可檢測到大量GB519-GFP,菌量達到5.4×105 cfu/g。處理后5~14 d,在水稻幼苗的根部、莖部和葉部都檢測到GB519-GFP,且菌量接近。處理后20 d,根、莖、葉中定殖的菌落數量達到最高峰,分別為8.0×105、3.8×105 cfu/g和4.4×105 cfu/g。20 d后各部位菌株定殖量都逐步下降,到處理后80 d,根中菌落數量仍可達1.9×105 cfu/g,而莖葉中含量接近于0。
2.3?葉面噴施處理后GB519-GFP在水稻植株中的定殖
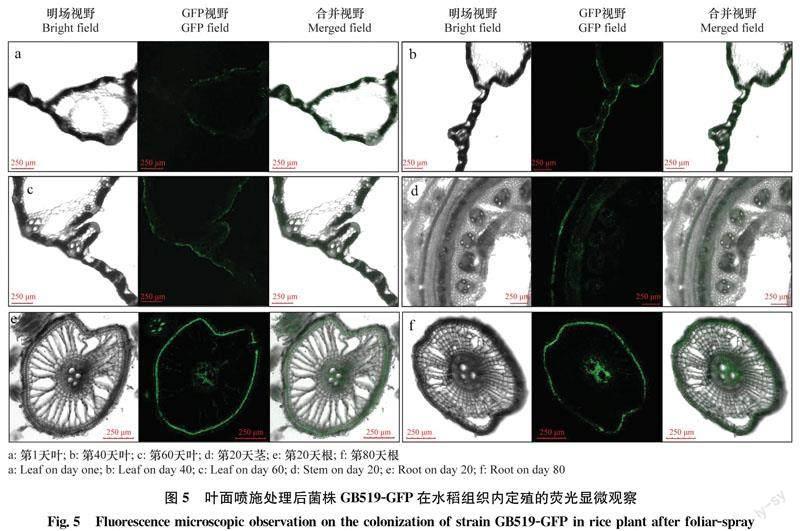
用GB519-GFP發酵液葉面噴施處理后1 d,在葉表面和表皮中都檢測到較強的綠色熒光,表明菌株通過氣孔和細微傷口進入水稻葉表皮之中,分布于上下表皮細胞間隙(圖5a)。處理后40 d和60 d葉表皮中檢測到綠色熒光度較強,表明菌株定殖量較大(圖5b, c)。葉面噴施后20 d,從莖部維管束(圖5d),根部表皮、皮層、維管束中都檢測到較強的綠色熒光(圖5e),表明標記菌株通過維管束在水稻植株內部遷移和擴展。而且葉面噴施后80 d,根部仍能檢測到明顯的綠色熒光(圖5f),表明菌株定殖效果較顯著。
葉面噴施處理后,GB519-GFP在水稻植株中定殖數量的變化如圖6所示。處理后前5 d,葉片中定殖菌量呈現遞減趨勢,而根莖中菌量呈現遞增趨勢:處理后3 d莖中檢測到菌落數量為0.2×105 cfu/g,處理后5 d根中檢測到菌落數量為0.7×105 cfu/g。處理后20 d葉中檢測到的菌落數量達到最高峰,為4.4×105 cfu/g。葉面噴施處理后,根中出現兩個定殖高峰,分別為處理后14 d和60 d,定殖量分別為6.1×105 cfu/g 和5.2×105 cfu/g。特別是處理后80 d,根中菌量仍達3.1×105 cfu/g,但莖和葉中均未檢測到標記菌株。這一結果與熒光檢測結果相同。
2.4?枯草芽胞桿菌GB519對稻瘟病的防治效果
經過兩年田間防治稻瘟病處理,枯草芽胞桿菌GB519葉面噴霧處理的病情指數分別為1.44(2020年)和1.60(2021年),防治效果分別達到73.9%(2020年)和74.5%(2021年)。同化學農藥75%肟菌·戊唑醇WG防效76.6%(2020年)和75.6%(2021年)相比,防治效果沒有顯著差異(表1)。
3?結論與討論
為保護生態環境、提高稻米品質,減少化學農藥使用與降低殘留,保障農業的可持續發展,越來越多的生防制劑產品應用于病害防控。由于枯草芽胞桿菌具有拮抗多種植物病原菌以及促進植物生長和提高作物產量的功能,是應用最多的菌種,成為生物防治的研究熱點[18]。在研發新生物農藥時,生防菌在作物中的內生定殖能力是影響其發揮作用的主要因子之一,定殖能力的強弱是評價其能否成為生物農藥的重要指標[19]。本研究結合激光共聚焦顯微鏡觀察和抗生素平板回收檢測的方法,系統研究了GB519-GFP發酵液處理的水稻種子、根和葉片后,GB519在植株體內的定殖動態,結果表明菌株可定殖于植株的表皮、皮層、維管束中,揭示其可通過維管束在水稻植株內遷移和定殖。
枯草芽胞桿菌不僅可以在植物表面形成一層致密的生物膜,還可以進入植物內部定殖,起到阻止病原菌侵染、占據病原菌定殖的空間位點的作用[20-21]。稻瘟病菌主要侵染水稻的葉片、莖、節和花序等部位,可以通過自然孔口或直接降解角質層傷口穿透表皮的方式侵入,占據皮層細胞內或細胞間隙[22-23]。菌株GB519-GFP通過植物維管束進行擴展遷移運動。Hao等[24]研究發現,枯草芽胞桿菌B96-II發酵液灌根處理蘆筍Asparagus officinalis時,菌株可以從根部侵入蘆筍體內,經由維管束由根部向莖部遷移。在本研究中,使用枯草芽胞桿菌GB519-GFP發酵液灌根和葉面噴施兩種常用手段處理水稻,處理后1 d就可發現標記菌株自根表或葉表侵入水稻體內,3~5 d后在非處理組織中發現標記菌株,分布于各器官表皮、外皮層、維管束等主要定殖位點。本研究證實了枯草芽胞桿菌GB519能夠定殖于水稻植株根莖葉等部位,推測菌株GB519可能起到阻止病原菌侵入的作用。
Walker等[25]等研究發現,枯草芽胞桿菌L-forms作為植物的共生菌在白菜種子萌發過程中,抑制了隨后接種的灰霉病菌孢子的萌發,對種子起到了保護作用。而使用枯草芽胞桿菌GB519發酵液浸種處理水稻種子后,發芽后標記菌株能定殖于水稻幼苗的各個組織部位,并伴隨幼苗生長分布于所有新生組織中,為水稻種子發芽后防止病菌侵染提供保護作用。
生防芽胞桿菌能在多種植物上定殖,定殖量直接影響到防治效果,定殖的時長決定了防治效果的持續性[26-27]。穆常青等[28]用枯草芽胞桿菌B-332在葉面噴施處理水稻,21 d后葉片表面仍能檢測到1.25×104 cfu/mm2的活菌,對稻瘟病防效為45.23%。Wang等[4]發現芽胞桿菌TUBP1在棉花中定殖時長超過45 d,對棉花黃萎病防效為55.21%。何朋杰等[29]在大白菜葉面噴施XF-1-gfp,處理后1 d樣品檢測到了標記菌(104 cfu/g),45 d后保持103 cfu/g的菌量。本試驗用枯草芽胞桿菌GB519發酵液進行浸種、灌根和葉面處理,通過抗性平板檢測,展示了不同處理根、莖、葉中菌株GB519-GFP的定殖量隨時間的動態變化情況,結果顯示不同處理方法GB519-GFP在各部位的定殖量幾乎均在處理后20 d達到峰值,可為病害防控時間節點提供參考。在處理后較短時間內定殖量達到峰值,并且在處理后各組織中能持續檢測到一定數量的標記菌株,表明菌株GB519具有較強定殖能力且防治作用可以維持較長時間。田間防控稻瘟病試驗達到74%以上的防效也證明了枯草芽胞桿菌GB519具有顯著預防和治療稻瘟病的作用。而且,與之前報道的文獻相比,菌株GB519具有更長的內定殖時長和內定殖能力。
由不同方式處理后7 d菌株GB519-GFP的定殖量可知,與灌根和浸種處理相比,葉面噴施在水稻葉片中定殖的菌量更多。葉面噴施處理后,根中菌落數量出現兩個高峰,分別為處理后14 d和60 d,菌落數量分別為6.1×105 cfu/g和5.2×105 cfu/g。出現兩次菌量高峰可能與環境的變化有關,具體的原因需要進一步的試驗驗證。第一次高峰可能是由于菌株GB519-GFP對根環境更適應,因而不斷地增殖擴大菌體數量;第二次高峰可能是由于水稻植株已經處于生長后期,葉片和莖中的營養逐漸減少不適宜菌株的生長增殖,菌株逐漸由葉和莖中轉移到根中生長增殖。植物病害生物防治的成功與否與引入生防菌株的定殖能力強弱有關,因此葉面噴施的處理方式對水稻稻瘟病的防治效果最佳。本研究為揭示枯草芽胞桿菌GB519的內生定殖能力和選擇有效使用方法防控稻瘟病提供了科學參考。
參考文獻
[1]?ZHANG Hongyin, GODANA E A, SUI Yuan, et al. Biological control as an alternative to synthetic fungicides for the management of grey and blue mould diseases of table grapes: a review [J]. Critical Reviews in Microbiology, 2020, 46(4):450-462.
[2]?BLAKE C, CHRISTENSEN M N, KOVCS A T. Molecular aspects of plant growth promotion and protection by Bacillus subtilis [J]. Molecular Plant-Microbe Interactions, 2021, 34(1): 15-25.
[3]?董麗紅, 郭慶港, 張曉云, 等. 棉花根系分泌物對枯草芽胞桿菌NCD-2生物膜形成和根際定殖的影響[J]. 植物病理學報, 2015, 45(5): 541-547.
[4]?WANG Bo, WAN Chuanxing, ZENG Hong. Colonization on cotton plants with a GFP labeled strain of Bacillus axarquiensis [J]. Current Microbiology, 2020, 77(10): 3085-3094.
[5]?高毓晗, 李世東, 郭榮君. sfp基因轉化增強了Bacillus subtilis 168的定殖能力和對黃瓜莖內枯萎病菌的抑制作用[J]. 中國生物防治學報, 2016, 32(1): 76-85.
[6]?ZABIHULLAH S, 楊娜, 張靜, 等. 棉花內生解淀粉芽孢桿菌489-2-2對棉花黃萎病的防效研究[J]. 核農學報, 2021, 35(1): 41-48.
[7]?隋麗, 徐文靜, 張正坤, 等. GFP標記的球孢白僵菌在玉米中的定殖[J]. 中國生物防治學報, 2018, 34(6): 848-857.
[8]?薛松, 汪軍, 王國芬, 等. 解淀粉芽胞桿菌的GFP標記及定殖能力[J]. 熱帶作物學報, 2017, 38(3): 551-558.
[9]?田濤, 王琦. 綠色熒光蛋白作為分子標記在微生物學中的應用[J]. 微生物學雜志, 2005, 25(1): 68-73.
[10]LIU Xuming, ZHAO Hongxing, CHEN Sanfeng. Colonization of maize and rice plants by strain Bacillus megaterium C4 [J]. Current Microbiology, 2006, 52(3): 186-190.
[11]沙月霞, 隋書婷, 曾慶超, 等. 貝萊斯芽孢桿菌E69預防稻瘟病等多種真菌病害的潛力[J]. 中國農業科學, 2019, 52(11): 1908-1917.
[12]朱峰, 王繼春, 田成麗, 等. 枯草芽胞桿菌GB519抗菌蛋白的理化性質及生防效果[J]. 中國生物防治學報, 2020, 36(5): 778-785.
[13]ZHU Feng, WANG Jichun, JIA Yulin, et al. Bacillus subtilis GB519 promotes rice growth and reduces the damages caused by rice blast fungus Magnaporthe oryzae [J]. PhytoFrontiers, 2021, 1(4): 330-338.
[14]SOROKAN A, BENKOVSKAYA G, BURKHANOVA G, et al. Endophytic strain Bacillus subtilis 26DCryChS producing Cry1Ia toxin from Bacillus thuringiensis promotes multifaceted potato defense against phytophthora infestans (Mont.) de Bary and pest leptinotarsa decemlineata Say [J/OL]. Plants, 2020, 9(9): 1115. DOI: 10.3390/plants9091115.
[15]楊珍福, 何鵬飛, 吳毅歆, 等. 煙草內生細菌YN2014042對煙草、玉米的定殖和促生作用研究[J]. 中國農學通報, 2021, 37(12): 98-105.
[16]SHA Yuexia, ZENG Qingchao, SUI Shuting. Screening and application of Bacillus strains isolated from nonrhizospheric rice soil for the biocontrol of rice blast [J]. The Plant Pathology Journal, 2020, 36(3): 231-243.
[17]MENG Xiangkun, YU Junjie, YU Mina, et al. Dry flowable formulations of antagonistic Bacillus subtilis strain T429 by spray drying to control rice blast disease [J]. Biological Control, 2015, 85: 46-51.
[18]RAIS A, SHAKEEL M, MALIK K, et al. Antagonistic Bacillus spp. reduce blast incidence on rice and increase grain yield under field conditions [J]. Microbiological Research, 2018, 208: 54-62.
[19]CAI Xunchao, KANG Xingxing, XI Huan, et al. Complete genome sequence of the endophytic biocontrol strain Bacillus velezensis CC09[J/OL]. Genome Announcements, 2016, 4(5): e01048-16. DOI: 10.1128/genomeA.01048-16.
[20]申紅妙, 李正楠, 賈招閃, 等. 內生枯草芽胞桿菌JL4在葡萄葉上的定殖及其對葡萄霜霉病的防治[J]. 應用生態學報, 2016, 27(12): 4022-4028.
[21]GINGICHASHVILI S, DUANIS-ASSAF D, SHEMESH M, et al. The adaptive morphology of Bacillus subtilis biofilms: a defense mechanism against bacterial starvation [J/OL]. Microorganisms, 2020, 8(1): 62. DOI: 10.3390/microorganisms8010062.
[22]WILSON R A, TALBOT N J. Under pressure: investigating the biology of plant infection by Magnaporthe oryzae [J]. Nature Reviews Microbiology, 2009, 7(3): 185-195.
[23]VANVU B V, ITOH K, NGUYEN Q B, et al. Cellulases belonging to glycoside hydrolase families 6 and 7 contribute to the virulence of Magnaporthe oryzae [J]. Molecular Plant-Microbe Interactions, 2012, 25(9): 1135-1141.
[24]HAO Bianqing, MA Liping, QIAO Xiongwu. Quantitative analysis of the migration and accumulation of Bacillus subtilis in Asparagus officinalis [J]. Current Microbiology, 2015, 71(3): 357-362.
[25]WALKER R, FERGUSON C M J, BOOTH N A, et al. The symbiosis of Bacillus subtilis L-forms with Chinese cabbage seedlings inhibits conidial germination of Botrytis cinerea [J]. Letters in Applied Microbiology, 2002, 34(1): 42-45.
[26]KAMILOVA F, VALIDOV S, AZAROVA T, et al. Enrichment for enhanced competitive plant root tip colonizers selects for a new class of biocontrol bacteria [J]. Environmental Microbiology, 2005, 7(11): 1809-1817.
[27]何朋杰, 崔文艷, 何鵬飛, 等. 表面活性素促進枯草芽胞桿菌XF-1在大白菜葉際定殖能力研究[J]. 植物保護, 2021, 47(5): 28-34.
[28]穆常青, 劉雪, 陸慶光, 等. 枯草芽孢桿菌B-332菌株對稻瘟病的防治效果及定殖作用[J]. 植物保護學報, 2007, 34(2): 123-128.
[29]何朋杰, 崔文艷, 何鵬飛, 等. 葉面噴施枯草芽胞桿菌XF-1防治大白菜根腫病[J]. 植物保護, 2019, 45(1): 104-108.
(責任編輯:楊明麗)

