不同頻率電刺激對2型糖尿病大鼠血糖水平及骨骼肌衛星細胞激活的影響
鄭密 黃新一 李瑩 及瑩 劉妍妍 陳德明

摘 要:目的:本文旨在探究不同電刺激參數對大鼠機體血糖調控和骨骼肌衛星細胞的激活效果。方法:通過比較不同參數條件的肌肉電刺激對2型糖尿病大鼠的空腹血糖濃度和口服葡萄糖耐量的改善效果,驗證肌肉電刺激對2型糖尿病大鼠機體血糖調控的影響以及確定對大鼠血糖調控最有效的電刺激條件。以及對大鼠骨骼肌衛星細胞標志性蛋白Pax7、MyoD和MyoG進行免疫熒光染色,比較不同參數條件的肌肉電刺激對大鼠肌肉衛星細胞激活效果。結果:(1)20 Hz、40 Hz和100 Hz都對2型糖尿病大鼠的空腹血糖濃度和口服葡萄糖耐量具有改善作用,其中40 Hz電刺激改善效果最為明顯。(2)100 Hz電刺激對大鼠肌衛星細胞的激活效果最為明顯。結論:三種電刺激誘導肌肉自主收縮來控制機體血糖,其中,40 Hz電刺激改善效果最明顯;三種刺激均可有效誘導肌衛星細胞的激活,100 Hz電刺激的激活效果最顯著。
關鍵詞: 2型糖尿病;電刺激;空腹血糖濃度;耐量;肌衛星細胞;頻率;大鼠
中圖分類號:G804
文獻標識碼:A
文章編號:1008-2808(2023)02-0011-07
Abstract: ?Objective: To explore the effects of different electrical stimulation parameters on the regulation of blood glucose and the activation of skeletal muscle satellite cells in rats. Methods: By comparing the effects of muscle electrical stimulation with different parameters on fasting blood glucose concentration and oral glucose tolerance in type 2 diabetic rats, the effects of muscle electrical stimulation on blood glucose regulation in type 2 diabetic rats were verified and the most effective electrical stimulation conditions for blood glucose regulation in rats were determined. And comparing the activation effects of muscle electrical stimulation ?with different parameters on rat muscle satellite cells by immunofluorescence staining of marker proteins Pax7, MyoD and MyoG of rat skeletal muscle satellite cells. Results: (1) 20 Hz, ??40 Hz ?and 100 Hz electrical stimulation could improve the fasting blood glucose concentration and oral glucose tolerance in type 2 diabetic rats, and the effect of 40 Hz electrical stimulation was the most obvious. (2) The effect of 100 Hz electrical stimulation
on the activation of rat muscle satellite cells was the most obvious. Conclusion: Three kinds of electrical stimulation induce muscle contraction to control blood glucose, among which ?40 Hz ?electrical stimulation has the most apparent improvement effect; all three types of electrical stimulation can effectively induce the activation of muscle satellite cells, and the activation effect of 100 Hz electrical stimulation is the most significant.
Key words: Type 2 diabetes; Electrical stimulation; Fasting blood glucose concentration; Glucose tolerance; Muscle satellite cells; Frequency; Rat
隨著時代的發展,人們物質生活水平得到了顯著提升,生活節奏不斷加速,人們的生活方式也隨之發生了巨大的改變。營養過剩、缺乏運動、焦慮、吸煙等不良的生活習慣愈發常見,由此導致2型糖尿病、肥胖等代謝性疾病的發病率不斷攀升,并出現患病人群年輕化的現象 ?[1] 。2型糖尿病是一種以機體血糖濃度持續過度升高為特征的慢性代謝性疾病,發病率高。隨著2型糖尿病病情的惡化,會導致患者的腎臟、心臟、大腦、骨骼肌等多種器官出現相應的并發癥,嚴重危害患者的身體健康,甚至導致患者肢體殘障和死亡 ?[1] 。
近年來,2型糖尿病病情發展與骨骼肌之間的關系越來越受到研究者的關注。研究發現,隨著 2型 糖尿病病情的發展,患者的骨骼肌會出現肌肉質量流失和力量下降的癥狀,被認為是2型糖尿病在骨骼肌組織的并發癥 ?[2] 。骨骼肌組織是人體的重要組成部分,約占健康成年人體重的40%,并且骨骼肌對于機體的能量代謝具有重要意義。骨骼肌是胰島素的靶器官和糖原儲存的重要場所,對于機體的血糖水平具有關鍵的調控作用 ?[3] 。此外,骨骼肌質量的變化還會影響機體的基礎代謝速率。研究發現,骨骼肌質量在體重中的占比低于32%時,哺乳動物的基礎代謝速率處于較低水平 ?[4] 。 2型 糖尿病患者的骨骼肌發生胰島素抵抗和骨骼肌質量流失,削弱了骨骼肌對血糖的攝取和代謝能力,將進一步加劇機體的代謝綜合征和2型糖尿病病情的惡化 ?[5] 。并且2型糖尿病的患病人群主要集中于中老年人,肌肉質量的流失和肌肉力量的減弱會增加患者跌倒、骨折的風險,降低患者的身體活動能力 ?[5] 。因此,維持或增強2型糖尿病患者骨骼肌的質量和力量對于阻止2型糖尿病病情的惡化和改善患者的生活質量具有重要意義。
維持和增強骨骼肌質量和力量的方法已經有了很多的研究報道,但是中老年2型糖尿病患者由于衰老、其他基礎性疾病等原因,想要通過抗阻訓練來提升肌肉質量存在一定危險性或者難以完成有效的訓練量。電刺激是康復醫學領域維持和提升患者肌肉質量和力量的有效方法,并且經過不斷的研究發展和臨床實踐,已經形成了具有不同治療效果和用途并且安全性高的多種電刺激方法,例如神經肌肉電刺激、功能性電刺激等 ?[6] 。電刺激維持和提升肌肉質量、力量的效果已經在過去的研究和臨床實踐中得到了驗證 ?[7] 。但是,電刺激對骨骼肌的干預效果是否也會改善機體的血糖水平仍然缺乏明確的驗證。本文通過采用3種不同的電刺激頻率(20Hz、40Hz以及100Hz),驗證電刺激骨骼肌是否能降低2型糖尿病大鼠的血糖,以及選擇出最有效的電刺激干預條件。
除此之外,骨骼肌具有自我再生修復的能力, 2型 糖尿病抑制骨骼肌的再生修復,這也是導致 2型 糖尿病肌肉并發癥的重要機制 ?[8] 。骨骼肌的再生修復依賴于骨骼肌組織中的肌肉干細胞又被稱為肌衛星細胞。損傷、肌肉鍛煉等刺激可以誘導肌衛星細胞的激活,激活后的肌衛星細胞通過增殖、分化、融合對肌纖維損傷部位的進行程序性的再生修復 ?[8] 。研究發現,電刺激通過誘導骨骼肌的收縮,同樣可以激活肌衛星細胞對骨骼肌的再生修復 ?[9] 。但是相應的電刺激方案種類繁雜,本文通過使用長時間的低頻電刺激(20Hz、40Hz)和間歇性的高頻電刺激(100Hz)三種電刺激方案對普通大鼠肌肉進行干預,確定對肌衛星細胞的激活效果最為明顯的電刺激方案。
1 材料與方法
1.1 實驗動物與分組
實驗第一部分,選用SPF級健康雄性SD大鼠50只,體質量200g±10g。本實驗所有大鼠均由哈爾濱醫科大學實驗動物學部提供,許可證號:SCXK(黑)2019-001,室內環境由獨立空調風機系統控制,室內通風良好,室溫:20℃-22℃,相對濕度:28%~50%。保持實驗室環境干凈衛生,大鼠自由攝食、飲水。大鼠隨機分為空白對照組(n=10)、造模組(n=40)。造模組通過使用高脂飼養聯合鏈脲佐菌素注射2型糖尿病造模,造模過程中死亡2只大鼠,其余38只大鼠全部造模成功。空白對照組的大鼠給予常規飼料喂養,在造模組注射鏈脲佐菌素時,同時對空白對照組注射等量的生理鹽水。造模成功后對符合2型糖尿病成模條件的大鼠隨機分為模型組(n=8)、20Hz組(n=10)、40Hz組(n=10)以及100Hz組(n=10),用于不同參數電刺激對2型糖尿病大鼠機體血糖調控的影響研究。
實驗第二部分,同樣選用相同條件的SPF級健康雄性SD大鼠32只,隨機分為空白對照組 (n=8), 20Hz組(n=8)、40Hz組(n=8)以及100Hz組(n=8),用于不同參數電刺激對大鼠肌衛星細胞激活情況的研究。
1.2 實驗方法
1.2.1 造模方法 ??模型組、20Hz電刺激組、40Hz電刺激組以及100Hz電刺激組進行2型糖尿病造模。 所有大鼠適應性喂養1周后,對上述4個造模組給予高脂飼料喂養8周。高脂飼料飼養8周后,對大鼠進行腹腔注射低劑量鏈脲佐菌素(35mg/kg.dw)。注射完成72h后測定大鼠空腹血糖≥16.7mmol/L 視為2型糖尿病造模成功 ?[13] 。對照組的大鼠則給予常規飼料喂養以及自由飲水,8周后腹腔注射等量的生理鹽水。
1.2.2 電刺激方法 ?按照石海旺等人的電刺激方案 ?[7] ,使用購自北京眾實迪創科技的電刺激儀,通過導線連接華佗牌非一次性針灸針,刺入部位為大鼠雙側后肢骨骼肌。電刺激開始前,將大鼠麻醉并使用大鼠固定器固定,避免電刺激過程中大鼠受到刺激掙扎造成骨骼肌損傷和應激。刺入針灸針前,使用實驗動物剃毛器清理大鼠后肢毛發,使用醫用酒精棉擦拭大鼠后肢皮膚和針灸針。
電刺激實驗計劃分成兩部分,第一部分使用3種參數條件的肌肉電刺激干預2型糖尿病大鼠,每天干預一次,每干預5天休息一天,電刺激實驗持續10周。第二部分使用三種參數條件的肌肉電刺激對普通大鼠進行一次性的電刺激實驗,觀察不同參數條件的肌肉電刺激對大鼠肌肉中的肌衛星細胞的激活效果。電刺激參數見下表。
1.2.3 空腹血糖濃度(FBG)和口服葡萄糖耐量檢測(OGTT)
在電刺激實驗開始前和實驗結束后對所有大鼠都進行一次空腹血糖濃度和口服葡萄糖耐量的檢測,電刺激開始后對20Hz電刺激組、40Hz電刺激組和100Hz電刺激組的所有大鼠每間隔5天檢測一次空腹血糖濃度。測定空腹血糖濃度和口服葡萄糖耐量提前14個小時給大鼠禁食,保持自由飲水。空腹血糖濃度和口服糖耐量測試在清晨時進行,采用尾尖取血和三諾血糖儀檢測大鼠的空腹血糖濃度。然后給予大鼠20%葡萄糖溶液灌胃(10ml/kg.bw),灌胃后15min、30min、60min、90min和120min時分別測定血糖值并繪制葡萄糖耐量趨勢圖(見圖2),糖耐量曲線下面積比(AUC)采用幾何面積相加法。 計算公式為AUC =(1/4×a+1/2×b+3/4×c+1/2×d) ×60(a、b、c、d 分別為 0、30min、60min、120min時刻血糖值)
1.2.4 免疫熒光染色
實驗第二部分大鼠肌肉電刺激實驗結束后對大鼠后肢腓腸肌進行取樣并使用4%多聚甲醛固定,然后將固定好的樣本在自來水下進行沖水30min,放入脫水機進行脫水,脫水結束后。樣本放入包埋機中,對樣本進行石蠟包埋,包埋的蠟塊冰鎮2h;攤、烤、烘一體機提前預熱:攤片50℃,烤片80℃,烘片95℃。之后進行切片,樣本切片為4μm。將切好的組織放入攤片槽的水里進行撈片,然后玻片進行烤片30min,烘片15min。之后對切片進行浸泡脫蠟,破膜,洗片,抗原修復中火煮沸10min。之后使用PBST緩沖液洗片, 封閉孵育30min,滴加熒光一抗(PAX7 Antibody; MyoD1 Antibody;MYOG Rabbit pAb )孵育之后。再次使用PBST洗片后,滴加熒光二抗(Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 488)孵育。再次重復PBST洗片后,滴加DAPI對細胞核進行染色孵育。再次洗片后滴加抗熒光淬滅劑后,使用顯微鏡觀察并拍照。
1.3 統計學分析
采用SPSS25.0統計分析軟件,多組之間采用單因素方差分析(ANOVA),同組前后采用配對t檢驗,P<0.05為差異具有統計學意義,結果以平均數±標準差( ±SD)表示。
2 研究結果
2.1 不同電刺激對2型糖尿病大鼠空腹血糖濃度的影響
進行10周肌肉電刺激干預后,三個電刺激組的大鼠的空腹血糖濃度均較模型組顯著下降(P<0.05),但是仍然顯著高于空白對照組空腹血糖濃度,說明長期肌肉電刺激大鼠骨骼肌對于2型糖尿病大鼠具有降低血糖的作用,但是并不能恢復至健康大鼠的血糖水平。相較于20Hz電刺激,40Hz電刺激與100Hz電刺激產生的降糖效果更加顯著 (P< 0.05)。
電刺激實驗開始后,每間隔5天對3個電刺激組的大鼠檢測一次空腹血糖濃度,所得到的數據整理并繪制如下大鼠空腹血糖濃度變化趨勢(圖1),可見相較于20Hz電刺激組,40Hz電刺激與100Hz電刺激對2型糖尿病大鼠的降糖效果更加明顯。
2.2 不同電刺激對2型糖尿病大鼠血糖曲線下面積(AUC)的影響
口服葡萄糖耐量是診斷2型糖尿病的常用測試方法,糖耐量數據可以反映受試者胰島β細胞的功能和機體調節血糖濃度的能力。將肌肉電刺激實驗結束后模型組與3個電刺激組所測量的口服糖耐量數據整理繪制如下糖耐量趨勢圖(圖2)。
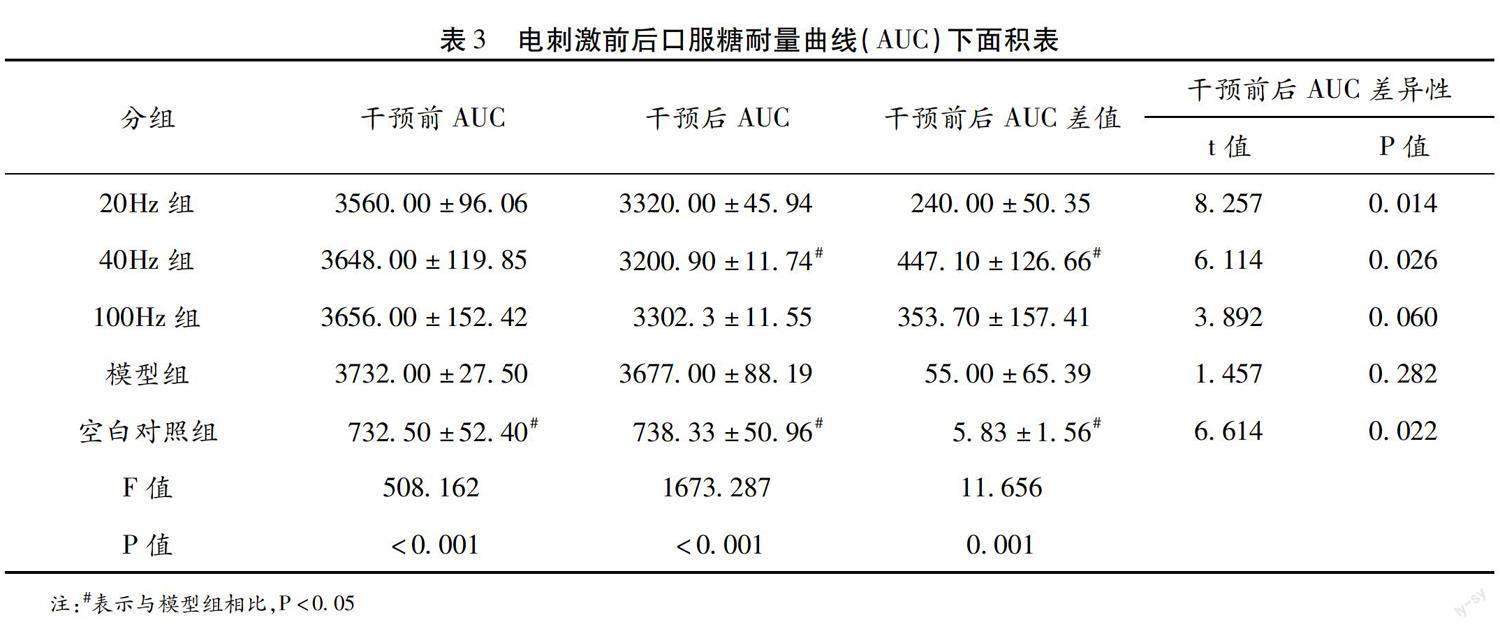
如圖所見,與模型組的口服糖耐量趨勢相比較,在灌胃葡萄糖溶液30-60 min后,3個電刺激組的大鼠血糖都開始下降,而模型組的大鼠在灌胃后2 h血糖值仍然處于高水平,并且沒有出現明顯的下降趨勢。這說明相較于造模組大鼠,長期肌肉電刺激對2型糖尿病大鼠的葡萄糖耐量產生了一定的改善作用。另外,根據肌肉電刺激干預實驗前后所得到的口服葡萄糖耐量數據計算口服葡萄糖耐量曲線下面積(AUC),并進行整理分析(表3)。糖耐量曲線根據口服葡萄糖后不同時刻的血糖濃度進行繪制。糖耐量受損的受試者攝入葡萄糖后,血糖濃度過度升高并且難以恢復至機體攝入葡萄糖前的水平,從而導致其AUC增加。因此,AUC數據的變化可以反映受試者機體糖耐量的改變。
在3種參數條件的肌肉電刺激方案中,40Hz電刺激對2型糖尿病大鼠的糖耐量影響最為顯著。與模型組相比,40Hz組大鼠在電刺激實驗后,口服葡萄糖耐量曲線下面積得到了顯著性的降低,具有統計學意義(P<0.05)。其余兩種肌肉電刺激方案雖然也對2型糖尿病大鼠的口服葡萄糖耐量產生了一定的改善效果,但是它們的AUC數據與模型組相比無統計學差異(P>0.05)。
2.3 不同電刺激對正常大鼠腓腸肌肌衛星細胞增殖分化的影響
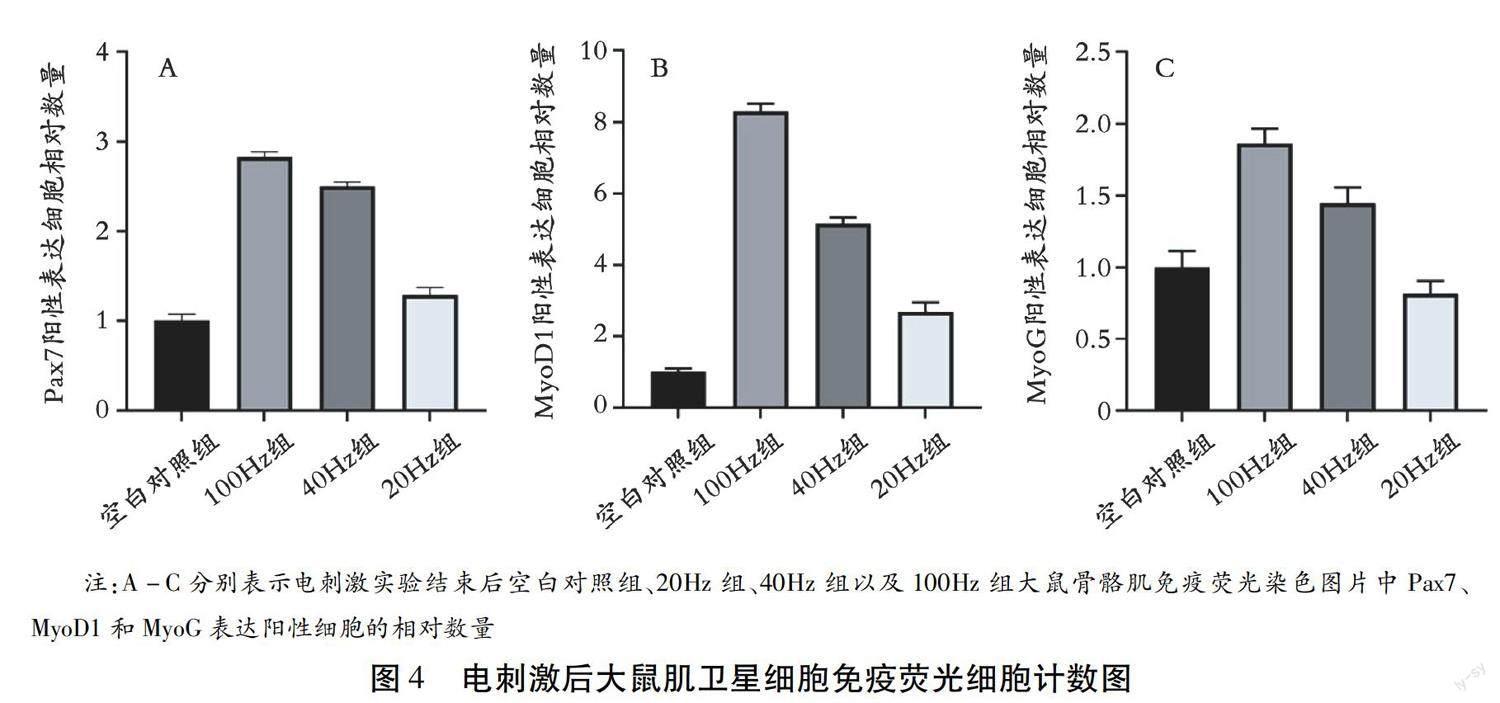
肌衛星細胞的增殖分化受到Pax7和肌生成調節因子MyoD1和MyoG的調控,Pax7、Myod1和Myog也是肌衛星細胞增殖分化過程的標志性蛋白 ?[10] 。對電刺激后取樣的普通大鼠肌肉進行免疫熒光染色后,得到以下結果(圖3)。與空白對照組相比,3種參數的電刺激實驗后,大鼠肌肉中Pax7、MyoD1和MyoG表達陽性的細胞數量均得到顯著提高,說明三種參數條件的電刺激方案都可以有效的激活大鼠骨骼肌中的肌衛星細胞。其中100Hz電刺激干預后,大鼠肌肉三種蛋白表達陽性的細胞數量最多,說明100Hz電刺激對大鼠肌肉中的肌衛星細胞的激活效果最為明顯(圖4)。
3 討 論
骨骼肌是機體進行糖代謝的重要場所,骨骼肌質量和功能的維持對于機體血糖的調控也具有不可或缺的作用 ?[3] 。通過各種類型的運動去改善機體的能量代謝一直是防治2型糖尿病的核心干預手段。但是,我國2型糖尿病高發于中老年人群體,完成有效的運動訓練計劃具有一定的難度和危險性。因此,對于無法有效完成自主運動的2型糖尿病患者亟需其他的方式來改善機體血糖控制。
電刺激作為一種物理因子治療方法是康復醫學領域的傳統治療手段,尤其是在肌肉質量的維持和功能康復方面得到廣泛的應用,衍生出多種電刺激方法。通過電刺激誘導骨骼肌的主動收縮已經被證明可以改善肌肉的能量代謝。Hamada等人發現通過電刺激誘導受試者下肢肌肉收縮可以增強受試者機體的能量消耗和機體對葡萄糖的吸收和氧化代謝 ?[11] 。因此,根據前人的研究,電刺激可以作為抗阻運動、高強度間歇訓練等運動干預方式的潛在的替代方法或者輔助手段,作為另外一種選擇應用于2型糖尿病患者的機體血糖調控。本文比較了不同參數條件的肌肉電刺激對2型糖尿病大鼠機體血糖調控的改善效果,驗證了肌肉電刺激的確具有降低2型糖尿病大鼠空腹血糖濃度和改善葡萄糖耐量的效果。并且,通過比較不同參數產生的改善效果,發現40Hz電刺激對2型糖尿病大鼠血糖調控的改善效果最為顯著,不僅降低空腹血糖濃度的效果最為明顯,而且對2型糖尿病大鼠的葡萄糖耐量也具有顯著的改善效果。100Hz電刺激對于2型糖尿病大鼠的空腹血糖濃度也具有顯著的降低效果,但是對于大鼠的葡萄糖耐量的改善并沒有達到具有統計學意義的程度。出現這種結果可能與不同參數電刺激誘發的肌肉主動收縮的強度、時間不同有關 ?[12] 。100Hz電刺激,電壓強度更高因此募集的運動單位更多,并且循環間斷式的輸出脈沖刺激,也會導致大鼠肌肉間斷式的激發肌肉收縮,這種肌肉收縮方式類似于肌肉力量訓練或高強度間歇訓練時的肌肉收縮。相較于100Hz電刺激,20Hz電刺激和40Hz刺激的電壓強度較低,脈沖輸出持續60min不間斷的進行,肌肉收縮類似于耐力訓練。因此,40Hz電刺激相較于20Hz電刺激,在相同的時間內,40Hz電刺激輸出的脈沖次數多,引起的肌肉收縮頻率同樣也高于20Hz電刺激。這可能導致完成相同時間的一次電刺激,40Hz電刺激消耗的血糖高于20Hz電刺激。而相對于引起高強度間歇式肌肉收縮的100Hz電刺激,40Hz電刺激引起的肌肉收縮所持續的時間更長,這也可能也會造成40Hz電刺激消耗的血糖高于100Hz電刺激。經過10周電刺激干預實驗的累加效應后,最終使得40Hz電刺激對糖尿病大鼠的機體血糖調控的改善效果更加顯著。
另外,電刺激與運動一樣對于肌肉衛星細胞的激活同樣具有顯著的效果,這也是電刺激維持、增加骨骼肌容量的機制之一 ?[13] 。肌衛星細胞是骨骼肌組織中的干細胞,當骨骼肌受到運動、損傷等刺激時,肌衛星細胞從靜止狀態中激活,并進入增殖分化過程,最終分化成為肌管對受損的肌纖維進行修補或者融合形成新的肌纖維 ?[14] 。肌衛星細胞數量減少和功能受抑制也是2型糖尿病患者和中老年人出現肌肉質量流失、肌肉萎縮的重要機制 ?[19] 。本文通過比較了不同參數條件的電刺激對大鼠下肢骨骼肌中的肌衛星細胞的激活情況。對電刺激后24h取樣的大鼠骨骼肌切片進行免疫熒光染色,綠色熒光選擇調控肌衛星細胞增殖分化過程的 3個 特異性蛋白Pax7、Myod1和Myog ?[10] 。發現20Hz、40Hz和100Hz電刺激對大鼠肌衛星細胞都具有激活的效果,其中100Hz的激活效果最為明顯。正如前面所述,100Hz電刺激強度更高,募集的運動單位更多,激發的肌肉收縮也更加類似于肌肉力量訓練,這可能就是100Hz電刺激相較于強度較低的20Hz電刺激和100Hz電刺激對大鼠肌衛星細胞的激活效果更明顯的原因。
肌衛星細胞作為肌肉再生修復的主要承擔者,激活后的肌衛星細胞通過與受損肌纖維融合來修補破損的肌纖維膜,從而維持肌纖維膜的完整性。此外,與肌纖維融合的肌衛星細胞會貢獻出自己的細胞核來適應肌纖維損傷修復以及肌纖維肥厚過程中伴隨的“肌核域”變化(肌纖維是多核細胞,每個肌細胞核在轉錄上只能控制有限的細胞質區域,被稱為肌核域) ?[15] 。可見肌衛星細胞可以對肌纖維進行從肌纖維膜到肌細胞核的完整修復再生。肌衛星細胞的再生修復能否重塑肌纖維的胰島素受體從而改善肌纖維的胰島素抵抗情況,這個思路是令人感興趣的。換言之能否通過抗阻運動、肌肉電刺激等干預方式來激活2型糖尿病患者的肌肉組織中的肌衛星細胞,從而重塑肌纖維膜上的胰島素受體和胰島素主導的肌肉攝取葡萄糖的信號通路。盡管目前缺乏確鑿的證據來證明,經過肌衛星細胞修復后的肌纖維膜上的胰島素受體是否得到重塑,但這為改善2型糖尿病患者肌肉組織的胰島素抵抗情況提供了新的研究思路。
4 結 論
本研究探討了不同肌肉電刺激條件誘導骨骼肌收縮對2型糖尿病大鼠血糖調控以及對健康大鼠肌衛星細胞激活的效果。實驗結果顯示20Hz、40Hz和100Hz電刺激均能有效改善大鼠機體血糖調控,并且確定了40Hz是改善大鼠機體血糖調控最有效的參數條件。電刺激可以有效的激活大鼠骨骼肌中的肌衛星細胞,而對肌衛星細胞激活效果最顯著的是100Hz電刺激。
參考文獻:
[1] ?ZHENG ?Y, LEY S H, HU F B. Global aetiology and epidemiology of type 2 diabetes mellitus and its complications [J]. Nat Rev Endocrinol, 2018, 14(2): 88-98.
[2] ?IZZO A, MASSIMINO E, RICCARDI G, et al. ?A narrative review on sarcopenia in type 2 diabetes mellitus: prevalence and associated factors [J]. Nutrients, 2021, 13(1): 1-18.
[3] MERZ K E, THURMOND D C. Role of skeletal muscle in insulin resistance and glucose uptake [J]. Compr Physiol, 2020: 785-809.
[4] MCNAB B K. What determines the basal rate of metabolism? [J]. J Exp Biol, 2019, 222(15): 1-7.
[5] 張瑩, 薛君, 董智慧. 2型糖尿病合并肌少癥發病機制的研究進展 [J]. 醫學綜述, 2021(14): 2852-2857.
[6] 楊佳佳, 徐義明, 白躍宏. 神經肌肉電刺激預防廢用性肌萎縮作用機制及研究進展 [J]. 中國康復, 2020, 35(3): 153-156.
[7] 石海旺, 段銳, 劉承宜. 電刺激對失重導致的廢用性骨骼肌萎縮的影響 [J]. 華南師范大學學報(自然科學版), 2020, 52(6): 57-66.
[8] TENG S, HUANG P. The effect of type 2 diabetes mellitus and obesity on muscle progenitor cell function [J]. Stem Cell Res Ther, 2019, 10(1) 103-118.
[9] ADAMS V. Electromyostimulation to fight atrophy and to build muscle: facts and numbers [J]. J Cachexia Sarcopeni, 2018, 9(4): 631-634.
[10] ?ZAMMIT ?P S. Function of the myogenic regulatory factors Myf5, MyoD, Myogenin and MRF4 in skeletal muscle, satellite cells and regenerative myogenesis [J]. Semin Cell Dev Biol, 2017, 72: 19-32.
[11] ?HAMADA T, HAYASHI T, KIMURA T, et al. ?Electrical stimulation of human lower extremities enhances energy consumption, carbohydrate oxidation, and whole body glucose uptake [J]. J Appl Physiol, 2004, 96(3): 911-916.
[12] 李凱, 崔婷婷, 袁芳等. 神經肌肉電刺激對衰老過程骨骼肌功能的研究 [J]. 中國醫療美容, 2022, 12(1): 77-81.
[13] CHENG Q H, LI J Y, SHENG X L, et al. Higher frequency electrical stimulation enhanced myloglossus satellite cell differentiation by upregulating expression of Pax7 mRNA, MyoD, myogenin and MyHC protein [J]. Eur Rev Med Pharmacol Sci, 2020, 24(23): 12041-12049.
[14] BAZGIR B, FATHI R, REZAZADEH VALOJERDI M, et al. Satellite cells contribution to exercise mediated muscle hypertrophy and repair[J]. Cell j, 2017, 18(4): 473-484.
[15] MURACH K A, FRY C S, DUPONT-VERSTEEGDEN E E, et al. Fusion and beyond: satellite cell contributions to loading-induced skeletal muscle adaptation [J]. Faseb J, 2021, 35(10): 1-15.

