西紅花苷通過調控TLR4/MyD88/NF-κB通路改善糖尿病大鼠視網膜病變機制研究
孟 宏,王桂青,杜竹君
(邯鄲市中心醫院,河北 邯鄲 056000)
糖尿病視網膜病變(Diabetic retinopathy,DR)是糖尿病最常見的眼部微血管并發癥,是糖尿病患者視力受損和致盲的主要原因。根據國際糖尿病聯盟2021年數據,我國居民糖尿病發病率約9.98%(約1.41億人),其中22.40%的患者并發DR,已經成為嚴重威脅人們生活質量和生命健康的公共衛生問題[1]。研究[2-3]表明,持續高血糖導致腫瘤壞死因子α(TNF-α)、白細胞介素1β(IL-1β)等促炎因子和趨化因子大量釋放而引發慢性炎癥,損傷內皮細胞,是DR等糖尿病并發癥的病理基礎。Toll樣受體4(TLR4)/髓樣分化因子88(MyD88)/核轉錄因子-κB(NF-κB)通路是介導炎癥因子釋放的重要途徑,在炎性機制中發揮著關鍵的作用[4]。有研究[5-7]報道,通過抑制TLR4/MyD88/NF-κB通路可有效減輕DR以及糖尿病心肌病、腎病等并發癥。西紅花苷是由鳶尾科植物番紅花的干燥柱頭中提取的一種水溶性類胡蘿卜素,具有抗炎、抗氧化、降血脂等生物學活性[8-9]。研究[10]報道,西紅花苷能夠通過抑制TLR4/MyD88/NF-κB通路介導的炎性反應對缺血性腦卒中大鼠起到保護作用。西紅花苷能夠通過抑制氧化應激和炎性反應減輕糖尿病大鼠腎臟損傷[11],但西紅花苷是否對DR具有影響尚未見文獻報道。本研究通過制備DR大鼠模型,研究西紅花苷對糖尿病大鼠視網膜病變的影響,并基于TLR4/MyD88/NF-κB通路探索其機制。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物:清潔級7周齡雄性SD大鼠105只,體重210~250 g,由河北伊維沃生物科技有限公司提供,許可證號SCXK(冀)2020-002。分籠飼養,維持室溫(24±1)℃、相對濕度(50±10)%,光暗12 h/12 h交替。
1.1.2 主要試劑:西紅花苷(純度≥98%)購自上海源葉生物科技有限公司(批號B21336);瑞沙托維(TLR4抑制劑)、核蛋白提取試劑盒、ECL發光液購自北京索萊寶生物科技有限公司;TNF-α、IL-1β、IL-8、可溶性細胞間黏附分子1(sICAM-1)ELISA法檢測試劑盒購自南京建成生物工程研究所;兔抗大鼠TLR4、MyD88、NF-κB p65、高遷移率族蛋白B1(HMGB1)、β-actin、H3抗體購自北京博奧森生物技術公司;羊抗兔IgG二抗購自美國 SantaCruz公司。
1.2 實驗方法
1.2.1 DR大鼠模型制備與給藥:隨機取20只大鼠設置為正常組,繼續給予常規飼料喂養。剩余85只參照朱曉燕等[12]報道的方法制備DR大鼠模型:給予高糖高脂飼料喂養4周,禁食16 h后腹腔注射(IP)鏈脲佐菌素30 mg/kg,24 h和72 h后檢測空腹血糖(FBG)均≥16.7 mmol/L,即可判定糖尿病大鼠模型制備成功;繼續高糖高脂飼料喂養3個月后,檢測FBG水平≥16.7 mmol/L,通過眼底血管熒光造影檢測,出現眼底微血管熒光素滲漏和血管新生,則可判定DR大鼠模型制備成功。共造模成功82只,去除空腹血糖(FBG)水平最高和最低各1只后,將剩余80只DR大鼠模型隨機分為模型組、西紅花苷組、瑞沙托維組和西紅花苷+瑞沙托維組,每組20只。西紅花苷組IP給藥30 mg/kg[11],瑞沙托維組IP給藥3 mg/kg[13],西紅花苷+瑞沙托維組IP給藥30 mg/kg+3 mg/kg,正常組和模型組IP給予0.9%氯化鈉溶液,注射體積均為5 ml/kg,1次/d,療程12周。
1.2.2 視網膜厚度和血管通透性檢測: ①治療完成后,每組分別隨機取10只大鼠,IP水合氯醛0.35 mg/kg麻醉后,左眼滴托品酰胺擴瞳,通過動物視網膜影像系統行光學相干斷層掃描(10幀/s)進行視網膜厚度檢測,測量點選擇距視盤沿1.5 mm的位置,每隔30°角度測量1次,取平均值。②通過尾靜脈注射伊文思藍45 mg/kg,0.5 h后心臟灌流300 ml多聚甲醛溶液(濃度4%,速度先快后慢),取右側眼球剝離視網膜、稱重,研磨勻漿后加甲酰胺70 ℃恒溫孵育12 h,3000 r/min離心10 min取上清液,測定610 nm處吸光度值后計算伊文思藍含量。
1.2.3 視網膜病理學檢查:取各組剩余的10只大鼠,頸椎脫臼處死,取左側眼球視網膜,部分視網膜置于10 %中性甲醛溶液固定3 d,石蠟浸潤包埋、4 μm切片、貼附于涂有多聚賴氨酸的防脫載玻片上、烤片,脫蠟水化后行HE染色,通過光學顯微鏡觀察視網膜病理學改變。
1.2.4 視網膜細胞超微結構病變觀察:取剩余部分左側眼球視網膜,修飾成約1 mm×1 mm×1 mm小塊后,分別于4%戊二醛溶液、2%鋨酸中恒溫4 ℃固定2 h,脫水后樹脂包埋、60 nm超薄切片、醋酸鈾和檸檬酸鉛電子雙染色處理后,通過透射電子顯微鏡觀察視網膜細胞超微結構病變。
1.2.5 視網膜TNF-α、IL-1β、IL-8、sICAM-1含量檢測:取右側眼球視網膜,部分視網膜加入適量4 ℃預冷0.9%氯化鈉溶液,研磨勻漿后3000 r/min離心10 min取上清液,按照試劑盒操作說明進行檢測。
1.2.6 視網膜TLR4、MyD88、總NF-κB p65、胞核NF-κB p65、HMGB1蛋白表達檢測:取部分右側眼球視網膜,加入適量4 ℃預冷RIPA裂解液研磨勻漿、冰上靜置30 min后,12 000 r/min離心25 min取上清液即為總蛋白;取剩余部分右側眼球視網膜,遵照核蛋白提取試劑盒說明提取核蛋白。BCA法測定蛋白含量并配平后,以40 μg蛋白量上樣、SDS-PAGE凝膠電泳(80 V、0.5 h,100 V、1.5 h)分離蛋白、濕法轉膜(300 mA、1 h),5%脫脂牛奶室溫封閉2 h,一抗稀釋液4 ℃避光孵育過夜,二抗稀釋液室溫孵育1.5 h,ECL顯色,通過Image J軟件分析蛋白條帶灰度值后,分別以β-actin和H3為內參計算目標蛋白的相對表達量。
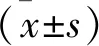
2 結 果
2.1 各組大鼠視網膜厚度和血管通透性比較 與正常組比較,模型組視網膜厚度降低、血管通透性升高(均P<0.05)。與模型組比較,西紅花苷組、瑞沙托維組和西紅花苷+瑞沙托維組視網膜厚度升高、血管通透性降低(均P<0.05)。與西紅花苷組或瑞沙托維組比較,西紅花苷+瑞沙托維組視網膜厚度升高、血管通透性降低(均P<0.05)。見表1。
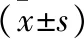
表1 各組大鼠視網膜厚度和血管通透性比較
2.2 各組大鼠視網膜病理性改變比較 正常組大鼠視網膜組織結構完整,分層清晰,各層細胞形態正常、排列規則。模型組視網膜可見結構紊亂、分層界限不清,內外核層變薄,神經節細胞和內外核層細胞數量減少、排列不規則、空泡樣變,神經纖維層水腫、炎性細胞浸潤,新生血管形成等病理性改變。與模型組比較,西紅花苷組、瑞沙托維組和西紅花苷+瑞沙托維組視網膜病理性改變均明顯改善,西紅花苷+瑞沙托維組效果優于西紅花苷組和瑞沙托維組。見圖1。

圖1 各組大鼠視網膜病理性改變比較(HE染色,×200)
2.3 各組大鼠視網膜細胞超微結構改變比較 正常組大鼠視網膜內外節層細胞和內外核層細胞超微形態正常,線粒體結構完整,未見新生毛細血管。模型組視網膜感受器外節層細胞排列疏松紊亂、水腫;感受器內節層細胞可見胞膜破裂,內質網擴張、顆粒脫落;外核層細胞可見數量減少、間隙增大,線粒體腫大、嵴斷裂;內核層細胞可見線粒體基質空泡化,囊性細胞器擴張;可見毛細血管新生。與模型組比較,西紅花苷組、瑞沙托維組和西紅花苷+瑞沙托維組視網膜感受器內外節層及內外核層細胞超微結構病變明顯改善,新生毛細血管明顯減少,其中西紅花苷+瑞沙托維組效果優于西紅花苷組和瑞沙托維組。見圖2。
2.4 各組大鼠視網膜TNF-α、IL-1β、IL-8、sICAM-1含量比較 與正常組比較,模型組視網膜TNF-α、IL-1β、IL-8、sICAM-1含量升高(均P<0.05)。與模型組比較,西紅花苷組、瑞沙托維組和西紅花苷+瑞沙托維組TNF-α、IL-1β、IL-8、sICAM-1含量降低(均P<0.05)。與西紅花苷組或瑞沙托維組比較,西紅花苷+瑞沙托維組TNF-α、IL-1β、IL-8、sICAM-1含量降低(均P<0.05)。見表2。

表2 各組大鼠視網膜TNF-α、IL-1β、IL-8、sICAM-1含量比較(ng/L)
2.5 各組大鼠視網膜TLR4、MyD88、總NF-κB p65、胞核NF-κB p65、HMGB1蛋白表達比較 與正常組比較,模型組視網膜TLR4、MyD88、胞核NF-κB p65、HMGB1蛋白相對表達量及胞核NF-κB p65/總NF-κB p65比值升高(均P<0.05)。與模型組比較,西紅花苷組、瑞沙托維組和西紅花苷+瑞沙托維組TLR4、MyD88、胞核NF-κB p65、HMGB1蛋白相對表達量及胞核NF-κB p65/總NF-κB p65比值降低(均P<0.05)。與西紅花苷組或瑞沙托維組比較,西紅花苷+瑞沙托維組TLR4、MyD88、胞核NF-κB p65、HMGB1蛋白相對表達量及胞核NF-κB p65/總NF-κB p65比值降低(均P<0.05)。見表3。
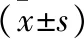
表3 各組大鼠視網膜TLR4、MyD88、總NF-κB p65、胞核NF-κB p65、HMGB1蛋白相對表達量及胞核NF-κB p65/總NF-κB p65比值比較
3 討 論
西紅花苷為番紅花的主要活性成分,邢甜甜等[11]報道西紅花苷能夠通過抑制氧化應激和炎性反應減輕糖尿病大鼠腎臟損傷。本研究采用普遍認可的高糖高脂飼料喂養加IP鏈脲佐菌素的方法構建DR大鼠模型,結果顯示,經西紅花苷治療能夠明顯提高DR大鼠視網膜厚度、降低血管通透性,減輕視網膜結構紊亂、分層界限不清,內外核層變薄,神經節細胞和內外核層細胞數量減少、排列不規則、空泡樣變等病理性改變;改善感受器內外節層細胞、內外核層細胞超微結構病變,抑制毛細血管新生。這與Rong等[14]和Yang等[15]研究報道相似。提示西紅花苷對DR大鼠視網膜組織病變和細胞超微結構病變具有保護作用。
炎性反應是DR發生和進行性加重的重要因素,Tang等[16]研究發現持續高血糖將破壞內皮細胞,引發白細胞聚集并釋放TNF-α、IL-1β、IL-8、sICAM-1等炎癥因子,誘發炎性反應。TNF-α、IL-1β、IL-8可促進白細胞、巨噬細胞等聚集和釋放炎癥因子,sICAM-1可促進炎性浸潤,加重炎性反應[17-18]。Toll樣受體 (TLRs)屬于Ⅰ型跨膜糖蛋白受體,是機體免疫及炎性反應的關鍵介質,其中TLR4亞型在哺乳動物細胞廣泛表達,李曉潔等[19]報道TLR4信號通路在DR進展過程中發揮著重要調控作用。MyD88是TLR4信號通路的關鍵銜接因子和信號配體,MyD88由C-端TIR結構域、中間域、N端死亡域共三部分構成,TLR4能夠與C-端TIR結構域結合激活MyD88。生理狀態下,NF-κB與其抑制劑(IκBα)結合定位于細胞質中,激活態MyD88的N端死亡域可誘導IκBα磷酸化,促使NF-κB游離活化與核轉位,進而誘導TNF-α、IL-1β、sICAM-1等炎癥因子轉錄表達。HMGB1為哺乳動物細胞廣泛表達的一種高度保守的核蛋白,可誘導炎癥因子表達而促進炎性反應[20-21]。Alomar等[22]報道HMGB1可激活TLR4信號通路介導的炎性反應。本研究結果顯示,經西紅花苷治療能夠明顯降低DR大鼠視網膜TNF-α、IL-1β、IL-8、sICAM-1含量和TLR4、MyD88、胞核NF-κB p65、HMGB1蛋白表達量,降低胞核NF-κB p65/總NF-κB p65比值,提示西紅花苷具有抑制DR大鼠炎性反應的作用,其機制可能與抑制TLR4/MyD88/NF-κB通路和NF-κB核轉位有關。
為了驗證上述推論,本實驗設置了瑞沙托維(TLR4抑制劑)組和西紅花苷+瑞沙托維組,結果顯示,瑞沙托維對DR大鼠視網膜厚度和血管通透性、視網膜組織病理性改變和超微結構病變、炎性反應及TLR4/MyD88/NF-κB通路相關蛋白的調控方向與西紅花苷相同,西紅花苷+瑞沙托維對DR大鼠上述各指標的調控作用明顯優于西紅花苷組和瑞沙托維組。從而進一步證實了西紅花苷對DR大鼠視網膜的保護作用與抑制TLR4/MyD88/NF-κB通路和NF-κB核轉位有關。
綜上所述,西紅花苷可降低DR大鼠視網膜血管通透性,減輕視網膜組織病變和細胞超微結構病變,其機制可能與抑制TLR4/MyD88/NF-κB通路和NF-κB核轉位,減少促炎因子釋放有關。本實驗結果為西紅花苷做為DR治療備選藥物提供了理論依據,但本研究僅在動物體內實驗水平進行了考察,其作用機制還有待于在體外細胞實驗水平進一步驗證。

