芒柄花黃素對膿毒癥小鼠炎性反應及MAPK/NF-κB通路影響的實驗研究
魏東梅,邵龍剛
(江蘇省第二中醫院急危重癥醫學科,江蘇 南京210019)
膿毒癥是不同病原體侵入循環系統后引起的全身免疫反應,與其相關的免疫反應包括中性粒細胞、巨噬細胞、淋巴細胞、單核細胞和自然殺傷細胞等多種細胞的激活[1]。在膿毒癥發生后,激活的免疫細胞處于高炎癥狀態,不受控制的產生促炎因子、急性期蛋白和其他炎癥介質[2]。感染部位的炎性反應還包括白細胞的募集和增殖、補體系統的活躍以及內皮黏附分子和趨化因子水平的增加等[1-2]。目前雖已建立了多種治療膿毒癥的方法,然而,患者的病死率并沒有顯著降低[1,3]。因此,開發新型藥物對于膿毒癥的治療具有重要意義。芒柄花黃素是一種從紅三葉和黃芪中提取的甲基化異黃酮,由于其來源廣泛,且使用安全,引起了學者的廣泛關注[4]。最新的多項研究表明,芒柄花黃素具有強大的抗炎能力,已有報道其在神經保護、血管保護和治療哮喘等方面具有良好的應用前景[5-7]。然而,迄今為止,尚未有芒柄花黃素在膿毒癥中的作用報道。本研究通過腹腔注射脂多糖建立小鼠膿毒癥模型,探究芒柄花黃素對膿毒癥炎性反應的作用及機制。
1 材料與方法
1.1 實驗動物 選取8~10周齡、清潔級的C57BL/6雄性小鼠40只,體重22 g左右,由南京中醫藥大學動物實驗中心提供。動物實驗經本院倫理委員會通過后實施。
1.2 試劑與儀器 芒柄花黃素購自Med Chem Express公司(純度>99.9%,貨號HY-N0183);脂多糖購自Sigma-Aldrich公司(貨號297-473-0);檢測炎癥因子C-反應蛋白(C-reactive protein,CRP)(貨號MCRP00)、單核細胞趨化蛋白-1(Monocyte chemoattractant protein-1,MCP-1)(貨號CSB-E07430)、髓過氧化物酶(Myeloperoxidase,MPO)活性(貨號CSB-E12108)、白細胞介素-1β(Interleukin-1β,IL-1β)(貨號DY401)、白細胞介素-6(Interleukin-6,IL-6)(貨號SM6000B)和腫瘤壞死因子-α(Tumor necrosis factor-α,TNF-α)(貨號SMTA00B)的酶聯免疫吸附試驗試劑盒購自Minneapolis公司;抗P-P38抗體(貨號ab182453)、抗P38抗體(貨號ab170099)、抗P-ERK抗體(貨號ab229912)、抗ERK1/2抗體(貨號ab176640)、抗P-JNK抗體(貨號ab176662)、抗JNK 抗體(貨號ab126424)、抗P65抗體(貨號ab32536)和抗β-actin抗體(貨號ab6276)購自美國Abcam公司;辣根過氧化物酶標記的二抗(貨號9003-99-0)購自Macklin公司。顯微鏡(Olympus公司);酶標儀(BEC公司);電泳儀及發光儀(天能公司)。
1.3 實驗方法
1.3.1 膿毒癥小鼠模型建立和分組:利用隨機數法將小鼠隨機分為四組,即對照組、內毒素組、低劑量組和高劑量組,每組10只。內毒素組按5 mg/kg濃度腹腔注射脂多糖[8],對照組按5 mg/kg注射0.9%氯化鈉溶液,低劑量組在給予脂多糖小鼠中當天按照10 mg/kg腹腔注射芒柄花黃素,高劑量組的芒柄花黃素濃度為20 mg/kg,連續注射7 d[9-10]。
1.3.2 白細胞計數:利用3 ml無菌0.9%氯化鈉溶液灌洗小鼠腹腔,收集灌洗后的腹腔液(IPF)保持在冰上以進行進一步分析。將500 μl IPF固定在載玻片上5 min,并用Wright染色法染色,在顯微鏡下對不同種類白細胞進行計數[11]。
1.3.3 炎癥因子檢測:取小鼠脾臟后獲取脾臟勻漿液。根據試劑盒說明書,對CRP、MCP-1、MPO活性、IL-1β、IL-6和TNF-α進行檢測。利用聚氯乙烯作為固相載體,在試劑盒中加入適合濃度的抗體,調整包被緩沖液pH值,室溫孵育2 h后,即刻利用非特異性蛋白進行封閉,完成清洗后加入顯色液,酶標儀檢測[11]。
1.3.4 脾臟形態學分析:為確定膿毒癥及給藥后脾臟形態學變化,室溫下,將小鼠脾臟浸潤在10%福爾馬林中固定過夜,隨后將其包埋在石蠟中。用蘇木精和伊紅(HE)染料對厚度為4~5 μm的脾臟切片進行染色,最后使用放大400倍的光學顯微鏡進行觀察[11]。
1.3.5 免疫印跡法檢測蛋白含量:利用蛋白裂解液對小鼠脾臟進行勻漿,低溫離心后加入緩沖液,煮沸制作蛋白樣本;電泳及轉膜參數:90 V維持30 min,120 V維持90 min,250 mA恒流轉膜2 h。進行抗體孵育過夜,沖洗后孵育二抗[12]。
1.4 統計學方法 采用SPSS 19.0統計學軟件進行數據分析。計數資料以均數±標準差表示,兩樣本間比較利用獨立樣本t檢驗,三個樣本比較采用方差分析;P<0.05為差異有統計學意義。
2 結 果
2.1 芒柄花黃素對膿毒癥小鼠存活率的影響 見圖1。對照組小鼠在觀察期間全部存活;內毒素組小鼠在2 d后開始死亡,7 d的病死率為100%;低濃度組小鼠的存活率為21%;高濃度組小鼠的存活率達到了37.5%。
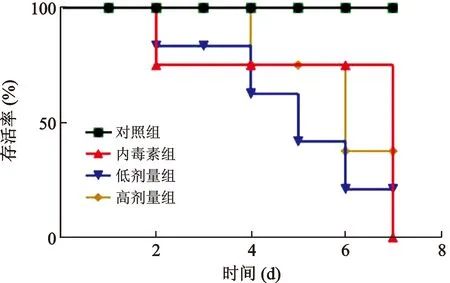
圖1 芒柄花黃素對膿毒癥小鼠存活率的影響
2.2 芒柄花黃素對膿毒癥小鼠IPF中白細胞計數的影響 見圖2。與對照組相比,內毒素組白細胞、巨噬細胞、中性粒細胞和淋巴細胞計數均增加(均P<0.05);與內毒素組相比,芒柄花黃素干預后上述白細胞計數均降低(均P<0.05),且具有劑量依賴性(均P<0.05)。
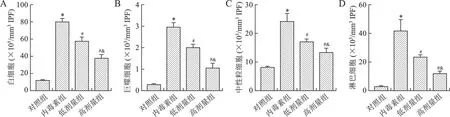
A:IPF中白細胞總數;B:IPF中巨噬細胞計數;C:IPF中中性粒細胞計數;D:IPF中淋巴細胞計數。與對照組相比,*P<0.05;與內毒素組相比,#P<0.05;與低劑量組相比,&P<0.05
2.3 芒柄花黃素對膿毒癥小鼠脾臟中炎性介質的影響 見圖3。與對照組相比,內毒素組小鼠脾臟中的炎癥因子(CRP、MCP-1和MPO)和促炎因子(IL-1β、IL-6和TNF-α)含量均升高(均P<0.05);與內毒素組相比,芒柄花黃素干預后上述炎癥因子和促炎因子均降低(均P<0.05),且具有劑量依賴性(均P<0.05)。
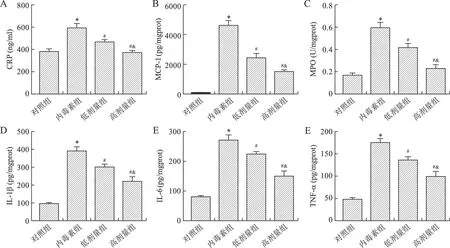
A:脾臟組織中CRP含量;B:脾臟組織中MCP-1含量;C:脾臟組織中MPO含量;D:脾臟組織中IL-1β含量;E:脾臟組織中IL-6含量;F:脾臟組織中TNF-α含量。與對照組相比,*P<0.05;與內毒素組相比,#P<0.05;與低劑量組相比,&P<0.05
2.4 芒柄花黃素對膿毒癥小鼠脾臟組織結構的影響 見圖4。對照組脾組織的HE染色表現出正常的組織結構;內毒素組切片中融合的白髓(黑色箭頭)明顯增多,還觀察到壞死細胞及紅髓處的凋亡小體,這意味著脾腫大和白髓周圍巨噬細胞的主動免疫反應強;芒柄花黃素干預后上述脾臟的受損表現得到部分恢復,且以劑量依賴的方式改善。

注:黑色箭頭指示融合的白髓
2.5 芒柄花黃素對膿毒癥小鼠脾臟組織中MAPK/NF-κB通路相關蛋白的影響 見圖5。與對照組相比,內毒素組P-P38、P-ERK、P-JNK和P65表達均增加(均P<0.05);與內毒素組相比,芒柄花黃素干預后P-P38、P-ERK、P-JNK和P65表達減少(均P<0.05),且具有劑量依賴性(均P<0.05)。

A:免疫印跡實驗條帶的灰度示意圖;B:P-P38含量統計圖;C:P-ERK含量統計圖;D:P-JNK含量統計圖;E:P65含量統計圖。與對照組相比,*P<0.05;與內毒素組相比,#P<0.05;與低劑量組相比,&P<0.05
3 討 論
膿毒癥進展迅速,病死率高,治療效果不盡如人意[1-3]。而芒柄花黃素來源廣泛,使用安全,在多種疾病中取得一定治療效果,相關研究成為熱點[4-7]。本研究發現芒柄花黃素能夠提高膿毒癥小鼠的存活率。而膿毒性的進展與白細胞、巨噬細胞、中性粒細胞和淋巴細胞等細胞數量的增加密切相關,這些細胞的過度活化是機體發生失控性炎性反應的根本環節[1-3]。膿毒癥發生后,這些白細胞分泌并產生大量炎癥蛋白和促炎因子,CRP是一種急性期蛋白[13],MCP-1是一種啟動細胞因子[14],而MPO活性反映了中性粒細胞在脾臟中的隔離[15],所有這些介質都被廣泛用作炎癥標志物;而IL-1β、IL-6和TNF-α等促炎因子,不僅消耗大量抑炎因子,而且又能引起炎癥級聯放大反應,引發失控性炎癥[16]。因此,抑制炎癥細胞的過度活化,控制炎性反應,是膿毒癥治療的關鍵所在[13-16]。
本研究發現芒柄花黃素不僅能夠降低膿毒癥小鼠IPF中的多種白細胞數量,還能顯著降低脾臟中相關炎癥因子(CRP、MCP-1和MPO)和促炎因子(IL-1β、IL-6和TNF-α)含量。本實驗對脾臟形態學的分析也同樣支持芒柄花黃素的抗炎作用和對膿毒癥的治療作用。近來一些研究已證實,芒柄花黃素能夠調節白細胞增殖和活性,以及細胞因子的產生,從而抑制炎性反應。有學者報道,芒柄花黃素可通過減輕動脈粥樣硬化中的血管炎癥發揮腦保護作用[6]。也有學者證實,芒柄花黃素能夠抑制胃潰瘍大鼠的炎性反應促進胃黏膜血管再生[17]。還有學者發現,芒柄花黃素抑制IL-1β誘導的人軟骨細胞炎癥并減緩大鼠骨關節炎的進展[10]。不僅在慢性炎癥中發揮抗炎作用,芒柄花黃素在急性炎癥中也同樣發揮作用。Yi 等[17]報道,芒柄花黃素可減輕小鼠過敏性哮喘的氣道炎癥和氧化應激反應。本實驗結果與上述研究相似,均證實了芒柄花黃素的抗炎作用,并擴展了芒柄花黃素在不同疾病中的應用。
為進一步探究芒柄花黃素減輕膿毒癥炎性反應的機制,課題組進行了炎癥相關通路的檢測。已有文獻[18-19]報道,在發生膿毒癥等炎性反應過程中NF-κB和MAPK信號通路可被激活,通路中的關鍵分子,如P38、JNK、ERK1/2和P65等表達增加。Gao等[18]發現,膿毒癥發生肝腎損傷時NF-κB和MAPK信號通路活化,加重組織器官損傷。還有研究發現,在膿毒癥心肌損傷時巨噬細胞功能紊亂,導致P38、JNK、ERK1/2和P65等分子異常表達[19]。本研究也發現,在小鼠膿毒癥發生后脾臟中的NF-κB和MAPK信號通路被激活,而芒柄花黃素干預后此異常活化的通路被抑制。本實驗結果和先前研究一致,芒柄花黃素能夠通過對NF-κB和MAPK等炎癥關鍵通路的抑制發揮抗炎作用。有學者發現,芒柄花黃素通過抑制NF-κB和MAPK通路的激活來減弱破骨細胞的生成[20]。也有學者證實,芒柄花黃素通過調節NF-κB通路抑制大鼠胃部炎癥并促進潰瘍愈合[17]。
綜上所述,芒柄花黃素可能通過抑制MAPK/NF-κB通路活化減輕小鼠膿毒癥炎性反應。本研究拓展了芒柄花黃素在不同疾病模型上的應用,為開發新型治療膿毒癥藥物提供了更加深入的實驗依據。

