基于網絡藥理學探討千金黃連丸對疾病動脈粥樣硬化的分子機制
包鵑 李雯麗 曾梅蘭 陳文雅 梁佳華 伍興汝 韋煒
摘 要:目的 基于網絡藥理學探討千金黃連丸(qianjin huanglian wan,QHW)對疾病動脈粥樣硬化(atherosclerosis,AS)的分子機制。方法 通過檢索Batman—TCM、Uniprot、GeneCards、DisGeNET等多個數據庫,對QHW的活性成分和對應的靶點以及AS的相關疾病基因進行分析,篩選關鍵靶點,并在Venny2.1軟件下建立QHW-活性成分-靶點-通路網絡圖,利用STRING數據庫構建所獲得的相關靶點之間作用網絡效應圖。結果 通過String數據庫的富集分析功能,得到QHW治療AS的活性成分12個,靶點94個。通過Network Analyzer拓撲分析得到28個關鍵靶點,MCODE聚類分析得到6個核心基因。GO富集分析得到1 257條生物過程,74項分子功能相關,44項細胞組成。KEGG功能富集分析得到47條信號通路。結論 初步了解QHW干預AS的多成分、多靶點、多通路作用機制,為進一步研究AS提供更精確的理論依據。
關鍵詞:生地;黃連;動脈粥樣硬化;網絡藥理學;分子機制
中圖分類號:R966
文獻標志碼:A
Exploring the molecular mechanism of Qianjin Huanglian Pill for the treatment of atherosclerosis based on network pharmacology
BAO Juan LI Wenli ZENG Meilan CHEN Wenya LIANG Jiahua WU Xingru, WEI Wei
(1. Department of Biochemistry and Molecular Biology, Guangxi University of Traitional Chinese Medicine, Nanning 530200, China; 2. Department of Cardiology, Nanning Second Peoples Hospital, Nanning 530200, China)
Abstract: Objective To explore the molecular mechanism of Qianjin Huanglian Pill (QHW) on disease atherosclerosis (AS) based on network pharmacology. Methods The active ingredients and corresponding targets of Huanglian and Shengdi and the related disease genes of AS were analyzed by searching several databases such as Batman-TCM, Uniprot, GeneCards, DisGeNET, etc., to screen the key targets. The network diagrams of the active ingredients, targets and pathways were established under Venny2.1 software, and the network effect diagrams between the obtained relevant targets were constructed using STRING database. Through the enrichment analysis function of STRING database, 12 active ingredients and 94 targets of QHW were obtained for the treatment of AS. The enrichment analysis of GO yielded 1 257 biological processes, 74 molecular function-related and 44 cellular compositions. 47 signaling pathways were obtained by enrichment analysis of KEGG function. Conclusion This study preliminarily understands of the mechanism of action of multiple components, multiple targets, and multiple pathways of Qianjin Huanglian Pill for the treatment of atherosclerosis, and provides a more accurate theoretical basis for further basic research.
Key words: Shengdi; Huanglian; atherosclerosis; network pharmacology; molecular mechanism
動脈粥樣硬化(atherosclerosis,AS)是一種常見的以動脈管壁增厚、變硬和彈性減低為主要特征的循環系統疾病,是冠心病、頸動脈疾病及周圍動脈疾病的共同潛在病因[1]。AS的確切病因和發病機制尚未完全明確,但AS與高脂血癥、高血壓、糖尿病、吸煙、遺傳等危險因素密切相關。大量研究表明,脂質在脈管上沉積、血管內皮受損及炎癥反應的發生是AS形成的關鍵病理環節。中醫雖無“AS”,但其病因病機及證候與中醫的“痰濁”“瘀血”“胸痹”等病癥相對應。中醫認為,“痰”“瘀”是由于脾虛和腎虛,導致津液、水谷精微代謝異常形成的[2],痰濁瘀血經久不散,凝結于脈管之上,則表現為血管腔狹窄及血液動力學障礙,血管穩態和結構遭到破壞,以致痰瘀互結,即AS斑塊形成[3]。
千金黃連丸(qianjin huanglian wan,QHW)是古代中醫首次記載于《千金要方》的方劑。它由黃連、地黃2種中藥組成。黃連是毛茛科黃連的一種草本植物。本品性寒、味苦,具有清熱燥濕、瀉火解毒的功效。地黃是一種高山植物,性味甘、寒、苦,它既能滋陰生津,又能清熱涼血。藥理學研究發現黃連影響心血管系統的主要成分是小檗堿[4]。小檗堿保護內皮細胞(endothelial cells,ECs)免受細胞炎癥因子的破壞,使血管形態功能不受影響,同時減少血管平滑肌細胞(vascular smooth muscle cells,VSMCs)的增殖,另外小檗堿具有降低巨噬細胞系統活性的功能[5]。地黃發揮血管保護作用的有效成分主要有環烯醚萜苷類化合物和苯乙醇苷類,可以減少巨噬細胞吞噬脂質形成泡沫細胞[6-7] 。地黃的苷類和萜類配伍黃連的小檗堿能夠調節血中脂類成分,對血管內皮功能有調節作用。綜上所述,地黃可通過減少泡沫細胞的形成來抑制AS的進展。本研究將運用網絡藥理學數據挖掘和分析方法,探索活性成分-靶點-疾病與黃連、地黃配伍治療AS的關系,挖掘黃連、地黃配伍治療AS的有效成分和分子機制。
1 材料與方法
1.1 QHW的成分靶點信息查詢
在Batman-TCM數據庫中進行篩選,以補充黃連和地黃的化合物及相關靶標,并將QHW組分靶標得分大于20的納入篩選。將所有目標輸入Uniprot數據庫(https://www.uniprot.org/),篩選出人體靶標并刪除非人體靶標。合并在TCMSP數據庫收錄的成分和靶點,進行匯總和刪重。
1.2 AS靶點查找
將“atherosclerosis”作為關鍵詞,在GeneCards數據庫(https://www.genecards.org/)和DisGeNET數據庫(https://www.disgenet.org/)以及NCBI數據庫(https://www.ncbi.nlm.nih.gov/)中檢索人類基因。綜合檢索結果,通過去重等進行對比分析,其中,GeneCards數據庫所獲得的靶點依據得分進行參數平均度值(degree)篩選以獲得更密切相關的靶點。
1.3 蛋白質相互作用(protein protein interaction,PPI)網絡構建、拓撲分析及MCODE聚類分析
在STRING(https://string-db.org/cgi/input.pl)數據庫中輸入QHW和AS的交集靶點,并設定生物種類為“Homo sapiens”,得到相關的PPI網絡關聯圖后導入Cystoscape 3.8.0工具中進行拓撲分析:在NetworkAnalyzer工具中,進行Degree排序后,選擇分值超過平均分的基因作為關鍵靶點。通過MCODE分析,可以實現對核心基因的檢測和篩選。構建好的PPI網絡導入到Cytoscape 3.8.0中,利用MCODE模塊進行基因簇的分析和核心靶點的篩選,這一步可以完成相關核心靶點的分析。
1.4 成分-疾病-靶點網絡構建
為了更好地理清成分、疾病以及相應靶點之間錯綜復雜的關系,基于納入的地黃和黃連的成分、治療的疾病以及藥物作用于疾病的相關靶點,QHW利用Cytoscape 3.8.0軟件構建出成分-疾病-靶點網絡圖構建出來。
1.5 關鍵成分篩選
利用Cytoscape 3.8.0對上一步構建的網絡圖進行拓撲分析,完成QHW關鍵成分的篩選。將成分按照數值的高低進行Degree排序,Degree值越高,代表成分越重要。可以選取大于平均度值的成分作為關鍵成分進行后續的研究。
1.6 GO富集分析與KEGG通路富集
將藥物與疾病共有的靶點進行GO富集分析,在STRING數據庫中篩選出P校正<0.05的項目。針對藥物和疾病的共同靶點進行KEGG的通路富集分析,利用STRING數據庫篩選出P校正<0.05的項目。然后利用R 4.0.3 軟件,引用ClusterProfiler、Enrichplot和ggplot2包(KEGG通路富集僅引用ClusterProfiler),繪制出相對應的柱狀圖和氣泡圖。
1.7 中藥成分-疾病-通路-靶點網絡構建
運用Cytoscape 3.8.0工具,將所獲得的成分-疾病-通路-靶點網絡文件導入其中,繪制出通路網絡關聯圖。每條邊表示節點與節點之間的靶向關系,可以簡潔地呈現出QHW的活性成分在對疾病AS的療效中相關成分和核心靶點的效應特點。
2 結果
2.1 QHW的成分靶點信息查詢
通過Batman-TCM數據庫、Uniprot數據庫的補充和校正,合并在TCMSP數據庫收錄的經過匯總和刪重,黃連獲得9個化合物成分和156個靶點;生地獲得4個化合物成分和216個靶點。
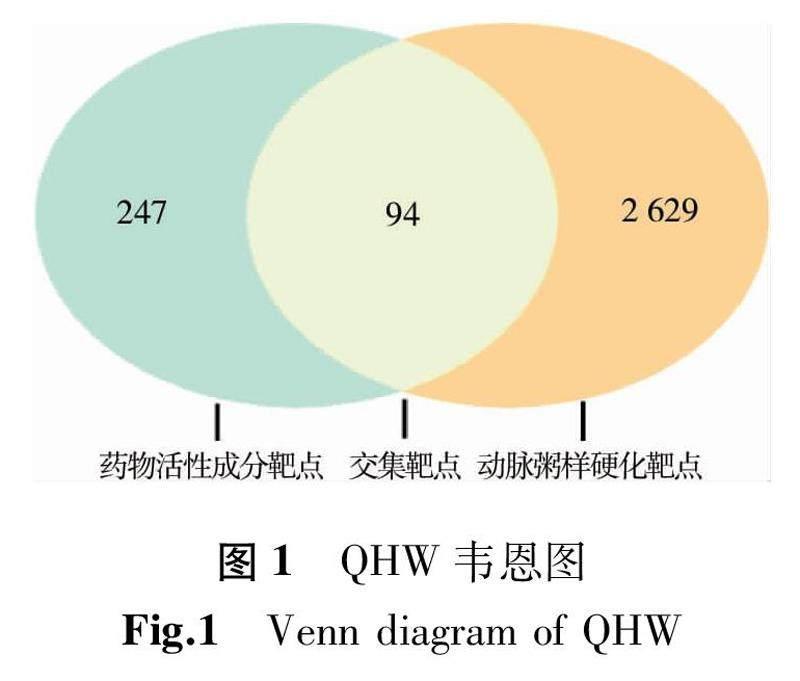
2.2 動脈粥樣硬化的靶點查找
經檢索,DisGeNET數據庫篩選得到相關靶點共2 044個;NCBI數據庫篩選得到相關靶點共1 138個;GeneCards數據庫篩選得到相關靶點共1 145個。經3個數據庫的基因合并和去重后,得出與AS相關的基因共2 723個。使用韋恩圖制作軟件Venny 2.1取AS與QHW的共有靶點交集,篩選出藥物和疾病的交集靶點94個,這些共有靶點即藥物作用于疾病的預測靶點,對其進行以下通路富集分析,得到韋恩圖(圖1)。
2.3 PPI網絡的構建和拓撲分析
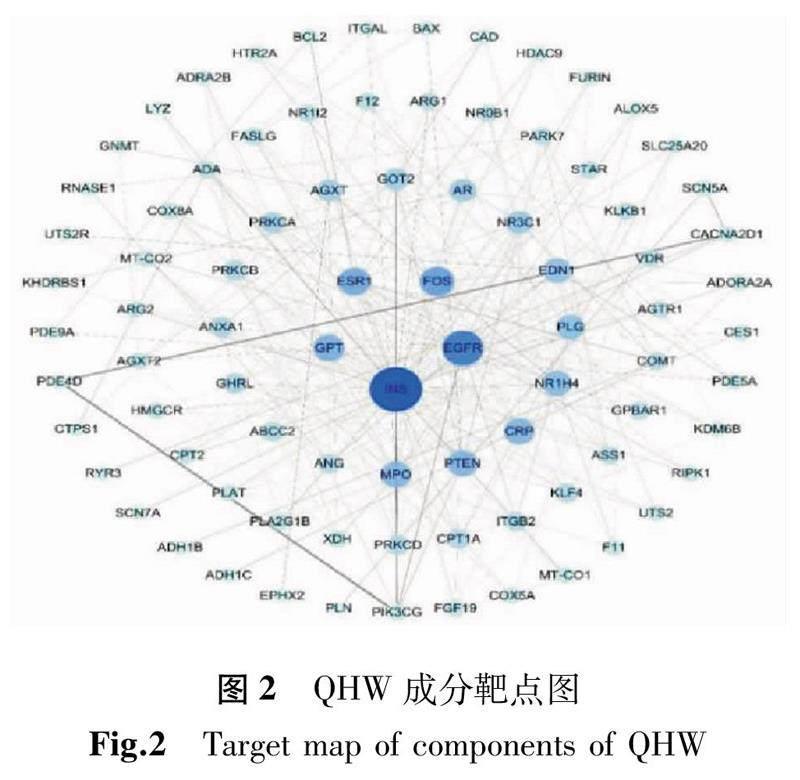
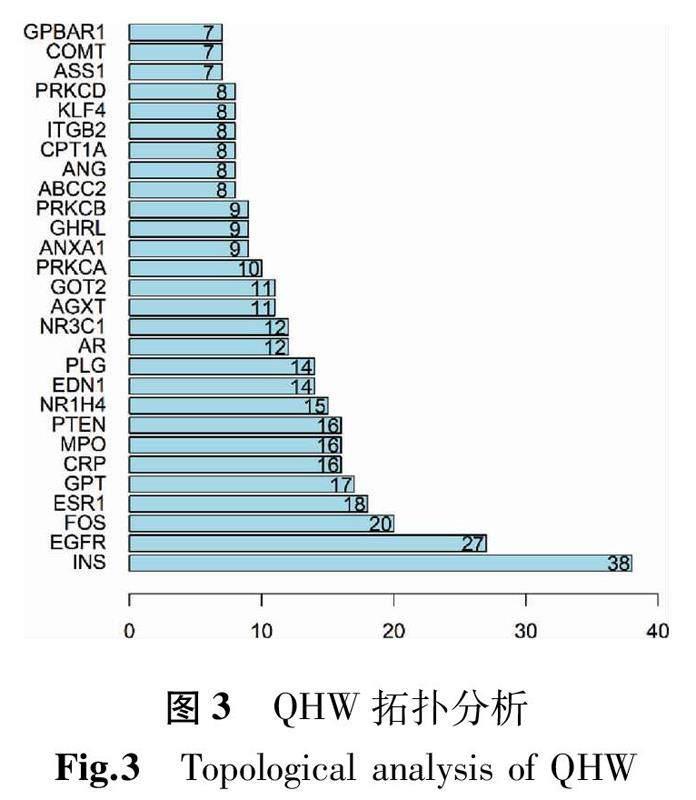
此PPI網絡中共有節點94個,邊292條,所得的平均度值為6.21。圖2為運用STRING網站導出的PPI網絡關聯圖的結果導入Cytoscape軟件繪制的PPI網絡圖(此圖中的節點大小與顏色根據度值會有相應的變化,隨著節點的增大及顏色的加深,其所獲得的度值也相應增大;圖中線由細到粗即表示Edge betweenness由小到大)。根據拓撲分析篩選藥物-疾病的關鍵靶點,總共得到關鍵靶點28個,使用R 4.0.3對這28個靶點進行柱狀圖的繪制,如圖3所示(圖中的橫坐標代表靶點的度值)。
2.4 MCODE聚類分析
在MCODE聚類分析中,共得到6個核心基因和6個基因簇。其中核心基因NR1I2、EGFR、F11、ESR1、SCN7A、MT-CO2,具體結果見表1。
2.5 成分-疾病-通路-靶點網絡構建
由94個節點,12個活性成分與疾病AS及2個藥物成分相互連接,彼此交織成網形成了成分-疾病-通路-靶點網絡,見圖4。
2.6 關鍵成分篩選
取degree分值排序前10的成分,從高到低分別為γ-氨基丁酸、三羥基丁磷酸膽酸、菜油甾醇、雷姆凝集素C、非洲防己堿、掌葉防己堿木蘭花堿、黃麻苷A、茄鐮飽菌素、廣玉蘭內酯,這10種活性成分可能在黃連-地黃配伍干預AS的過程中起關鍵作用。見表2。
2.7 GO富集的分析與KEGG通路的富集
GO富集分析后得到的生物過程共1 257條,分子功能相關共74項,細胞組成相關共44項,利用相關軟件繪制出相關的柱狀圖(圖5)。KEGG通路富集后得到相關信號通路共47條,使用相關軟件進行氣泡圖的繪制,具體信息見圖6。由圖6可見,QHW可通過多個信號通路協同治療AS,各通路間存在上下游關系,各靶點間存在相互作用關系。
2.8 中藥成分-疾病-通路-靶點網絡構建
取KEGG富集分析的20條最顯著的相關信號通路與2.5得到的成分-疾病-通路-靶點網絡進行匯總,得到中藥成分-疾病-通路-靶點網絡圖,見圖7。由圖7可見,QHW可通過多個信號通路協同干預AS,各通路間存在上下游關系,各靶點間存在相互作用關系。
3 討論
AS斑塊的形成是疾病發生發展的主要過程,斑塊的形成與內皮細胞的改變與脂質的沉積有關。而內皮損傷也會引起機體產生反應,比如炎癥、免疫應答等。QHW中黃連和地黃均有保護內皮細胞免受炎癥因子破壞的作用以及抑制泡沫細胞生成等功能[8],證明QHW在治療AS中有明確的療效。本研究結合多篇相關文獻并利用網絡藥理學研究方法進行初步分析,從藥物活性成分、靶點、基因、作用通路等微觀角度多方面說明QHW對AS的作用機制。通過拓撲學分析結果可見,γ-氨基丁酸(gamma-aminobutync acid,GABA)、三羥基丁磷酸膽酸、菜油甾醇等12種活性成分可能為QHW作用于AS的關鍵活性成分。外周的GABA可以作用于GABAA受體和GABAB受體,這2個受體分別具有擴張血管和抑制交感神經的作用。GABA與這兩個受體結合后,通過擴張血管、降低血壓,可發揮減少血管內皮損傷的作用[9]。表達于外周樹突狀細胞、T淋巴細胞、巨噬細胞等細胞膜上的GABAA受體激活后可以通過抑制炎癥免疫細胞的活性,減輕炎癥反應,改善巨噬細胞內異常的膽固醇轉運,抑制巨噬細胞分泌腫瘤壞死因子(tumor necrosis factor alpha,TNF-α),從而延緩動脈粥樣硬化[10-11] 。GABAA受體激動劑通過下調單核細胞趨化蛋白-1(monocyte chemoattractant protein-1,MCP-1)的mRNA和 P-pMAPK38的蛋白表達來抑制AS斑塊形成,以抑制AS斑塊形成蛋白(ABCA1、SR-BI等) 的表達,下調膽固醇逆轉運蛋白SR-A、LOX-1的表達,從而抑制泡沫細胞形成[12]。
攝入適量的膽固醇有重要的生理意義,但攝入過多則會引起AS。菜油甾醇是植物甾醇之一。植物甾醇能以濃度依賴性方式減少膽固醇的吸收,不僅能降低血清中膽固醇的濃度,還能有效緩解高脂血癥和延緩AS[13-14]。
植物甾醇與膽固醇有相似的化學結構,二者不同之處僅在于側鏈,因此,植物甾醇降血脂的機制很可能與競爭結合膽固醇受體有關,植物甾醇可以通過阻止膽固醇的酯化作用和膠體顆粒的形成,有效地減少膽固醇的吸收[15-16]。
在 PPI 網絡中,拓撲分析顯示有5個靶點處于拓撲網絡結構中心,包括ESR1、FOS、GPT、EGFR、INS,它們可能是治療AS的關鍵靶點。MCODE聚類分析結果顯示核心基因為NR1I2、EGFR、F11、ESR1、SCN7A、MT-CO2,表明6個核心基因可能在QHW治療AS過程中發揮較重要的作用。其中關鍵靶點之一EGFR是一種受體型的蛋白酪氨酸激酶,可以參與血管中內皮細胞的增殖、遷移及分化的過程[17]。C-反應蛋白則可誘發血管內皮分泌促炎因子[18],促進巨噬細胞攝取低密度脂蛋白[19],增加血管內皮泡沫細胞含量,并加速合成纖溶酶原激活物抑制劑因子和促凝血因子,促進血栓形成[20]。目前,大量的研究表明,AS發生和發展的每一個環節都涉及炎性反應[21]。
GO富集分析顯示,QHW可以通過負調節對外界刺激的反應、肽激素生成的反應、血液循環、羧酸生物合成等生物學過程,發揮一定的調節作用來干預AS;這些靶點主要位于囊泡腔、呼吸鏈復合體、胞質囊泡腔、細胞色系復合體、肌纖維膜等處,具有核受體活性,配體激活等分子功能。KEGG途徑富集結果顯示,QHW干預AS的主要通路有精氨酸生物合成、補體和凝血級聯系統、丙氨酸、天冬氨酸、谷氨酸代謝、鈣信號通路等。精氨酸生物合成通路中精氨酸作為血管功能調節因子可以改善內皮功能,從而改善心血管結局。其中精氨酸酶和一氧化氮合酶介導的精氨酸在免疫細胞中的代謝對AS反應過程起重要的抑制作用[22]。補體與凝血級聯系統中血小板微粒有助于單核細胞黏附在發生炎癥反應的內皮上,加速泡沫細胞的形成,從而加速AS的形成和發展[23]。脂肪因子直接影響內皮功能、血小板和單核細胞,并產生補體因子維持炎癥,使AS加重[22,24]。QHW中黃連和生地黃均有保護內皮細胞免受炎癥因子破壞的作用和抑制泡沫細胞生成等功能。因此,QHW可以通過保護內皮細胞和抑制炎癥反應來延緩動脈粥樣硬化。
綜上,應用網絡藥理學方法探析了QHW通過主要活性成分調控關鍵靶點起到干預AS的作用,是在現有的數據庫基礎上進行深究,彰顯了QHW活性成分在治療AS過程中的相關成分和核心靶點之間的作用特點,為今后中藥藥效及作用機制的研究提供指導。
參考文獻:
[1]LUSIS A J. Atherosclerosis[J]. Nature, 2000, 407(6801): 233-241.
[2]錢小奇. 試論高脂血癥的病因病機[J]. 天津中醫, 2002, 19(6): 50-52.
[3]張偉, 鄧常清. 從氣血理論探討病理性血管重構的研究思路[J]. 中華中醫藥雜志, 2019, 34(10): 4713-4717.
[4]周瑞, 項昌培, 張晶晶, 等. 黃連化學成分及小檗堿藥理作用研究進展[J]. 中國中藥雜志, 2020, 45(19): 4561-4573.
[5]RUI R, YANG H L, LIU Y K, et al. Effects of berberine on atherosclerosis[J]. Front Pharmacol, 2021, 12: 764175.
[6]劉艷賓, 秦潔潔, 楊樹涵, 等. 基于“IL-34”-Rho/Rock信號通路探討生地黃水煎總提物對動脈粥樣硬化的作用分析[J]. 中國藥學雜志, 2019, 54(8): 624-631.
[7]翟英英. 生地黃提取物對腫瘤壞死因子誘導的人臍靜脈內皮細胞的保護作用及機制研究[D]. 鄭州: 河南中醫學院, 2014.
[8]李靜, 陳泫錦, 佘成燁, 等. 中藥千金黃連丸的抗動脈粥樣硬化作用[J]. 中南藥學, 2021, 19(12):2569-2575.
[9]CURRIE P J, COIRO C D, NIYOMCHAI T, et a1. Hypothalamic paraventricular 5-hydroxytryptamine: receptor-specific inhibition of NPY-stimulated eating and energy metabolism[J]. Pharmacol Biochem Behav, 2002, 71(4): 709-716.
[10]BARRAGAN A, WEIDNER J M, JIN Z, et al. GABAergic signalling in the immune system[J]. Acta Physiol (Oxf), 2015, 213(4): 819-827.
[11]YANG Y, LIAN Y T, HUANG S Y, et al. GABA and topiramate inhibit the formation of human macrophage-derived foam cells by modulating cholesterol-metabolism-associated molecules[J]. Cellular Physiology and Biochemistry, 2014, 33(4): 1117-1129.
[12]楊穎. GABA-A受體調節動脈粥樣硬化的作用及其機制的研究[D]. 武漢: 華中科技大學, 2013.
[13]張帆. 植物甾醇的生物活性與構效關系初探[D]. 南昌: 南昌大學, 2018.
[14]LLAVERIAS G, ESCOLA-GIL J C, LERMA E, et al. Phytosterols inhibit the tumor growth and lipoprotein oxidizability induced by a high-fat diet in mice with inherited breast cancer[J]. Journal of Nutritional Biochemistry, 2013, 24(1): 39-48.
[15]賈代漢, 周巖民, 王恬. 植物甾醇降膽固醇作用研究進展[J]. 中國油脂, 2005, 30(5): 55-58.
[16]TRAUTWEIN E A, DUCHATEAU G S M J E, LIN Y G, et al. Proposed mechanisms of cholesterol-lowering action of plant sterols[J]. European Journal of Lipid Science & Technology, 2003, 105(3/4): 171-85.
[17]李曉蕊, 郭青龍, 盧娜. VEGFA/VEGFR2作用于血管內皮細胞途徑及其抑制劑研究進展[J]. 藥物生物技術, 2016, 23(3): 274-278.
[18]SARKAR N C, SARKAR P, SARKAR P, et al. Association of coronary heart disease and CRP-as a noble marker of inflammation-A case control study[J]. The Journal of the Association of Physicians of India, 2019, 67(10): 54-56.
[19]PEA E, DE LA TORRE R, ARDERIU G, et al. mCRP triggers angiogenesis by inducing F3 transcription and TF signalling in microvascular endothelial cells[J]. Thromb Haemost, 2017, 117(2): 357-370.
[20]HUANG S Z, TIAN J R, LIU C Q, et al. Elevated C-reactive protein and complement C3 levels are associated with preterm birth: a nested case-control study in Chinese women[J]. BMC Pregnancy and Childbirth, 2020, 20(1): 131.
[21]胥雪蓮, 何川. 炎癥與動脈粥樣硬化[J]. 心血管病學進展, 2015, 36(5): 634-637.
[22]NITZ K, LACY M, ATZLER D. Amino acids and their metabolism in atherosclerosis[J]. Arteriosclerosis Thrombosis & Vascular Biology, 2019, 39(3): 319-330.
[23]FRANCESCUT L, STEINER T, BYRNE S, et al. The role of complement in the development and manifestation of murine atherogenic inflammation: novel avenues[J]. Journal of Innate Immunity, 2012, 4(3): 260-272.
[24]KOUGIAS P, CHAI H, LIN P H, et al. Effects of adipocyte-derived cytokines on endothelial functions: implication of vascular disease[J]. Journal of Surgical Research, 2005, 126(1): 121-129.

