基于宏微結合發展微粒觀的單元整體教學設計*
——以“離子反應”為例
成志高 雷 歡
(1.衡陽市教育科學研究院 湖南 衡陽 421001;2.湖南科技大學 湖南 湘潭 411201)
新課標倡導“觀念構建”為本的化學教學,主張對教材內容或者事實素材進行加工,通過設計有思考價值的情境、問題和探究活動,引領學生進行積極的思考、概括、提升,從而實現對化學學科本質規律的認識。[1]基本觀念的構建通常是需要借助于不同層次的化學知識由淺入深地揭示出來的,這就意味著教師需要有深刻解讀教材的能力,能挖掘出教材不同單元、章節中的不同知識點可能具有相同的觀念內涵。[2]進行單元整體教學,概括提煉單元核心概念知識能體現化學基本觀念,并運用基本觀念指導不同層次的化學知識的學習,能有效促進學生化學基本觀念的形成。
一、單元整體分析
“離子反應”位于人教版化學(必修第一冊)第一章第二節,涉及到的內容主要是電解質的電離和復分解反應類型的離子反應,屬于核心的基礎概念知識。新課標對其內容提出了明確要求:認識酸、堿、鹽等電解質在水溶液或熔融狀態下能發生電離,通過實驗事實認識離子反應及其發生的條件,了解常見離子的檢驗。[3]可見課程標準這部分內容剖析了離子反應的認識角度,即從“微觀角度認識溶液中物質的存在與變化”。但在常規教學中往往側重于“知識本位”,教學目標圍繞知識習得、知識應試展開,讓學生知道如何辨析電解質的概念、學會書寫離子方程式、掌握常見離子的檢驗,卻沒有認識到電離、離子反應內容對促進學生認識發展和微粒觀構建的教學價值。[4]
微粒觀是化學學科的重要觀念,也是學生難以構建的觀念。學生自初三接觸化學以來一直在構建微粒觀,學生知道物質是由原子、分子、離子等微粒構成,認識酸、堿、鹽溶于水之后會解離出離子,了解溶液的導電性是與溶液中的離子是有關的,但是學生對于溶液中離子的來源,離子在水溶液中的行為缺乏全面的認識,電離和離子反應的學習,能幫助學生從微觀上理解物質在水溶液中的行為,將進一步發展學生的微粒觀。[5]現有的將電離與離子反應作為核心概念和關鍵活動進行實施的“離子反應”的單元整體教學設計,[4,6~7]可促進學生微粒觀的構建和發展,值得借鑒。基于上述分析,筆者以解決實際教學問題為出發點,深入挖掘核心知識的教學價值為目的,開展了以“氯化鈉”為主題的“離子反應”單元整體教學設計的嘗試。教學過程中重視電離的教學,從微觀角度引導概念的生成、微觀表征及其過程與反應原理,旨在促進學生微粒觀的構建與發展。
二、單元教學目標
(1)通過創設情境“濕手摸電器易發生觸電”引出對氯化鈉溶液導電的分析,認識電離;從宏觀—微觀—符號三重表征電離過程,促進學生微粒觀的發展;從電離的角度認識酸、堿、鹽,引導學生從宏觀視角進入微觀層面認識酸、堿、鹽;從電離的角度對化合物進行分類,進而引導學生生成“電解質”的概念。
(2)通過創設情境“指紋破案”,測定NaCl 溶液和AgNO3溶液反應過程中的電導率變化趨勢,引出離子反應,并從微觀角度認識物質在溶液中的反應;預測稀鹽酸和Na2CO3溶液反應現象并實施實驗,學生自主分析溶液中能發生反應的離子,再依據實驗現象總結出復分解反應類型的離子反應發生的條件;判斷能兩兩發生復分解反應的組合,找出實際參與反應的離子,用離子方程式表示出來,并總結離子方程式書寫的方法和程序。
(3)解決實際問題——粗鹽提純,從微觀角度分析粗鹽中的可溶性雜質離子,分組實驗并運用所學知識檢驗雜質離子和除去雜質離子,歸納總結出除去溶液中雜質離子的一般思路。
三、教學流程
基于單元整體的教學形式符合新課標的教學要求,能承載化學觀念的構建。因此,本次“離子反應”專題單元整體教學以常見物質氯化鈉為主題,重新鏈接電離、電解質、離子反應等核心概念知識,將概念的形成與應用作為一個教學單元,旨在促進學生的微粒觀的發展,教學課時共劃分為3個課時,具體教學流程如圖1所示。
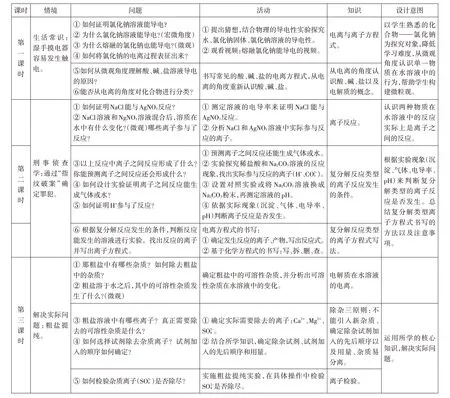
圖1 教學流程
第1 課時通過建立電離概念,學會從微觀角度認識單一物質在水溶液中的存在狀態和行為,并從宏觀—微觀—符號三重表征電離的過程,幫助學生構建微粒觀。第2課時是從微觀角度分析兩種物質在水溶液中的存在狀態和行為,認識兩種物質在水溶液中的反應實質是離子之間的反應,能深化對溶液中化學反應的認識思路。第3課時是運用從微觀角度認識溶液中反應的思路和方法,解決實際問題——粗鹽提純。
四、教學實錄
本次“離子反應”單元整體教學的3個課時已經全部實施,其中課時1 和課時2 的內容屬于核心概念知識,有助于學生微粒觀的形成,并對后續的深入學習具有指導意義,具體教學實錄如下:
1.宏觀—微觀—符號三重表征電離過程
【情境】展示濕手觸摸電器易發生觸電的視頻,以及人手汗液中的主要鹽成分(NaCl)。
【教師】濕手摸電器為什么容易發生觸電?
【學生】結合初中所學科學探究的一般過程,對提出的問題作出猜想(猜想一:NaCl 固體導電、猜想二:水導電、猜想三:NaCl溶液導電),并設計實驗(測定物質的導電性實驗)驗證猜想三成立。
【教師】為什么NaCl 溶液能導電呢(微觀)?引導學生結合物理知識“電流產生的條件”進行分析。
【學生】NaCl溶液中有自由移動的離子。
【教師】為什么NaCl 固體不能導電呢?展示氯化鈉晶體的微觀示意圖。
【學生】有離子但不能自由移動。
【教師】水在NaCl 固體溶解過程中起到什么作用?展示氯化鈉固體溶于水的微觀示意圖。
【學生】水分子能將緊密連結的鈉離子和氯離子分離開來,產生能自由移動的鈉離子和氯離子。
【教師】離子要自由移動需要借助外力,如果將氯化鈉固體加熱融化,能否產生自由移動的離子?播放熔融氯化鈉能導電的視頻。
【總結】電離:化合物產生能夠自由移動的離子的過程。條件:溶于水或受熱熔化。
【教師】如何用化學語言表示氯化鈉的電離過程?
2.運用電離概念從本質上認識酸、堿、鹽
【教師】結合初中知識,你能從微觀角度解釋稀鹽酸和氫氧化鈉溶液導電的原因嗎?
【學生】說出溶液中存在的帶電粒子以及來源:
【教師】稀鹽酸、稀硫酸、稀硝酸均能使石蕊溶液變紅,為什么?稀氫氧化鈉溶液、稀氫氧化鉀溶液、稀氫氧化鋇溶液均能使石蕊溶液變藍,為什么?(微觀角度分析)
【學生】酸溶液中都有氫離子。堿溶液中都有氫氧根離子。
【教師】如何從電離的角度認識酸、堿、鹽(列舉一些可溶性的酸、堿、鹽)?怎么用電離方程式表示?
【學生】寫出相應的電離方程式,并從電離的角度重新定義酸、堿、鹽。
【教師】能否從電離的角度,對化合物進行分類?
【學生】把能夠電離的化合物劃分為一類,教師順勢提出“電解質”的概念。
【總結】電解質:在水溶液或熔融狀態下能產生自由移動的離子(導電)的化合物。例如:強酸、強堿、大多數鹽。
非電解質:在水溶液和熔融狀態下都不能產生自由移動的離子(導電)的化合物。例如:非金屬氧化物、大多數有機物。
【情境釋疑】汗液的主要成分是氯化鈉,氯化鈉屬于電解質,溶于水會形成自由移動的鈉離子和氯離子,因而濕手摸電器更容易發生觸電。
3.兩種物質在水溶液中發生反應的實質——離子反應
【情境】罪犯偵查學常通過指紋鑒別來確定罪犯。模擬指紋破案:將大拇指深深地在濾紙上按一下,涂上硝酸銀溶液,在燈光下照射一會兒就顯現出灰黑色的指紋。注解:氯化銀在光的作用下會分解成細微的灰黑色銀粒。
【教師】同學們能解釋其中的原因嗎?
【學生】手指上有汗液,溶質的主要成分是氯化鈉,硝酸銀可以與氯化鈉反應,生成的氯化銀被光照后發生顏色變化,指紋便顯現出來。
【教師】如何證明硝酸銀可以與氯化鈉反應?教師需要引導學生從溶液中離子的種類和數目進行思考——測電導率。
【學生】將電導率儀插入NaCl溶液中,再向其中加入AgNO3溶液,通過儀器可觀察溶液電導率下降。
【教師】同學們能解釋電導率下降的原因嗎?
【學生】NaCl 與AgNO3反應后生成的AgCl 是難溶于水的物質,難解離出自由移動的離子,從而使得溶液中離子的種類和數目減少,所以,電導率下降。
【教師】NaCl溶液和AgNO3溶液混合后,溶質在水中有什么變化?(微觀角度)哪些離子參與了反應?
【學生】教師引導學生分析:
【教師】如何從微觀角度理解這一反應?
【學生】離子之間發生了反應。
【總結】離子反應:電解質在溶液中的反應實際上是離子之間的反應。
4.探究復分解類型離子反應發生的條件
【教師】以上反應中離子之間反應形成了什么?離子之間反應還會形成什么?
【學生】沉淀。還會形成氣體或水(預測)。
【教師】向稀鹽酸中加入Na2CO3溶液,會有什么現象?請預測參與反應的離子。
【學生】現象:有氣泡產生。預測:H+、CO2-3。
【教師】如何證明H+參與了反應?并設計實驗證明。
【學生】實施實驗,用pH試紙測定反應前后的pH(H+濃度變小)。
【教師】除了H+參與反應能使H+濃度變小,是否有其他可能使H+濃度變小?
【學生】加入的Na2CO3溶液中有水,可能將H+稀釋,也能使濃度變小。
【教師】如何設計實驗消除稀釋的影響?
【學生】方法1:設置對照實驗,方法2:Na2CO3溶液換成Na2CO3固體。
【教師】實驗證明H+和CO2-3能反應,你能寫出該反應的生成物嗎?
【教師】復分解類型的離子反應可以生成沉淀、氣體或水,也可以依據實驗現象(沉淀、氣體、電導率、pH)來判斷復分解類型的離子反應是否發生。
【總結】復分解反應類型的離子反應發生的條件:形成沉淀、氣體或者水。
5.總結復分解類型離子反應的書寫方法
【教師】根據復分解反應發生的條件,判斷反應能發生的溶液進行實驗。找出發生反應的離子并寫出離子方程式。提供的試劑:Na2CO3溶液、稀鹽酸、NaOH溶液、BaCl2溶液。
【學生】:選取藥品進行實驗,并寫出離子方程式。
【總結】離子方程式:用實際參與反應的離子表示離子反應的式子。
方法1:確定發生反應的離子、產物,直接寫出離子方程式,再配平。
方法2:基于化學方程式拆寫離子方程式,包括寫、拆、刪、查。
五、教學反思
本課題是以學生熟悉的物質——氯化鈉為主題,重新鏈接“離子反應”章節核心知識內容進行的單元整體教學,旨在幫助學生發展微粒觀,能從微觀的角度認識物質在溶液中的變化、存在以及相互作用,并學以致用,解決實際問題。在單元整體教學的3課時中,都有創設真實可信的教學情境、突出微粒觀的問題設計、宏微結合的視角分析問題、運用實驗探究解決問題等環節,學生在獲取核心概念知識的過程中對化學學科本質規律的認識更加深刻,可以有效地促進微粒觀的構建和發展。


