應用量子化學計算理解溶劑對CH3O-/CH3S-親核性的影響
朱榮秀,王小莫,郭今心,張冬菊
山東大學化學與化工學院,濟南 250100
1 前言
雙分子親核取代反應(SN2)是有機化學中最基本、最具代表性的經典反應類型,用于將一個官能團置換為另一個官能團,在有機合成領域有重要應用。如式(1)所示,SN2反應是一個一步反應,親核試劑從離去基團的背面進攻親電碳原子,經歷瓦爾登(Walden)型過渡態形成相應的構型反轉產物[1]。
親核試劑的親核性強弱對SN2反應有重要影響,其親核性越強,反應越容易發生。研究表明,親核試劑的親核性不僅取決于其本身的結構,而且與反應溶劑密切相關。溶劑類型及極性大小對親核試劑的反應活性有很大的影響,闡明不同溶劑對親核試劑親核性的影響是化學類各專業有機化學教學中的重要內容[2,3]。CH3O-和CH3S-是一類重要的親核試劑,有機化學教材中強調[3],其親核能力受溶劑影響顯著,在極性質子溶劑中,親核性是CH3S-> CH3O-;而在極性非質子溶劑中,親核性則是CH3S-< CH3O-。教材中通常通過比較兩種親核試劑的可極化程度、與溶劑形成氫鍵能力的強弱等解釋其親核能力的變化,缺少定量、直觀的信息。本文以CH3O-/CH3S-與CH3Cl的SN2反應為例,探討溶劑對CH3O-和CH3S-親核性的影響,以期加深學生對相關內容的理解,探討計算化學在有機化學教學中的應用。
2 模型反應與計算方法
本文研究的模型反應如式(2)、式(3)所示。基于密度泛函理論計算首先研究了氣相中的反應,繼而采用隱含溶劑模型以及顯含+隱含溶劑模型方法探討了溶劑對反應性能的影響。計算中涉及的溶劑包括極性非質子溶劑(乙腈、丙酮和氯仿)和極性質子溶劑(水和甲醇)。隱含溶劑模型采用溶質全電子密度(SMD)溶劑化模型方法進行模擬,而顯含+隱含溶劑模型則是在隱含溶劑模型的基礎上在反應中心加入一個溶劑分子。
全部計算使用Gaussian 09程序[4]完成。結構優化使用M06-2x[5]泛函和aug-cc-pvtz基組,對勢能面上的各駐點(包括反應物、中間體、過渡態及產物等)進行了幾何構型全優化,并使用同樣的理論水平進行了振動頻率分析,確認了穩定點的性質,極小點無虛頻、過渡態有且僅有一個虛頻。對全部過渡態進行了內稟反應坐標(IRC)計算,確認了對應的產物和反應物。自然鍵軌道(NBO)分析使用Gaussian 09軟件包中的NBO 3.1程序進行[6]。為了獲得更精確的相對吉布斯自由能量,在CCSD(T)[7]/aug-cc-pvtz水平上對各駐點進行了單點能計算。
親核試劑的親核能力可通過其最高占據分子軌道(HOMO)的能級(εHOMO)高低予以評估,εHOMO值越大,分子活性越高,其親核能力越強。通常將四氰乙烯(TCE,εHOMO最低的有機分子)的HOMO能級作為參考,定義親核試劑的親核指數(N)如下[8,9]:
其中,εHOMO(Nu)和εHOMO(TCE)分別表示親核試劑和TCE的HOMO能級。文中給出的親核指數,均考慮了溶劑的影響。各結構名字的前綴g-,w-,m-和a-分別代表氣相、水、甲醇和乙腈中的反應;與CH3OS-相關的結構,在其相應的名字上加上撇號,以區別于CH3O-對應的結構。
3 結果與討論
3.1 氣相模型
計算的兩個氣相反應的勢能剖面示于圖1,其中孤立反應物的能量設為能量零點。對于CH3S-的反應(圖1a),計算的反應機制與教科書中的描述一致,是一步完成的協同反應,勢能面呈雙勢阱特征。親核試劑CH3S-首先與CH3Cl形成初始離子-偶極復合物IM1’,放熱9.3 kJ·mol-1;然后經歷過渡態TS1’形成產物型離子-偶極復合物IM2’,需克服的能壘為17.7 kJ·mol-1,反應放熱107.7 kJ·mol-1;最后IM2’解離為產物CH3SCH3和Cl-,該過程吸熱7.0 kJ·mol-1。
對于CH3O-的反應,計算的機理涉及兩個基元步驟,反應呈現三勢阱特征,這與文獻中報道的F-與CH3Cl的親核取代反應類似[10]。由于氧的電負性較強,CH3O-容易與CH3Cl形成較穩定的氫鍵絡合物IM0,放熱31.5 kJ·mol-1;氫鍵絡合物經TS0轉化為穩定性相對較差的離子-偶極配合物IM1;隨后IM1經歷瓦爾登轉化過渡態TS1,形成產物型離子-偶極配合物IM2;最后IM2解離得到取代的產物CH3OCH3和Cl-。總的反應能壘為15.4 kJ·mol-1,反應放熱180.8 kJ·mol-1。
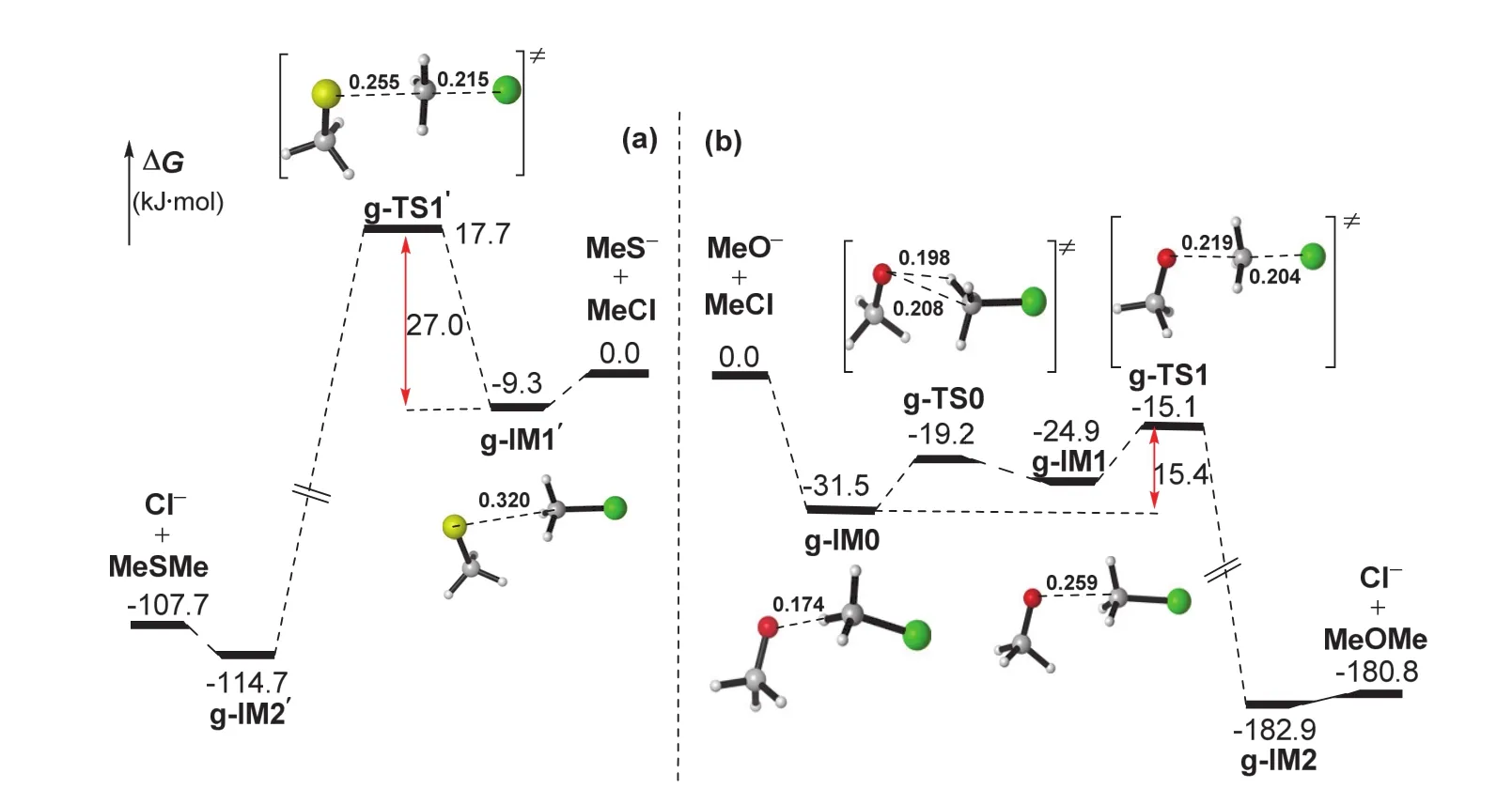
圖1 計算的氣相中SN2反應的勢能剖面圖
顯然,氣相中的兩個反應都是放熱反應,能壘低,是熱力學可行和動力學有利的過程。與CH3S-相比,CH3O-更容易與CH3Cl發生SN2親核取代反應,即在氣相中CH3O-的親核性大于CH3S-。兩個反應有明顯差異,CH3O-的反應,涉及氫鍵絡合物和離子-偶極復合物的形成;而CH3S-的反應,由于硫的電負性較弱,不能形成穩定的氫鍵絡合物,反應中僅涉及離子-偶極復合物。
3.2 隱含溶劑模型
采用隱含溶劑模型SMD方法進一步研究了極性溶劑中上述兩個親核取代反應,使用的溶劑包括乙腈、丙酮、氯仿、水和甲醇等常用溶劑。這些極性溶劑可分為兩類,極性非質子溶劑(乙腈、丙酮、氯仿)和極性質子溶劑(水和甲醇)。圖2中給出了使用水和乙腈分別作為極性質子溶劑和極性非質子溶劑的計算結果,并和其它三種溶劑的計算結果一并列于表1。
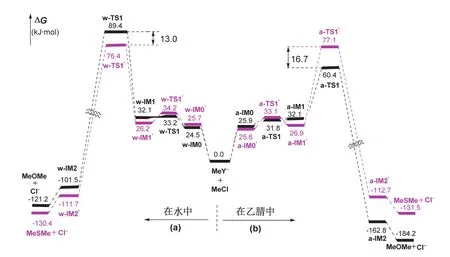
圖2 使用隱含溶劑模型計算的勢能剖面,使用水(a)或乙腈(b)做溶劑
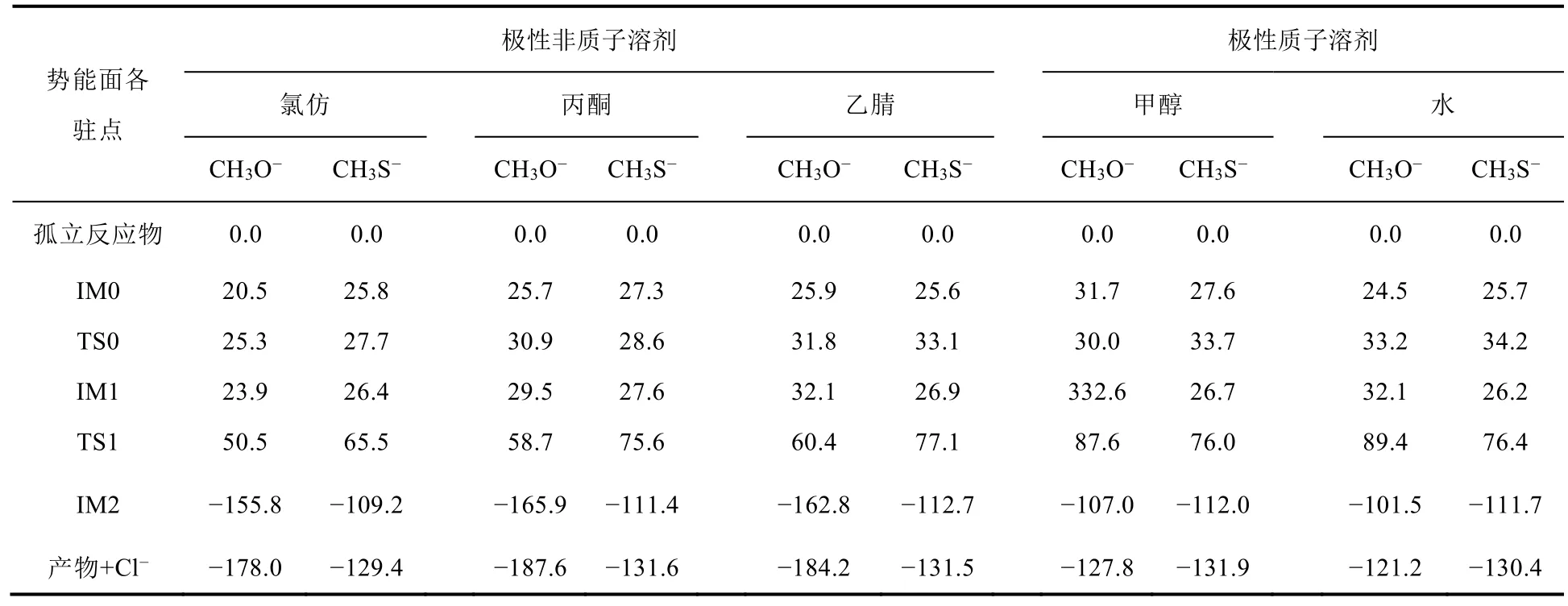
表1 不同極性溶劑中反應勢能面上各駐點的相對吉布斯自由能(kJ·mol-1)
與氣相中反應相比,極性溶劑對反應的影響體現在如下三個方面:1)兩個親核試劑的反應,均經歷兩個基元步驟,在通常的瓦爾登轉化之前,涉及氫鍵絡合物到離子-偶極配合物的轉化;2)氫鍵絡合物和離子-偶極配合物的形成,由氣相中的放熱過程變為吸熱過程;3)反應能壘明顯增大。這些結果表明,極性溶劑不僅顯著影響反應的熱力學和動力學性質,而且對反應機制有一定影響。
更重要的是,計算發現,兩類溶劑對兩個親核試劑親核性的影響是截然不同的。在極性質子溶劑中,親核性是CH3O-< CH3S-;而極性非質子溶劑中,則是CH3O-> CH3S。如圖2所示,水溶劑中,CH3O-與CH3Cl反應的能壘為89.4 kJ·mol-1,而CH3S-與CH3Cl反應的能壘為76.4 kJ·mol-1,二者相差13.0 kJ·mol-1,逆轉氣相中兩個親核試劑的相對親核能力,使CH3S-的親核性更強,CH3S-與CH3Cl的反應更容易發生。在乙腈溶劑中,兩個親核試劑的反應性則恰好相反,CH3O-體系的能壘為60.4 kJ·mol-1,而CH3S-體系的能壘為77.1 kJ·mol-1,這與氣相中二者的相對親核能力一致,CH3O-的親核性更強,CH3O-與CH3Cl的親核取代反應動力學上更有利。
從這些結果還可以看出,極性質子溶劑對CH3O-的親核性的影響遠大于對CH3S-的影響,如CH3S-與CH3Cl反應的能壘在水和乙腈中非常接近(76.4 vs. 77.1 kJ·mol-1),而CH3O-與CH3Cl的反應在水中的能壘比在乙腈中高29.0 kJ·mol-1。這可以從兩個親核試劑的堿性和變形性不同予以理解,CH3O-中氧的電負性較大,堿性較強,容易與極性質子溶劑形成氫鍵絡合物,削弱其親核能力;而CH3S-中硫的電負性相對較小,堿性較弱,但其變形性較大,其親核性主要與溶劑的極性大小有關。計算結果驗證了有機化學教材中關于溶劑對親核試劑親核性的定性描述,即在極性非質子溶劑中同族的親核試劑親核性順序與堿性一致(堿性:CH3O-> CH3S-);在極性質子溶劑中,親核性與其堿性大小順序相反,而與可極化性順序一致(可極化性:CH3O-< CH3S-)。
3.3 隱含溶劑模型+顯含溶劑模型
為進一步理解甲醇和水等極性質子溶劑對反應性能的影響,我們在隱含溶劑模型的基礎上將計算模型增加了一個溶劑分子,計算結果示于圖3。結果表明,將一個溶劑分子引入反應體系,二者均為一步反應,只涉及經典的瓦爾登型過渡態,隱含溶劑模型識別的初始氫鍵絡合物不再是勢能面上的穩定點。
計算發現,甲醇和水作為氫鍵供體對反應的影響幾乎相同,對于兩個反應,計算的能壘差值均小于2kJ·mol-1(圖3a),過渡態的構型參數也幾乎相同(圖3b)。與隱含溶劑模型的計算結果類似,CH3S-體系的能壘明顯低于CH3O-體系的能壘,進一步證實極性質子溶劑中,CH3S-的親核性大于CH3O-。與隱含溶劑模型相比,使用顯含+隱含溶劑模型計算的反應能壘較高,升高約10kJ·mol-1,表明極性質子溶劑不利于本文討論的SN2反應。
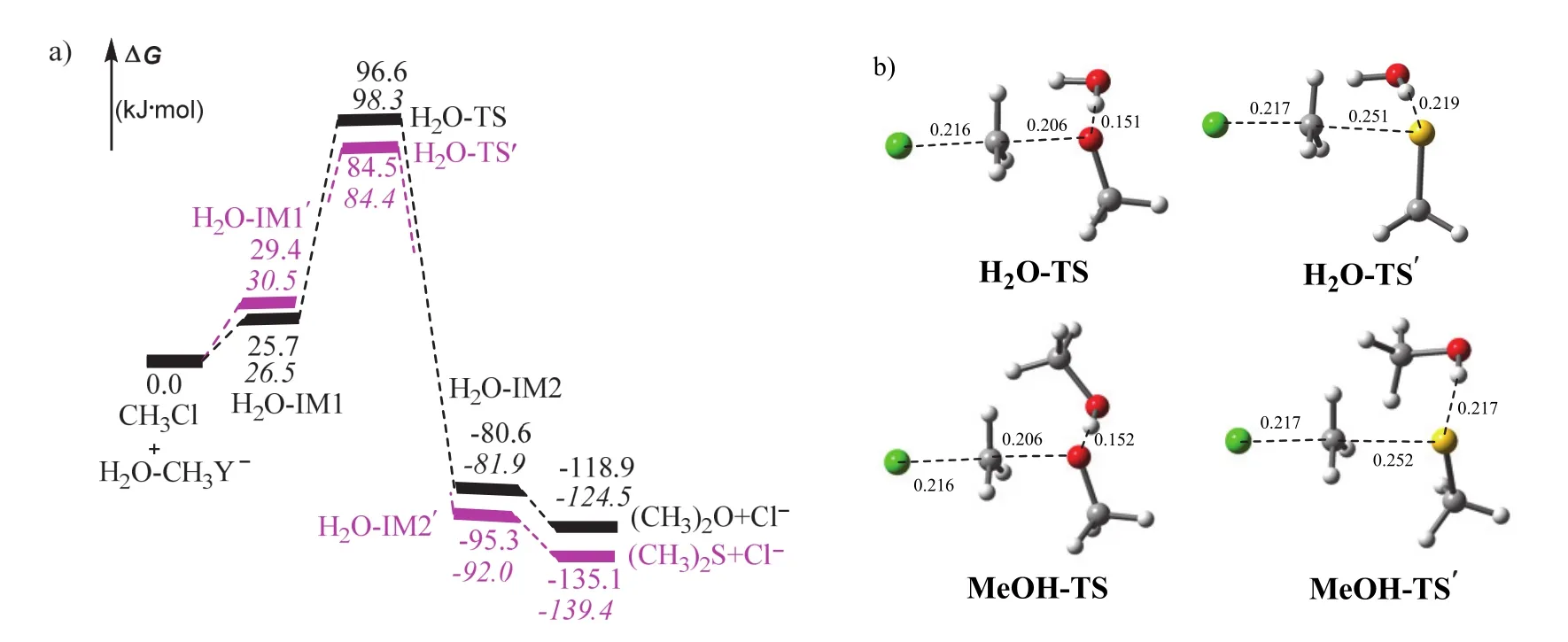
圖3 使用隱含溶劑+顯含溶劑模型的計算結果
另外,親核試劑的親核性也可以計算其親核指數予以評估。根據計算的親核試劑的HOMO能級以及TCE的HOMO能級(在水和甲醇中分別為-11.46和-11.49 eV),表2列出了計算的兩個親核試劑的親核指數(N)。可以看出,無論使用隱含溶劑模型還是顯含+隱含溶劑模型,無論是水溶劑還是甲醇溶劑,CH3S-的親核指數均大于相應CH3O-的親核指數,進一步證實在極性質子溶劑中CH3S-的親核性大于CH3O-。
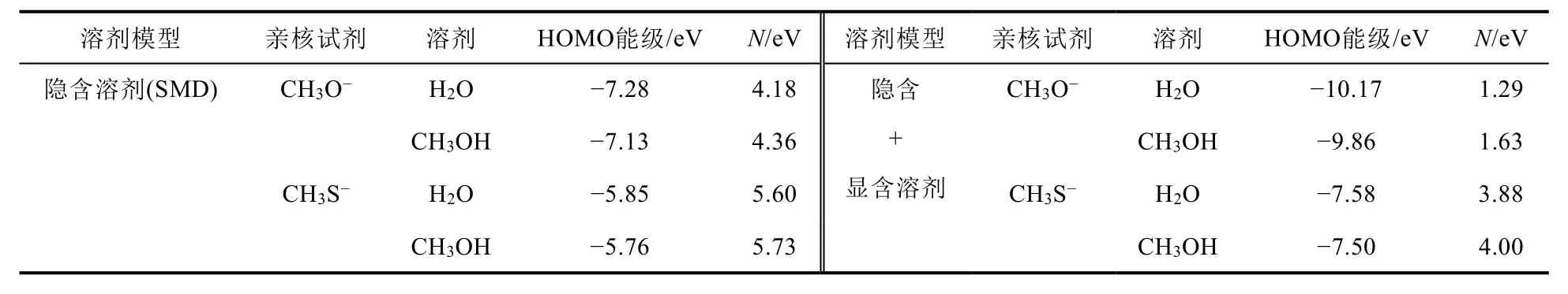
表2 CH3O-和CH3S-的親核指數(N)
4 結語
采用量子化學計算研究了不同類型溶劑中親核試劑CH3O-/CH3S-與CH3Cl的親核取代反應,計算了反應的熱力學(反應熱)和動力學(能壘)性質,明確了溶劑對親核試劑親核性的影響。研究結果給出了描述兩種親核試劑在極性質子溶劑和極性非質子溶劑中親核性變化規律的定量信息,有助于加深學生對相關內容的理解和掌握。本文內容可作為計算化學輔助有機化學教學的典型案例,豐富有機化學的教學內容,激發學生學習有機化學和計算化學的興趣。

