POU2F1調控miR-433-3p抑制胃癌細胞增殖、遷移的實驗研究
趙軼峰,李明霞,張 超,胡小敏,王 雄,趙鐵軍
胃癌是世界范圍內一種可致命的癌癥,具有復發率高、轉移快的特點[1]。盡管胃癌的診斷和治療取得一定進展,但是臨床預后依然很差,5年生存率僅為21.35%[2]。因此,深入了解胃癌進展的分子機制可以為改善其預后提供有價值的生物學標志物和潛在的治療靶點。微小核糖核酸(miRNA)是一類由19~25個核苷酸組成的單鏈非編碼RNA,能夠參與細胞增殖、凋亡、遷移和分化等許多生物過程[3]。最近研究表明,位于14號染色體上的抑癌基因miR-433-3p通過靶向生長因子受體結合蛋白2抑制食管鱗狀細胞癌的增殖和侵襲[4]。然而,正如大多數文獻報道,對于miR-433-3p的研究僅局限于靶基因的鑒定及對細胞生物學功能的影響方面,而關于其自身轉錄調控機制的研究卻很少。本研究通過生物信息學預測發現第2類POU結構域轉錄因子1(POU2F1)與miR-433-3p啟動子區存在結合位點,POU2F1作為POU同源域家族的一員,已有研究顯示其在肝癌組織中高表達,POU2F1過表達促進了肝癌細胞增殖、集落形成、上皮間質轉化、遷移和侵襲,而沉默POU2F1表達則抑制了這些惡性表型[5]。但POU2F1調控miR-433-3p對胃癌細胞增殖、遷移的影響鮮有報道。因此,本研究旨在探索POU2F1對miR-433-3p表達的調控作用及對胃癌細胞增殖、遷移的影響,以期進一步闡明胃癌的發病機制。
1 材料與方法
1.1材料
1.1.1胃癌組織樣本及細胞:2021年6月—2022年4月在河北北方學院附屬第一醫院共收集45例胃癌組織及與之匹配的癌旁組織(距癌組織4 cm處)。其中男22例,女23例;年齡(57.25±3.45)歲;Ⅰ~Ⅱ期24例,Ⅲ~Ⅳ期21例。將所有臨床組織標本在液氮中速凍后保存于-80 ℃冰箱中。所有臨床組織標本的組織學診斷至少由2名病理專家證實。胃癌患者在手術或活檢前均未接受任何抗腫瘤治療。所有患者在本研究開始前簽署本研究知情同意書。人胃黏膜上皮細胞株GES-1和人胃癌細胞株BGC-823、MKN-28、SGC-7901均購自上海信裕生物科技有限公司,批號分別為XY19167、XY19325、XY26331、XY23115。本研究獲得醫院醫學倫理委員會批準。
1.1.2主要試劑與儀器:POU2F1小干擾RNA(siRNA)、POU2F1 siRNA陰性對照、miR-433-3p siRNA、miR-433-3p siRNA陰性對照及miR-433-3p、POU2F1、U6引物均由上海基屹生物科技有限公司設計合成;RPMI-1640培養基(批號KE1902)、Trizol試劑(批號KE13127)、RIPA裂解液(批號KE04361)、LipofectamineTM2000轉染試劑盒(批號KE90117)、四甲基偶氮唑藍(MTT,批號KE20035)均購自上海創凌生物科技有限公司;胎牛血清(FBS,批號90170)、羊抗鼠二抗(批號33175)、化學發光試劑盒(批號40219)均購自北京威瑞谷生物技術有限公司;鼠源POU2F1(批號1076R)、GAPDH單克隆抗體(批號1013R)、雙熒光素酶報告基因檢測試劑盒(批號4159K)均購自常州福生生物技術有限公司;CO2培養箱(型號Galaxy 48)、酶標儀(型號Sunrise)、凝膠成像儀(型號ChampChemi 580)均購自北京博勱行儀器有限公司;qRT-PCR儀(型號CG-05)、Transwell小室(型號PIEP12R48)均購自北京明陽科華科技有限責任公司。
1.2研究方法
1.2.1細胞培養:將人胃黏膜上皮細胞株GES-1及人胃癌細胞株BGC-823、MKN-28、SGC-7901在RPMI-1640培養基中培養,該培養基含有10%FBS、鏈霉素100 U/ml和青霉素100 U/ml,置于含有5% CO2的37 ℃培養箱中。取對數生長期細胞用于后續實驗。
1.2.2qRT-PCR檢測胃癌組織、癌旁組織和GES-1、BGC-823、MKN-28、SGC-7901細胞中miR-433-3p、POU2F1 mRNA表達:將胃癌組織和癌旁組織勻漿,使用Trizol試劑從胃癌組織、癌旁組織和GES-1、BGC-823、MKN-28、SGC-7901細胞中提取總RNA。使用NanoDrop 2000分光光度計測定RNA濃度后,將RNA反轉錄為cDNA。在PCR系統上使用TransStart? Green qPCR SuperMix進行PCR擴增。引物序列:miR-433-3p上游引物:5′-AGAAGTACGGTGAGCCTGTC-3′,miR-433-3p下游引物:5′-GCTCTCACTCTGTCACCCAG-3′;POU2F1上游引物:5′-ATCTGGACTACGCTAGCTGAC-3′,POU2F1下游引物:5′-CGTAGTCCGATCAAGCTAGCA-3′;U6上游引物:5′-CTCGCTTCGGCACACA-3′,U6下游引物:5′-TGGTGTCGTGGAGTCG-3′。以U6作為內參,通過2-ΔΔCt法分析miR-433-3p、POU2F1 mRNA的相對表達。每種細胞設置6個重復組。
1.2.3蛋白印跡法檢測胃癌組織、癌旁組織和GES-1、BGC-823、MKN-28、SGC-7901細胞中POU2F1蛋白表達:將胃癌組織和癌旁組織勻漿,利用RIPA裂解液提取胃癌組織、癌旁組織和GES-1、BGC-823、MKN-28、SGC-7901細胞中蛋白質,定量蛋白濃度后,通過電泳分離等量蛋白質。電泳結束后,將蛋白質轉移至聚偏氟乙烯膜上,然后用5%脫脂牛奶封閉膜2 h,用TBST洗膜3次,再將膜分別與鼠源POU2F1(1︰2000)、GAPDH(1︰3000)一抗在4 ℃下孵育過夜。第2日用TBST洗膜3次后,將膜與羊抗鼠二抗(1︰2000)于室溫下孵育3 h,化學發光試劑盒可視化蛋白,采用Image軟件對灰度值進行量化分析(內參為GAPDH)。每種細胞設置6個重復組。
1.2.4BGC-823細胞轉染與分組:取對數生長期BGC-823細胞,利用LipofectamineTM2000轉染試劑盒進行轉染,分為空白組(細胞未轉染)、POU2F1 siRNA組(POU2F1 siRNA轉染細胞)、POU2F1 siRNA-NC組(POU2F1 siRNA陰性對照轉染細胞)、miR-433-3p siRNA組(miR-433-3p siRNA轉染細胞)、miR-433-3p siRNA-NC組(miR-433-3p siRNA陰性對照轉染細胞)、miR-433-3p siRNA+POU2F1 siRNA-NC組(miR-433-3p siRNA和POU2F1 siRNA陰性對照共轉染細胞)、miR-433-3p siRNA+POU2F1 siRNA組(miR-433-3p siRNA和POU2F1 siRNA共轉染細胞)。每組設置6個復孔。
1.2.5MTT法檢測BGC-823細胞增殖能力:將“1.2.4”中轉染后培養48 h的各組BGC-823細胞以1×103個/孔的密度接種在96孔板上,向每孔中加入MTT 10 μl,于37 ℃、5% CO2條件下培養3 h,然后向每孔中加入二甲基亞砜150 μl,使用酶標儀測定490 nm波長處的光密度(OD)值,計算BGC-823細胞增殖率,增殖率=各轉染組OD值/空白組OD值×100%。
1.2.6Transwell實驗檢測BGC-823細胞遷移能力:將“1.2.4”中轉染后的各組BGC-823細胞加入到無FBS的RPMI-1640培養基重懸后,調整細胞濃度為2×105個/ml,取100 μl轉移至Transwell上室中,并使用600 μl含有10% FBS的RPMI-1640培養基填充于Transwell下室中。48 h后,細胞用4%多聚甲醛固定20 min,0.1%結晶紫染色20 min,顯微鏡下隨機選取6個視野計數遷移細胞數目。
1.2.7qRT-PCR和蛋白印跡法檢測BGC-823細胞中miR-433-3p、POU2F1 mRNA和蛋白表達:將“1.2.4”中轉染后培養48 h的各組BGC-823細胞,按照“1.2.2”和“1.2.3”中的方法檢測BGC-823細胞中miR-433-3p、POU2F1 mRNA和蛋白表達。
1.2.8雙熒光素酶報告基因實驗:使用TransmiR v2.0 database在線軟件預測POU2F1與miR-433-3p啟動子區的結合位點,分別構建miR-433-3p啟動子區野生型(WT)和突變型(MUT)報告質粒,標記為miR-433-3p-WT、miR-433-3p-MUT。按照LipofectamineTM2000轉染試劑盒說明書將miR-433-3p-WT和miR-433-3p-MUT分別與POU2F1 siRNA陰性對照或POU2F1 siRNA共轉染于BGC-823細胞,分別記為:POU2F1 siRNA-NC+miR-433-3p-WT組(POU2F1 siRNA陰性對照和miR-433-3p-WT共轉染)、POU2F1 siRNA+miR-433-3p-WT組(POU2F1 siRNA和miR-433-3p-WT共轉染)、POU2F1 siRNA-NC+miR-433-3p-MUT組(POU2F1 siRNA陰性對照和miR-433-3p-MUT共轉染)、POU2F1 siRNA+miR-433-3p-MUT組(POU2F1 siRNA和miR-433-3p-MUT共轉染)。每組設置6個復孔,轉染48 h后,使用雙熒光素酶報告基因分析系統評估熒光素酶相對活性。
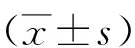
2 結果
2.1胃癌組織、癌旁組織中miR-433-3p及POU2F1 mRNA、蛋白表達比較 與癌旁組織比較,胃癌組織miR-433-3p表達水平顯著降低,POU2F1 mRNA和蛋白表達水平顯著升高(P<0.05),見表1。
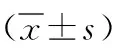
表1 胃癌組織、癌旁組織中miR-433-3p及POU2F1 mRNA、蛋白表達比較
2.2GES-1、BGC-823、MKN-28、SGC-7901細胞中miR-433-3p及POU2F1 mRNA、蛋白表達比較 與GES-1細胞比較,BGC-823、MKN-28、SGC-7901細胞miR-433-3p表達水平均降低,POU2F1 mRNA和蛋白表達水平均升高(P<0.05),其中BGC-823細胞miR-433-3p表達水平最低,POU2F1 mRNA和蛋白表達水平最高。見表2。因此選用BGC-823細胞為研究對象進行后續研究。
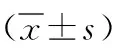
表2 GES-1、BGC-823、MKN-28、SGC-7901細胞中miR-433-3p及POU2F1 mRNA、蛋白表達比較
2.3沉默POU2F1對BGC-823細胞增殖、遷移及miR-433-3p、POU2F1 mRNA和POU2F1蛋白表達的影響 與空白組和POU2F1 siRNA-NC組比較,POU2F1 siRNA組BGC-823細胞增殖率、遷移細胞數目、POU2F1 mRNA和POU2F1蛋白表達水平顯著降低,miR-433-3p表達水平顯著升高(P<0.05);空白組和POU2F1 siRNA-NC組上述指標比較差異無統計學意義(P>0.05)。見表3。
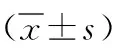
表3 沉默POU2F1對BGC-823細胞增殖、遷移及miR-433-3p、POU2F1 mRNA和POU2F1蛋白表達的影響
2.4沉默POU2F1逆轉下調miR-433-3p表達對BGC-823細胞增殖、遷移及miR-433-3p、POU2F1 mRNA和POU2F1蛋白表達的影響 與空白組和miR-433-3p siRNA-NC組比較,miR-433-3p siRNA組和miR-433-3p siRNA+POU2F1 siRNA-NC組BGC-823細胞增殖率、遷移細胞數目顯著升高(P<0.05),miR-433-3p表達水平顯著降低(P<0.05),POU2F1 mRNA和蛋白表達水平差異無統計學意義(P>0.05);與miR-433-3p siRNA組和miR-433-3p siRNA+POU2F1 siRNA-NC組比較,miR-433-3p siRNA+POU2F1 siRNA組BGC-823細胞增殖率、遷移細胞數目、POU2F1 mRNA和POU2F1蛋白表達水平顯著降低,miR-433-3p表達水平顯著升高(P<0.05)。見表4。
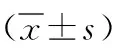
表4 沉默POU2F1逆轉下調miR-433-3p表達對BGC-823細胞增殖、遷移及miR-433-3p、POU2F1 mRNA和POU2F1蛋白表達的影響
2.5生物信息學預測miR-433-3p上游轉錄因子 使用TransmiR v2.0 database預測發現POU2F1與miR-433-3p啟動子區存在結合位點,結合位點位于14號染色體上的100881247~100881262區域,結合序列為GGGAGTGCAGAGCAT。雙熒光素酶報告基因實驗結果表明,POU2F1 siRNA-NC+miR-433-3p-WT組、POU2F1 siRNA+miR-433-3p-WT組、POU2F1 siRNA-NC+miR-433-3p-MUT組及POU2F1 siRNA+miR-433-3p-MUT組熒光素酶相對活性分別為1.09±0.13、2.06±0.19、1.06±0.12、1.04±0.11,與POU2F1 siRNA-NC+miR-433-3p-WT組比較,POU2F1 siRNA+miR-433-3p-WT組熒光素酶相對活性顯著升高(P<0.05);POU2F1 siRNA-NC+miR-433-3p-MUT組和POU2F1 siRNA+miR-433-3p-MUT組熒光素酶相對活性比較差異無統計學意義(P>0.05)。
3 討論
胃癌是癌癥相關死亡的第三大原因,也是全球第五大癌癥[6]。相關數據統計,東亞地區胃癌發病率急劇升高,該地區男女發病率在全球范圍內最高[7-8]。由于缺乏特異性生物學標志物,大多數新診斷的胃癌患者在確診時已處于晚期[9-10]。因此,迫切需要進一步研究胃癌的發病機制并確定與胃癌相關的特異性標志物。
miRNA在腫瘤細胞增殖、分化、凋亡、遷移和侵襲中發揮重要作用[11-12]。李燕等[13]發現miR-433-3p在宮頸癌細胞中低表達,miR-433-3p過表達可抑制宮頸癌細胞的增殖、遷移及侵襲。萬智雙等[14]表明miR-433-3p可通過下調絲裂原活化蛋白激酶8表達抑制肝癌細胞MHCC97H的遷移和侵襲。楊艷等[15]闡明下調miR-433-3p可促進結直腸癌HT-29細胞增殖、遷移、侵襲。SUN等[16]報道miR-433-3p通過靶向環磷酸腺苷反應元件結合蛋白來抑制神經膠質瘤細胞的生長、侵襲及遷移。本研究結果顯示,miR-433-3p在胃癌組織和胃癌細胞BGC-823、MKN-28、SGC-7901中呈低表達狀態,且miR-433-3p在BGC-823細胞中的表達水平最低,因此本研究選擇BGC-823細胞進行轉染實驗。本研究還發現,抑制miR-433-3p表達可明顯促進BGC-823細胞的增殖和遷移,提示miR-433-3p在胃癌中發揮著抑癌基因的作用。但關于miR-433-3p上游的調控機制尚不清楚,據報道轉錄因子可正向或負向調節miRNA的表達[17],因此本研究通過使用TransmiR v2.0 database預測發現轉錄因子POU2F1與miR-433-3p啟動子區存在結合位點。
POU2F1也稱為八聚體結合轉錄因子1,由染色體1q24.1上的基因位點編碼。它是一種普遍存在的轉錄因子,可調節與細胞周期相關靶基因的表達[18]。相關文獻報道,POU2F1通過脂肪非典型鈣黏蛋白1信號通路促進肝細胞癌的生長和轉移,可作為肝癌治療的靶點[19]。敲低POU2F1表達可導致頭頸部鱗狀細胞癌細胞的增殖和侵襲數目顯著減少[20]。POU2F1在肺癌細胞中高表達,且具有促進肺癌細胞上皮間充質轉化、遷移侵襲、增殖及克隆形成等生物學功能[21]。POU2F1在胃癌患者中上調并且與較差的存活率顯著相關[22]。有研究報道POU2F1可與miR-4490的啟動子序列互補結合調節miR-4490在胃癌中的表達[23]。但POU2F1與miR-433-3p在胃癌中的調控關系尚不十分清楚。本研究結果顯示,POU2F1 mRNA和蛋白在胃癌組織和細胞中高表達,雙熒光素酶報告基因實驗證實POU2F1作為轉錄因子,通過與miR-433-3p啟動子區結合,發揮調控miR-433-3p表達的作用;沉默POU2F1可抑制BGC-823細胞的增殖與遷移能力,促進miR-433-3p表達,下調miR-433-3p表達對BGC-823細胞增殖、遷移的影響。提示沉默POU2F1后,低表達的POU2F1可促進miR-433-3p表達進而發揮抑癌效應。
綜上,POU2F1可與miR-433-3p啟動子區結合,低表達的POU2F1可促進miR-433-3p表達,使miR-433-3p表達升高,進而抑制胃癌細胞的增殖與遷移。

