Siewert Ⅱ型食管胃結合部腺癌的外科治療現狀
黃亞迪,魏 猛,閆治波,孫丹平,鐘 鑫,劉 鵬,梁貽澤,曹偉波,趙汝東,于文濱
(1.山東大學齊魯醫院胃腸外科,山東 濟南,250012;2.威海市立二院普通外科;3.陽信縣中醫醫院普通外科)
胃癌作為消化系統最常見的惡性腫瘤之一,因其發病率高、預后差等,一直是研究的重點與熱點。胃癌在全球惡性腫瘤發病率中位居第五,每年有100多萬新發病例、76萬死亡病例,嚴重威脅人們的身體健康[1]。其中包括Siewert Ⅱ型食管胃結合部腺癌(adenocarcinoma of the esophagogastric junction,AEG)在內的胃上部癌近年發病率正在不斷升高[2]。AEG是指腫瘤中心位于食管胃交界(esophagogastric junction,EGJ)上、下5 cm內且累及EGJ的腺癌,由于位置特殊,且發病率在世界范圍內逐年上升,引起了人們的廣泛關注。美國國立綜合癌癥網絡胃癌治療指南建議[3],累及EGJ的腺癌均應進行Siewert腫瘤類型評估。SiewertⅠ型是食管下段腺癌,腫瘤中心位于解剖EGJ上方1~5 cm內;Siewert Ⅱ型是賁門癌,腫瘤中心位于EGJ上方1 cm至下方2 cm范圍內;SiewertⅢ型是賁門下癌,腫瘤中心位于EGJ下方2~5 cm,浸潤EGJ及以下部位、食管下端。目前針對Siewert Ⅰ型及Siewert Ⅲ型AEG的臨床治療已基本達成共識[4],但Siewert Ⅱ型AEG由于其解剖部位及生物學行為的特殊性,在手術入路、淋巴結清掃、切除范圍及消化道重建方式方面仍然備受爭議[5-6]。目前,盡管化學治療、靶向治療、經內鏡下黏膜切除術、內鏡下黏膜剝離術等可作為胃癌治療的選項,但以外科治療為主的綜合治療仍是胃癌治療的首選。本文以胃腸外科醫生視角,從胃切除范圍、淋巴結清掃及消化道重建三個方面闡述Siewert Ⅱ型AEG腫瘤的治療現狀。
1 胃切除范圍
對于早期Siewert Ⅱ型AEG,有經消化內鏡及外科手術兩種治療方式,而進展期Siewert Ⅱ型AEG只能通過外科手術達到根治目的。2019版的《Siewert Ⅱ型食管胃結合部腺癌腔鏡手術治療中國專家共識》[7]建議,腹腔鏡治療Siewert Ⅱ型AEG的手術指征為:(1)T分期≤cT3;(2)食管侵犯長度≤2 cm;(3)腫瘤直徑≤4 cm。對于大多數cT2或分期更高的AEG,中國臨床腫瘤學會胃癌治療指南[8]建議進行新輔助化療+胃切除術+輔助化療的綜合治療。日本胃癌治療指南[4]指出,在針對腫瘤進行胃切除術時,為達到根治性治療效果,應確保有足夠的切緣。對于T1期腫瘤,應獲得2 cm的大體切除邊緣。對于T2或更深的腫瘤,如果為擴張型生長,建議近緣至少3 cm;浸潤型生長則建議近緣至少5 cm。對于侵犯食管的腫瘤,切緣不一定要>5cm,但為了保證R0切除,最好將切線進行冰凍切片檢查。目前,Siewert Ⅱ型AEG的治療仍存在爭議,現將不同分期的Siewert Ⅱ型AEG的治療方式綜述如下。
1.1 早期胃癌 美國國立綜合癌癥網絡胃癌治療指南[3]建議,早期胃癌的診斷最好通過內鏡下病理結果進行明確。對于無絕對手術禁忌的早期胃癌患者,一般建議行內鏡下黏膜切除術、內鏡下黏膜剝離術或外科手術進行治療。對于病灶直徑≤2 cm且組織病理學顯示高或中高分化、未穿透淺表黏膜下層、未顯示淋巴血管浸潤且具有清晰的側切緣、深切緣時,內鏡下黏膜切除術或內鏡下黏膜剝離術可達到根治性切除。日本胃癌治療指南[4]也建議,對于病灶直徑≤2 cm且不伴潰瘍的分化型腺癌行內鏡下黏膜切除術或內鏡下黏膜剝離術。而對于臨床診斷為T1a,且病灶直徑≤2 cm的不伴潰瘍的未分化型黏膜內癌,是內鏡下黏膜剝離術的擴大指征[8]。而對于低分化、有淋巴血管浸潤證據、浸潤至黏膜下層深部、側切緣或深切緣陽性,或淋巴結轉移的胃癌,美國國立綜合癌癥網絡胃癌治療指南[3]認為,內鏡下黏膜切除術或內鏡下黏膜剝離術無法做到根治,應通過外科手術治療。對于早期Siewert Ⅱ型AEG的手術切除范圍,目前社會各界已基本達成共識,推薦行根治性近端胃大部切除術進行治療[4]。
1.2 進展期胃癌 對于具備手術指征的進展期胃癌,目前的首選治療方案仍是以手術治療為主的綜合治療,其手術方式有近端胃大部切除術、全胃切除術兩種,手術可通過開腹、腹腔鏡、機器人輔助三種方式進行。目前,腹腔鏡技術已趨于成熟,大量研究表明,與開腹手術相比,腹腔鏡技術具有術中視野清晰、淋巴結清掃徹底、術后康復快、術后并發癥少等優勢,具有逐漸取代開腹手術成為胃癌手術主流的趨勢[9]。但開腹手術對患者心肺功能影響較小,適應證更加廣泛,仍是臨床上不可摒棄的技術之一。機器人輔助技術作為新興技術,在胃癌手術治療方面的應用處于探索階段,仍需要大量多中心的前瞻性臨床研究去對比與腹腔鏡技術、開腹手術技術的優劣。
1.2.1 近端胃切除術 就Siewert Ⅱ型AEG而言,關于手術切除范圍的爭議仍然激烈[10],至今未制定出明確統一的標準來規范治療。根據日本胃癌治療指南[4]的建議,早期胃上部癌淋巴結轉移率較低,對于能保留一半以上遠端胃的近端cT1N0型腫瘤,可行近端胃大部切除術;而針對進展期胃癌,由于分期較晚,惡性程度較高,仍推薦行全胃切除術,以達到根治目的。Goto等[11]研究了AEG的淋巴結清掃獲益指數后認為,Siewert Ⅱ型AEG可選擇行近端胃切除術。綜合患者術后恢復、生存期、生活質量等多種因素考慮,目前我國胃癌治療指南[8]的胃癌手術切除原則是:基于腫瘤位置選擇胃切除的范圍,確保有足夠的手術切緣。這給了臨床醫生更大的選擇空間,也使得術者可綜合考慮腫瘤位置及其侵襲性、食管與殘胃狀態、患者與家屬意愿后選擇合適的手術切除范圍。此外,日本學者Mine等[12]的一項研究收集并分析了在7個臨床中心進行的進展期Siewert Ⅱ型AEG患者術后的淋巴結受累情況,發現腫瘤遠端至EGJ的距離小于3 cm時,胃大彎及幽門區的淋巴結轉移率為2.2%;腫瘤遠端距EGJ大于5 cm時,患者胃大彎及幽門區淋巴結的轉移率有了明顯升高(20%);因此,腫瘤遠端到EGJ的距離也是患者行近端胃切除的一個重要因素。這意味著對于進展期胃癌,腫瘤距EGJ在3 cm內,且術中有足夠的手術切緣,可行近端胃切除,從而保留部分殘胃功能,減少術后并發癥的發生。目前,雖然關于Siewert Ⅱ型AEG的最佳手術切除范圍仍在討論中,但近端胃切除術的療效已得到臨床醫生的認可,并逐漸得到普及。針對胃癌術后各種影響患者生活質量的并發癥,不少學者改良了術中消化道重建方式,并對其安全性、可行性及改善患者生活質量的能力進行了驗證。
1.2.2 全胃切除術 由于大多數胃癌患者就診時已處于進展期,腫瘤體積較大,侵及范圍較深,不滿足近端胃切除的要求,必須行全胃切除術以達到根治效果。全胃切除術的切除范圍包括賁門及幽門在內的全胃,全胃切除后通過近端空腸與食管進行吻合來重建消化道。相較近端胃大部切除術,全胃切除術淋巴結清掃更加徹底,杜絕了殘胃腫瘤復發的風險,由于全胃切除術后患者無胃酸分泌,反流性食管炎發生率較低,術后生活質量有一定提高。但同時由于舍棄了胃本身具有的儲備及分泌功能,改變了消化道的連續性,使得消化道中鹽酸及內因子等物質缺乏,食物的消化吸收受到一定影響,術后營養不足,體重減輕,傾倒綜合征等并發癥時有發生,給患者與術者帶來了極大的困擾[10]。目前,針對全胃切除術后的消化道重建方式,也有較多選擇。
2 淋巴結清掃
淋巴結轉移是胃癌預后與治療的重要指標,徹底的淋巴結清掃對于腫瘤根治具有重要意義。第7版的國際抗癌聯盟/美國癌癥聯合委員會TNM分期系統[13]建議,清掃淋巴結數量多于16枚。只有當清掃出的淋巴結數量大于16枚時,針對淋巴結轉移的病理分期才對腫瘤的分期及患者的術后生存具有更加明確的指導意義。淋巴結清掃不僅對于進展期腫瘤的術后治療具有一定的指導意義,在早期胃癌的治療中也發揮作用。雖然對于某些早期胃癌可通過內鏡下黏膜切除術或內鏡下黏膜剝離術進行治療,但早期胃癌仍存在一定的淋巴結轉移率。韓國的一項大型研究發現[14],早期胃癌的淋巴結轉移率為17.1%,而淋巴結的轉移與腫瘤的浸潤深度、分化類型及腫瘤大小有一定關系。Wang等[15]的研究表明,對于淋巴結轉移數量為0、1~2、3~6及>6枚的早期胃癌患者而言,五年生存率分別為94.9%、88.5%、64.3%、41.8%。此外,對于無淋巴結轉移或切除不少于15枚淋巴結的患者而言,其7年復發風險有所降低。因此,對于早期胃癌,行淋巴結清掃術不失為個體化的策略。
2.1 胃周淋巴結轉移規律及清掃范圍 關于胃周淋巴結清掃范圍的討論通常與胃切除的范圍有一定相關性,在全胃切除與近端胃切除的研究中,一個限制胃切除手術能否達到根治性切除的關鍵性因素就是淋巴結清掃范圍。Siewert Ⅱ型AEG位于EGJ,腫瘤兼具食管癌與胃癌的生物學特性,淋巴結清掃需考慮腹腔與縱隔兩處,是以有關淋巴結清掃范圍的研究也在如火如荼地進行。一項關于近端胃切除與全胃切除預后的研究[16]得出以下結論,胃癌浸潤越深,淋巴結轉移率越高,雖然近端胃次全切除術與全胃切除術后的長期結果并無明顯差異,但近端胃手術后長期生活質量優于全胃切除術。該研究認為,在胃上部三分之一的癌癥中,僅累及黏膜或黏膜下層的癌癥,甚至累及固有肌層的癌癥,其淋巴結轉移率均較低。然而,累及漿膜下的癌癥淋巴結轉移的發生率顯著增加。Feith等[17]的研究發現,在Siewert Ⅱ型AEG中,賁門左(67%)、賁門右(63%)、胃小彎(66%)、胃左動脈、脾動脈與腹主動脈(25%)是主要的淋巴結轉移部位,其他部位的淋巴結轉移很少發生。日本的一項大型研究表明[18],胃癌中,4sa、4sb、4d、5、6號淋巴結的轉移率均低于1%,與腫瘤部位、pT分期無關,超過90%的轉移淋巴結被證實局限于胃近端、食管裂孔、食管遠端及胰腺上區。但該研究還發現,對于第7、8、9、10組淋巴結而言,當腫瘤分期為pT3/4時,淋巴結轉移率較pT1/2分期有所升高。日本胃癌治療指南[4]推薦近端胃切除時的淋巴結清掃范圍為NO.1、2、3a、4sa、4sb、7、8a、9、11p。我國胃癌治療指南[8]也有類似推薦。因此對于近端胃切除而言,無需清掃遠端胃周圍淋巴結(NO.5、6)。
2.2 縱隔淋巴結清掃范圍及手術入路
2.2.1 縱隔淋巴結清掃范圍 Siewert Ⅱ型AEG的淋巴結清掃范圍目前尚未在國際上達成共識。根據日本胃癌治療指南[4],對于食管胃交界性腫瘤行近端胃切除術的患者,D1+淋巴結清掃范圍應包括NO.1、2、3a、4sa、4sb、7、8a、9、11p及110。行全胃切除術的食管胃交界性腫瘤的D1+淋巴結清掃范圍應包括NO.1~7、8a、9、11p、110,達到D2切除,則應繼續清掃第11d、12a、19、20、111組淋巴結。此外,由于目前很難做到NO.19、20及NO.110、111、112之間的精確區分,因此,下縱隔淋巴結通常與食管裂孔周圍的淋巴結被一起切除。對于Siewert Ⅱ型AEG,美國國立綜合癌癥網絡食管癌及食管胃結合部腫瘤指南[3]建議,淋巴結清掃數量不低于16枚,未對淋巴結清掃范圍進行界定。
研究表明,縱隔淋巴結的轉移主要與腫瘤侵犯食管的范圍及腫瘤浸潤深度有關[19]。Feith的一項基于1 602例患者的大型臨床研究表明[17],Siewert Ⅱ型AEG在中縱隔及上縱隔的淋巴轉移極少見,而下縱隔淋巴結的轉移率也僅有12%。與該研究類似,2015年發表的一項多中心的回顧性研究發現[20],Siewert Ⅱ型AEG其上、中、下縱隔淋巴結轉移率分別為4%、7%與11%,并且認為EGJ至原發灶近緣的距離可能是Siewert Ⅱ型AEG患者縱隔淋巴結轉移或復發的一個重要指標。只有當EGJ到原發灶近緣的距離大于3 cm時,經胸腔入路徹底的縱隔淋巴結清掃術可能對治療提供正面影響。而對于普外科醫生遇到的Siewert Ⅱ型AEG而言,能經腹腔直接進行根治性近端胃大部切除或全胃切除術而無需行胸腹聯合手術進行消化道重建的患者,其病變向上侵及食管的范圍多小于3 cm。一項大型研究證實[21],只有當腫瘤對食管的侵犯長度大于2 cm時,第110組淋巴結才被列為強烈推薦的清掃范圍。故而我們認為,如非必要,不將徹底清掃全部的縱隔淋巴結作為AEG的首選手術策略。
2.2.2 縱隔淋巴結清掃的手術入路 對于Siewert Ⅱ型AEG,目前臨床醫生常采用經胸食管胃切除術或經腹食管裂孔食管胃切除術[3],淋巴結清掃路徑也是通過經胸或經腹食管裂孔兩種途徑。經胸淋巴結清掃術相較經腹食管裂孔徑路而言,具有視野清晰、淋巴結清掃徹底的優勢,但術后肺部并發癥發生率也有所提高。由于縱隔淋巴結大部分位于膈上,只有NO.111組淋巴結位于膈下;因此對于縱隔淋巴結的清掃,經腹食管裂孔入路在不打開膈肌的情況下腹腔鏡下難以清掃所有的縱隔淋巴結,可能造成淋巴結清掃不徹底,增加術后轉移或復發的風險。荷蘭的團隊通過一項隨機對照試驗[22]比較了經胸入路與經腹食管裂孔徑路治療AEG的療效,發現盡管經胸入路徹底清掃縱隔淋巴結的患者5年長期存活率有所改善,但其早期發病率升高,給患者帶來的經濟壓力也更大;而經腹食管裂孔徑路治療的患者在獲得更好的短期收益的同時長期存活率卻相應降低。此外,兩組患者在中位數總體、無病與質量調整后的存活率方面并無明顯差異。也有研究表明[23],對于AEG,通過經腹食管裂孔徑路清掃淋巴結具有創傷小、出血量少、對心肺功能影響小的優點。Sasako等[24]的一項大型研究表明,對于AEG,與經腹食管裂孔徑路相比,經胸入路并不能給患者帶來更高的生存獲益。日本胃癌治療指南[4]及Siewert Ⅱ型食管胃結合部腺癌腔鏡手術治療中國專家共識[7]均推薦食管受累距離小于3 cm的Siewert Ⅱ型AEG,首選經腹食管裂孔徑路清掃下縱隔淋巴結。
3 消化道重建方式
3.1 近端胃切除術后消化道重建方式 近端胃切除術后最簡便的消化道重建方式是單純食管-殘胃吻合,然而食管與殘胃直接吻合后,由于失去了賁門、食管下括約肌等生理抗反流屏障的功能,術后發生反流性食管炎的頻率較高,嚴重影響患者的術后生活質量[25]。為此,臨床醫生在行近端胃切除術時多會選擇改良抗反流術式,以期改善患者術后生活質量,降低術后復發的風險。根據《完全腹腔鏡胃癌手術消化道重建專家共識及手術操作指南(2018版)》[26],近端胃切除術后消化道重建應盡可能滿足以下要求:(1)在保證腫瘤根治切除的前提下,根據切除胃的范圍選擇安全、方便的重建方式,操作簡便,易于推廣;(2)確保吻合口血運佳、張力低、腸襻通,并盡量減少吻合口數量;(3)保持消化道的連續性,兼顧食物儲存功能與預防反流性食管炎的功能;(4)盡量保證術后內鏡檢查的可行性(包括殘胃、十二指腸與膽道的檢查)。消化道重建的改良術式按照抗反流原理基本上可分為三類:(1)食管胃吻合口的改良,其大多復刻生理抗反流屏障的功能,如雙肌瓣吻合、胃底折疊術、食管胃側壁吻合等;(2)延長反流距離,這一類吻合通常會改變消化道的連續性或生理形態,如管狀胃吻合、雙通道吻合、間質空腸及間質空腸儲袋吻合等;(3)促進胃排空,如幽門成形術等。各類消化道重建方式見圖1。

圖1 近端胃切除術后消化道重建方式(A:傳統食管胃吻合;B:管狀胃吻合;C:管狀胃-giraffe吻合;D:雙肌瓣吻合;E:雙通道吻合;F:間質空腸吻合;G:胃底折疊術;H:食管胃側壁吻合)
3.1.1 管狀胃吻合 管狀胃吻合的技術要點在于自幽門上方5 cm處向上將遠端胃切割成長15~20 cm、寬3~5 cm的管狀,管狀胃也因此得名。管狀胃吻合切除了大部分小彎側胃壁,減少了胃酸的分泌,同時也延長了反流路徑,相較單純食管-殘胃吻合,其抗反流效果明顯,患者術后生活質量得到顯著提高[25]。因其制作簡單,學習難度低,不延長手術時間,也被臨床醫生廣泛接受。但在應用過程中,人們發現由于管狀胃在制作過程中產生了較多的切緣,且食管胃吻合口與管狀胃切緣距離較近,使得管狀胃吻合術后吻合口狹窄的發生率較高,許多患者需要尋求內鏡下球囊擴張以恢復飲食。此外,管狀胃吻合的抗反流效果僅有68%,與其他抗反流術式相比優勢并不明顯[27]。我國學者針對該術式進行改良,改造出了“giraffe吻合”[28],重建了小胃底及His角結構,抗反流效果也得到了驗證,然而該改良術式的安全性、可行性仍待進一步研究。
3.1.2 雙肌瓣吻合 雙肌瓣吻合是指由殘胃的漿肌層包裹食管下段,通過胃壁的張力給食管殘胃吻合口提供閉合的壓力,形成一個類似“食管下括約肌”的結構,使殘胃內容物無法反流至食管內。該吻合方式最早由Kamikawa報道,因此又被稱為Kamikawa術式。該術式抗反流效果顯著,Muraoka等[29]的研究證明,進行雙肌瓣吻合的24例患者均未出現反流癥狀,此外,他們通過術后的胃鏡檢查發現,吻合口處的外觀與天然賁門類似,也側面說明了雙肌瓣吻合形成了人工抗反流屏障,抗反流效果可靠。由于雙肌瓣吻合是腔鏡下手工吻合,對操作者的經驗、技術及醫療器械的質量要求較高,延長了消化道重建時間,且術后吻合口狹窄的發生率有所升高。一項研究表明[30],術后30%的患者會出現程度不一的進食梗阻感,10%的患者需行內鏡下球囊擴張。為簡化手術方式,縮短手術時間,有學者提出“拱橋式吻合”[31],通過輔助切口在體外進行肌瓣重建,形成一個類似拱橋的結構,進一步在腔鏡下完成食管殘胃的手工吻合。該學者的研究證明,“拱橋式吻合”可有效縮短手術時間,提高手術效率,且不影響術后抗反流效果。然而該改良術式目前研究較少,有待大樣本多中心的前瞻性臨床研究進一步探索。
3.1.3 雙通道吻合 雙通道吻合是日本胃癌治療指南推薦的三種消化道重建方式之一[4]。該術式重建“胃通道”及“腸通道”,給予食物兩種選擇,既保留了殘胃的儲備與分泌功能,又保證了消化道的通暢,減少了食物潴留的發生,同時,由于殘胃與食管之間的空腸段,使得反流距離得以延長,抗反流效果顯著,更加適于殘胃較小、行食管胃吻合有一定難度的患者。但雙通道吻合打破了消化道的連續性,給術后胃鏡檢查增加了難度。Sakuramoto等[32]的研究發現,行雙通道吻合后,無一例患者出現反流癥狀,僅25%的患者出現了內鏡下輕度反流性食管炎。由于該術式吻合口較多,使得手術時間相對延長,且術后發生吻合口漏的風險相應提高。一項研究表明[33],近端胃切除術后雙通道吻合能縮短手術時間,預防反流,改善患者術后營養狀態。關于雙通道,還有一些學者擔心一段時間后,殘胃通道的食物分流量減少,更多的食物傾向于通過空腸通道進行消化吸收,使得雙通道變成單通道,失去該消化道重建術式的發明初衷。因此,我們認為即使食物不通過殘胃,殘胃依舊保留著消化與分泌功能,其分泌的胃酸、內因子等物質通過十二指腸到達空腸,促進食物的消化吸收,改善患者營養狀態。就這方面而言,雙通道與全胃切除術后的Roux-en-Y吻合有本質區別。
3.1.4 間質空腸/間質空腸儲袋吻合 間質空腸及間質空腸儲袋吻合也是一個較為傳統的消化道重建方式,已被多個研究中心報道。間質空腸直接將食管與空腸進行吻合,并將殘胃曠置,僅保留殘胃的分泌功能,使食物通過食管-空腸通道進行消化吸收。一項研究證明[27],雖然間質空腸吻合的消化道重建相對復雜,花費時間較長,但其抗反流效果較好,且術后營養狀況更好,這得益于殘胃完整的分泌功能得以保留。間質空腸儲袋與間質空腸類似,其效果常與間質空腸一起評價,具體手術方式的選擇依舊依靠臨床醫生根據術中情況決定。
3.1.5 胃底折疊術 胃底折疊術不是臨床常用術式,因其對殘胃血供要求高,且必須在殘胃足夠大的前提下進行。該術式將殘胃上端向內折疊,包埋一段食管,通過胃壁的張力形成一個類似食管下括約肌的結構,從而拮抗反流。雖然與單純食管-殘胃吻合相比,胃底折疊術確實能有效拮抗胃酸反流,但文獻報道[32],其抗反流效果不如雙通道可觀穩定,且對殘胃的大小有一定要求,故而臨床上關于近端胃根治性切除術后使用胃底折疊術重建消化道的應用不多。值得一提的是,胃底折疊術是反流性食管炎質子泵抑制劑治療無效患者的首選標準術式[34]。
3.1.6 食管胃側壁吻合 食管胃側壁吻合是指將殘胃固定在左右膈肌腳上進行食管-殘胃吻合的方式,相當于重建了胃底結構,給胃酸反流提供了一個緩沖區,一定程度上可防止反流的發生,根據Yamashita等[35]的研究,食管胃側壁吻合將食管壁左側與胃壁前壁吻合后再使食管壁右側與胃壁貼緊,將食管變平,這使得保存下來的食管胃吻合口在正常狀態下是緊閉的狀態,從而構成了瓣膜狀的抗反流機制。該研究證實,僅7%(1/14)的患者術后出現了內鏡證實的反流性食管炎。然而由于該研究病例數較少,且臨床上很少采用此種術式進行消化道重建,是以其安全性、可行性仍有待評估。
3.1.7 其他吻合方式 如保留迷走神經術、幽門成形術、保留食管下括約肌的近端胃切除術等,由于應用較少,相關研究較少,且有的消化道重建方式通常與其他吻合方式聯合應用,在此不做贅述。
3.2 全胃切除術后消化道重建方式 全胃切除術是日本胃癌治療指南中進展期Siewert Ⅱ型AEG的標準手術方式[4]。全胃切除使得胃周圍淋巴結的清掃更加徹底,降低了胃癌復發與轉移的風險。由于胃被整個切除,杜絕了胃癌復發進展成殘胃癌的隱患。但其消化道重建方式仍存在一定爭議,主要表現在十二指腸曠置與加做空腸儲袋兩方面。不少學者為了模擬正常消化道的生理狀態,提高手術效率,改善患者術后生活質量,進行了不同消化道重建方式的嘗試(圖2),現總結如下。
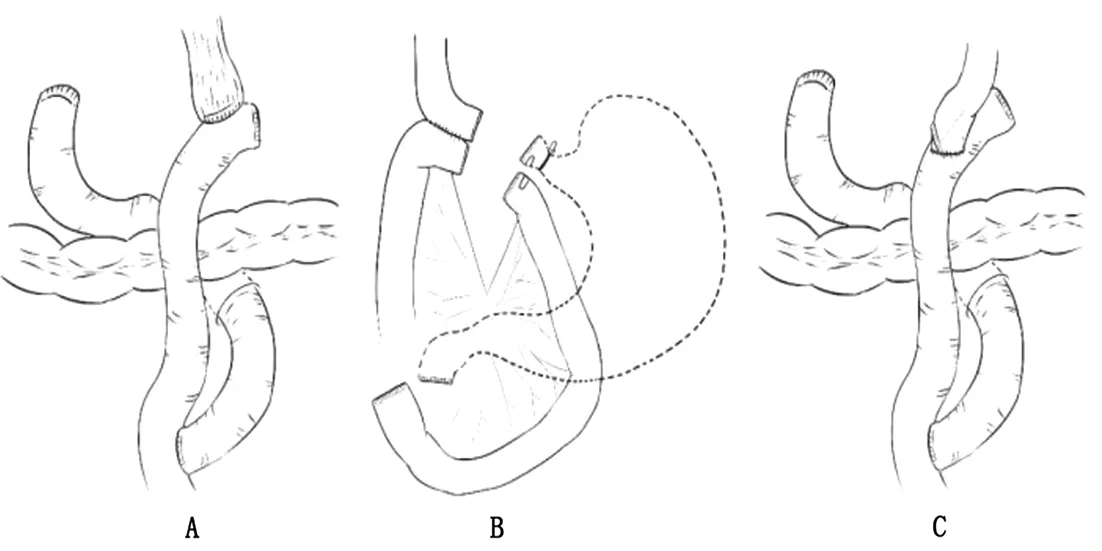
圖2 全胃切除術后消化道重建方式(A:Roux-en-Y吻合;B:π吻合;C:overlap吻合)
3.2.1 Roux-en-Y吻合 Roux-en-Y吻合是全胃切除術后最常見的消化道重建方式,也是《完全腹腔鏡胃癌消化道重建專家共識及手術操作指南》[26]中推薦的全胃切除術后消化道重建方式。An等的研究證實[10],Roux-en-Y吻合術后吻合口狹窄與反流性食管炎的發生率分別為6.9%與1.8%,與同期進行的近端胃切除術相比,其營養狀況未明顯降低。Roux-en-Y吻合過程中需離斷空腸,進行食管空腸吻合及空腸空腸吻合,破壞了消化道的連續性,也破壞了腸神經功能的傳導,容易導致腸道生理功能及運動功能紊亂,從而引起傾倒綜合征、Roux-en-Y滯留綜合征等術后長期并發癥。Uncut Roux-en-Y吻合可減少這種并發癥的發生。與Roux-en-Y吻合不同,Uncut Roux-en-Y吻合在保持腸管連續性的同時,保證了十二指腸功能的充分利用,同時給空腸增加了一段儲備功能,使消化道更接近術前狀態,利于患者術后恢復[36]。研究表明[37],Uncut Roux-en-Y吻合較Roux-en-Y吻合操作簡便,術后恢復快,并發癥發生率低,且對患者早期術后營養狀況的維持具有更好的作用。
3.2.2 π吻合 π吻合是近年新興的消化道重建方式之一,其技術要點在于先行食管空腸吻合后再關閉食管空腸共同開口,同時離斷胃。π吻合在離斷胃前先行食管空腸吻合,利用胃的牽拉作用提供張力,降低了食管空腸吻合的難度,同時減少了直線切割閉合器的應用。研究證實[38],π吻合操作簡便,能有效縮短手術時間,減輕了患者的經濟負擔,且不增加術后并發癥發生率。在了解π吻合的優勢時,我們也發現,在消化道重建過程中無法判斷腫瘤具體位置,離斷胃后有上切緣陽性的可能,因此該術式不適于術前評估腫瘤侵犯位置較高的腫瘤,尤其是AEG。由于π吻合提出時間不長,臨床上其研究不如傳統消化道重建方式多,具體臨床療效有待前瞻性的多中心臨床研究驗證。
3.2.3 Overlap吻合 2010年,Inaba提出了Overlap這一消化道重建方式,并報道了滿意的早期術后結果。為驗證該術式,Kitagami等進行了一項病例數為100的臨床研究[39],發現Overlap吻合所需中位吻合時間為32 min,手術時間短,且術后患者恢復迅速,無一例發生吻合口相關并發癥,證實了Overlap吻合是安全、可行且能使患者受益的術式。與π吻合不同,Overlap吻合離斷胃后進行吻合,術中視野不受限制,操作空間大,利于縮短手術時間,且吻合后食管及空腸蠕動方向一致,利于食物的傳遞。但由于食管缺少了胃的牽拉作用,容易回縮至胸腔,因此需要在食管斷端額外固定兩根牽拉線牽引食管,以保證手術的順利進行。
綜上所述,在保證腫瘤根治的前提下,對于Siewert Ⅱ型AEG,一般建議術中根據腫瘤位置及浸潤深度選擇淋巴結清掃范圍,在盡可能縮短手術時間的同時減少術后并發癥的發生與術后復發的可能。目前,全胃切除、近端胃切除術及其相對應的消化道重建方式仍存在較多爭議,且各有利弊,最佳術式仍在不斷探索研究中。因此,術中應根據患者一般狀況及食管、殘胃狀態選擇合適的消化道重建方式,使患者得到最佳獲益。

