基于生物信息學(xué)分析LncRNA AC005479.2在甲狀腺乳頭狀癌中的表達(dá)及相關(guān)分析
梁新科,王鵬飛,霍勝男,李建英,侯慶田
(河北省邯鄲市邯鋼醫(yī)院甲狀腺科,河北 邯鄲 056000)
甲狀腺乳頭狀癌(papillary thyroid carcinoma,PTC)是最常見(jiàn)的甲狀腺癌類(lèi)型,占甲狀腺惡性腫瘤的70%~85%,并且全球發(fā)病率逐年增加[1]。雖然甲狀腺乳頭狀癌普遍預(yù)后良好,但其腫瘤的復(fù)發(fā)和轉(zhuǎn)移亦嚴(yán)重影響患者的生存率。近年來(lái),基因檢測(cè)得以廣泛普及,可以研究基因表達(dá)與疾病之間的關(guān)系,為腫瘤機(jī)制的研究提供了明確的方向。本研究通過(guò)生物信息學(xué)方法篩選分析PTC與健康人群的甲狀腺組織的差異表達(dá)基因,尋找其發(fā)揮作用的相關(guān)信號(hào)通路,探索PTC的發(fā)病機(jī)制,為PTC診斷及治療提供新的研究方向。
1 資料與方法
1.1一般資料 選取TCGA數(shù)據(jù)庫(kù)中2000年1月—2020年12月收錄并具有完整隨訪(fǎng)信息的甲狀腺乳頭狀癌樣本510例與癌旁組織樣本58例。納入標(biāo)準(zhǔn):①腫瘤組織樣本來(lái)自甲狀腺乳頭狀癌患者,對(duì)照組為正常組織;②樣本須同時(shí)含有基因表達(dá)譜數(shù)據(jù)與臨床信息。
1.2TCGA數(shù)據(jù)的分析 使用Rstudio中的“Limma”軟件包對(duì)TCGA數(shù)據(jù)進(jìn)行差異分析,尋找甲狀腺乳頭狀癌組織與正常組織之間是否存在差異長(zhǎng)鏈非編碼RNA(long non-coding RNA, lncRNA),并繪制火山圖和熱圖。差異lncRNA篩選標(biāo)準(zhǔn)為:|log2FC|>1,F(xiàn)DR<0.05。
1.3WGCNA構(gòu)建及臨床相關(guān)性分析 使用“AnnotationDbi”R包將該數(shù)據(jù)中的探針I(yè)D轉(zhuǎn)換成基因符號(hào)以進(jìn)行進(jìn)一步分析。使用R軟件中的“FlsahClust”軟件包進(jìn)行樣本層次聚類(lèi)(implementation of optimal hierarchical clustering),過(guò)濾變異最大的25%基因。利用WGCNA軟件包中的“Pick-Soft-Threshold”函數(shù)調(diào)節(jié)參數(shù)β的權(quán)重。使用WGCNA軟件包將數(shù)據(jù)中有相關(guān)性和相鄰關(guān)系的lncRNA計(jì)算成為拓?fù)渲丿B矩陣(topological overlap matrix,TOM) ,然后計(jì)算相應(yīng)的相異度(1-TOM) 。使用1-TOM作為距離度量,使用動(dòng)態(tài)樹(shù)切割法進(jìn)行分層聚類(lèi)以識(shí)別模塊,將高度相似的模塊通過(guò)聚類(lèi)標(biāo)記并合并。最小基因模塊>100,合并相似模塊的閾值=0.1用于搜索在心肌甲狀腺乳頭狀癌中起重要作用的模塊。獲得基因模塊后根據(jù)模塊化特征將甲狀腺乳頭狀癌患者的臨床特征和模塊內(nèi)的基因聯(lián)合分析,探究模塊內(nèi)基因的生物學(xué)意義。使用相關(guān)性熱圖探究基因與模塊的相關(guān)性,并進(jìn)行聚類(lèi)分析。此外,WGCNA算法還對(duì)在同一模塊中基因進(jìn)行相互作用網(wǎng)絡(luò)的預(yù)測(cè)。Cytoscape是一種分析軟件,可以為生物學(xué)家提供生物網(wǎng)絡(luò)分析和二維可視化。
1.4模塊中差異lncRNA的篩選 Funrich是一種生物學(xué)分析軟件。本研究中,使用維恩圖,將blue模塊中的lncRNA與差異lncRNA取交集,得到blue模塊中差異lncRNA。
1.5統(tǒng)計(jì)學(xué)方法 本研究在Rstudio中使用“survival”包進(jìn)行單因素和多因素Cox回歸分析,進(jìn)行模型變量篩選。受試者工作特征(receiver operating characteristic curve, ROC)曲線(xiàn)用于評(píng)估基因的診斷價(jià)值。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
1.6功能富集分析 選取甲狀腺乳頭狀癌樣本,將其分為AC005479.2低表達(dá)組和AC005479.2高表達(dá)組,隨后導(dǎo)入GSEA中進(jìn)行基因本體論(Gene Ontology,GO)分析和京都基因與基因組百科全書(shū)(Kyoto Encyclopedia of Genes and Geomes,KEGG)分析。
2 結(jié) 果
2.1差異lncRNA的篩選 經(jīng)TCGA數(shù)據(jù)庫(kù)篩選,共獲得差異表達(dá)lncRNA58個(gè),其中包括高表達(dá)基因36個(gè)與低表達(dá)基因22個(gè)(P<0.05),見(jiàn)圖1A。LncRNA表達(dá)情況見(jiàn)圖1B。
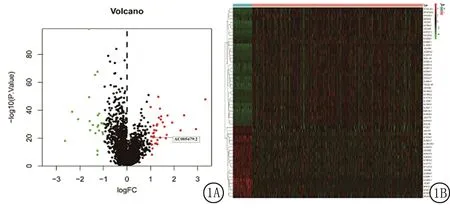
圖1 甲狀腺乳頭狀癌基因表達(dá)差異A.甲狀腺乳頭狀癌基因表達(dá)差異火山圖;B.甲狀腺乳頭狀癌LncRNA表達(dá)情況Figure 1 Differences in gene expression of thyroid papillary carcinoma
2.2加權(quán)基因共表達(dá)網(wǎng)絡(luò)構(gòu)建及臨床相關(guān)性分析 “pickSoftThreshold”函數(shù)的結(jié)果顯示,當(dāng)權(quán)重參數(shù)β=12時(shí),log(k)與log[p(k)]之間相關(guān)系數(shù)的平方>0.9。選取軟閾值β=12構(gòu)建WGCNA,見(jiàn)圖2A。使用動(dòng)態(tài)樹(shù)切割法識(shí)別基因模塊,設(shè)定模塊內(nèi)最低基因個(gè)數(shù)為100,最終得到11個(gè)相應(yīng)的模塊,見(jiàn)圖2B。結(jié)果顯示,模塊blue與甲狀腺乳頭狀癌顯著相關(guān),見(jiàn)圖2C。基因與模塊的相關(guān)性分別展現(xiàn)在圖2D與圖2E中。預(yù)測(cè)出的Blue模塊中基因之間的相互作用見(jiàn)圖2F。
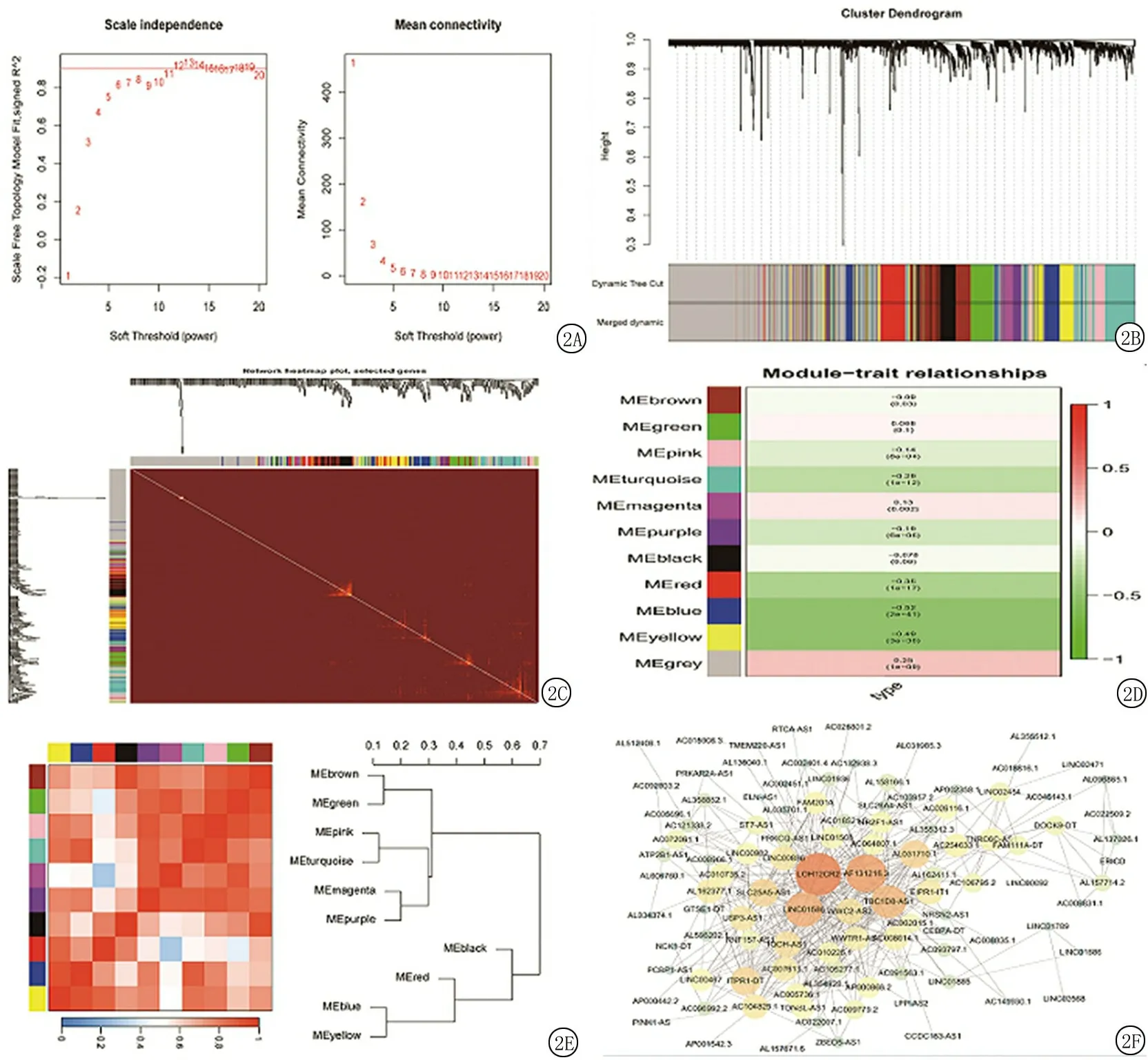
圖2 加權(quán)基因共表達(dá)網(wǎng)絡(luò)構(gòu)建A.構(gòu)建WGCNA;B.基因模塊;C.藍(lán)色模塊與甲狀腺乳頭狀癌顯著相關(guān);D.基因與模塊的相關(guān)性;E.基因與模塊的相關(guān)性;F.藍(lán)色模塊中基因之間的相互作用Figure 2 Construction of weighted gene co-expression networks
2.3模塊中差異基因的篩選 通過(guò)維恩圖將得到甲狀腺乳頭狀癌組織與正常組織之間的58個(gè)差異lncRNA與blue模塊中174個(gè)模塊lncRNA取交集,得到藍(lán)色模塊內(nèi)差異lncRNA共有34個(gè),見(jiàn)圖3。
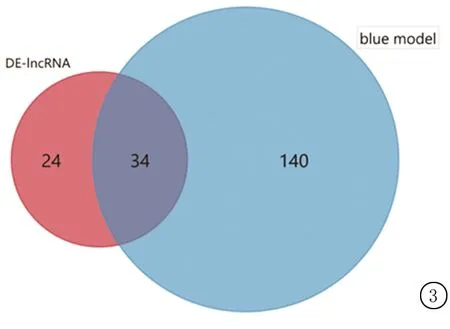
圖3 藍(lán)色模塊中的差異lncRNAFigure 3 Differential lncRNA in blue module
2.4預(yù)后模型的構(gòu)建與驗(yàn)證 對(duì)藍(lán)色模塊內(nèi)34個(gè)差異lncRNA進(jìn)行單因素和多因素Cox回歸分析(圖4A、B),得到AC005479.2。隨后對(duì)AC005479.2繪制ROC曲線(xiàn),曲線(xiàn)下面積(area under curve,AUC)值為0.838(圖4C)。
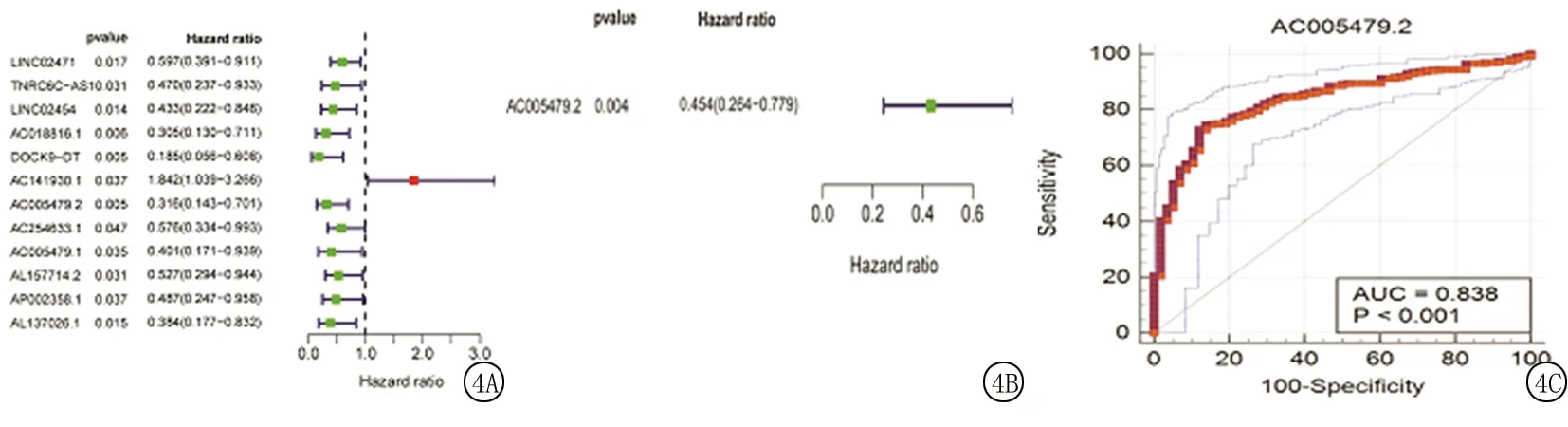
圖4 差異lncRNA的回歸分析A.單因素Cox回歸分析;B.多因素Cox回歸分析;C.ROC曲線(xiàn)Figure 4 Regression analysis of differential lncRNAs
2.5基因富集分析 通過(guò)GO和KEGG分析,揭示AC005479.2的潛在通路與功能,結(jié)果顯示AC005479.2通過(guò)脂肪細(xì)胞因子信號(hào)途徑、絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號(hào)通路、鈣黏蛋白結(jié)合參與細(xì)胞黏附、對(duì)凋亡信號(hào)通路的正調(diào)控等功能參與甲狀腺乳頭狀癌的病理過(guò)程,見(jiàn)圖5。
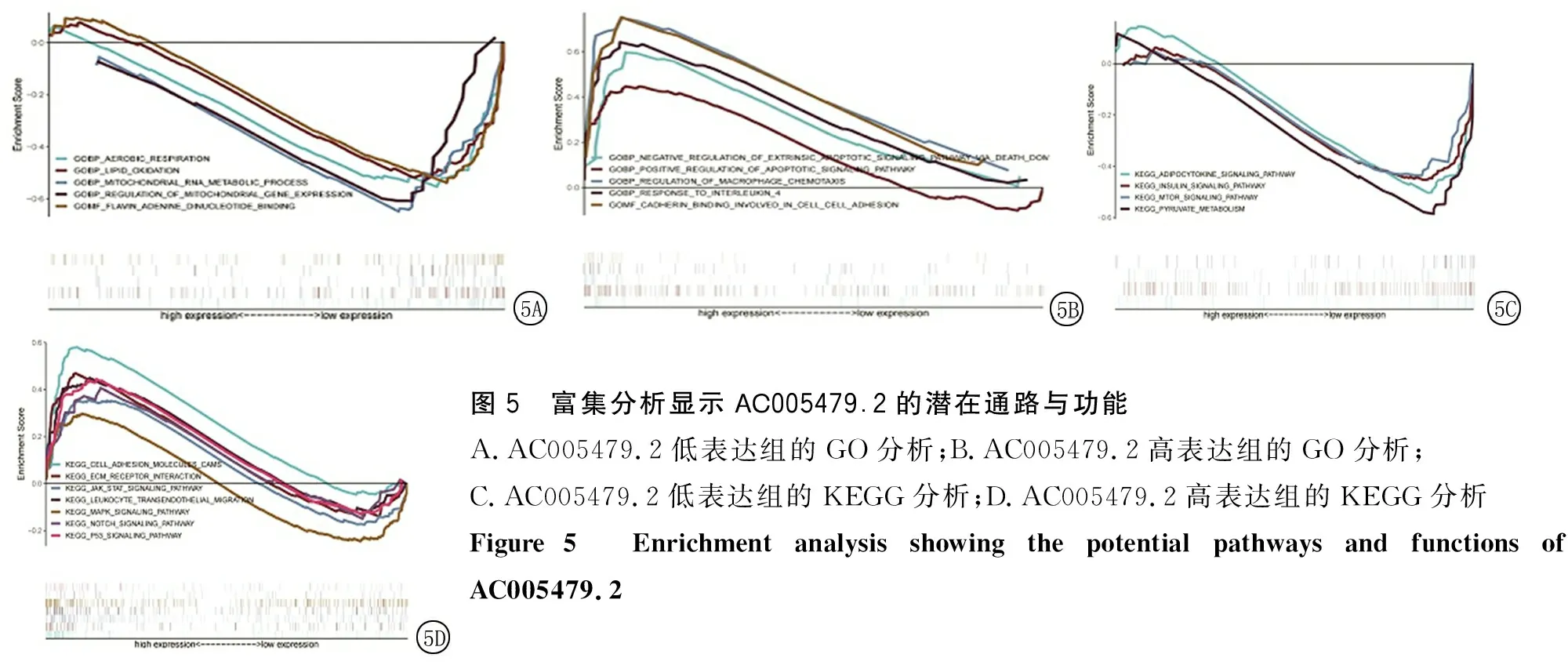
圖5 富集分析顯示AC005479.2的潛在通路與功能A.AC005479.2低表達(dá)組的GO分析;B.AC005479.2高表達(dá)組的GO分析;C.AC005479.2低表達(dá)組的KEGG分析;D.AC005479.2高表達(dá)組的KEGG分析Figure 5 Enrichment analysis showing the potential pathways and functions of AC005479.2
3 討 論
甲狀腺癌是最常見(jiàn)的內(nèi)分泌腫瘤,占人類(lèi)所有惡性腫瘤的0.5%~1%[2]。PTC被認(rèn)為是復(fù)發(fā)率最高的甲狀腺癌類(lèi)型,但同時(shí)也被認(rèn)為是具有良好預(yù)后的惰性癌癥,占已分化甲狀腺癌的70%~90%[3]。對(duì)于大多數(shù)PTC患者,預(yù)后良好,然而,在某些情況下會(huì)出現(xiàn)侵襲性行為,30%~90%的患者表現(xiàn)出臨床或隱匿性頸部淋巴結(jié)轉(zhuǎn)移[4-5]。lncRNA已被證實(shí)參與PTC的細(xì)胞遷移和增殖過(guò)程[6]。因此,尋找腫瘤與正常組織之間的差異lncRNA有助于進(jìn)一步了解甲狀腺乳頭狀癌的發(fā)病機(jī)制,為PTC的術(shù)前診斷提供生物標(biāo)志物和治療靶點(diǎn)。
基于生物信息學(xué)分析,研究顯示,lncRNA AC005479.2在甲狀腺乳頭狀癌中表達(dá)與癌旁組織差異有統(tǒng)計(jì)學(xué)意義(P<0.05),同時(shí)GO和KEGG結(jié)果顯示AC005479.2可能通過(guò)脂肪細(xì)胞因子信號(hào)途徑、MAPK信號(hào)通路、鈣黏蛋白結(jié)合參與細(xì)胞黏附、對(duì)凋亡信號(hào)通路的正調(diào)控等功能參與甲狀腺乳頭狀癌的病理過(guò)程。
近年來(lái)研究顯示,肥胖患病率的增加與包括乳腺癌、結(jié)腸癌和前列腺癌在內(nèi)的各種人類(lèi)癌癥的發(fā)病率、進(jìn)展和預(yù)后較差有關(guān)[7]。最近,一些研究顯示甲狀腺癌的發(fā)病率隨著肥胖率的顯著上升而增加,并且越來(lái)越多的證據(jù)表明肥胖與甲狀腺癌風(fēng)險(xiǎn)增加之間存在關(guān)聯(lián)[8-9]。脂肪因子是脂肪細(xì)胞分泌的各種酶、激素、細(xì)胞因子、生長(zhǎng)因子、蛋白質(zhì)和其他生物活性物質(zhì),包括脂聯(lián)素、瘦素、抵抗素和白細(xì)胞介素等。據(jù)報(bào)道,體重指數(shù)越高的患者脂肪因子濃度越高[10]。由于營(yíng)養(yǎng)過(guò)剩或運(yùn)動(dòng)不足所致肥胖時(shí),脂肪因子將出現(xiàn)異常分泌,并參與多種病態(tài)的發(fā)生。脂肪因子參與以下病理和生理過(guò)程,如胰島素敏感性、炎癥和增殖,這些在腫瘤發(fā)生和發(fā)展過(guò)程中均發(fā)揮重要作用。因此,脂肪因子可能是將肥胖與甲狀腺癌聯(lián)系起來(lái)的目標(biāo)之一。本研究顯示,AC005479.2可能通過(guò)脂肪因子參與了甲狀腺乳頭狀癌的發(fā)生發(fā)展過(guò)程。
MAPK通路代表一種普遍存在的信號(hào)轉(zhuǎn)導(dǎo)通路,在細(xì)胞活力、凋亡和侵襲的調(diào)控中發(fā)揮重要作用。MAPK信號(hào)通路能夠被受體酪氨酸激酶、G蛋白偶聯(lián)受體和部分細(xì)胞因子受體激活,將細(xì)胞外的信號(hào)刺激傳遞給細(xì)胞,引起細(xì)胞增殖、凋亡、分化等一系列反應(yīng),進(jìn)而促進(jìn)腫瘤的發(fā)生發(fā)展。先前的研究表明,MAPK信號(hào)通路在多種癌癥中被激活,包括胃癌[11]、肺癌[12]、卵巢癌[13]和肝癌[14]。這一途徑已被證明在腫瘤發(fā)生發(fā)展中發(fā)揮關(guān)鍵作用,因此,成為包括甲狀腺癌在內(nèi)的惡性腫瘤的重要治療靶點(diǎn)[15]。MAPK屬于絲氨酸/蘇氨酸蛋白激酶,MAPK信號(hào)級(jí)聯(lián)是腫瘤細(xì)胞增殖、分化、凋亡和耐藥性的關(guān)鍵途徑。此外,MAPK激活可以磷酸化核轉(zhuǎn)錄因子和蛋白激酶,調(diào)節(jié)相關(guān)基因的轉(zhuǎn)錄并參與各種生理過(guò)程[16]。MAPK信號(hào)通路由4個(gè)子通路組成:extracellular signal-regulated kinase(ERK)、c-Jun N-terminal kinase(JNK)、p38 和big MAPKinase(BMK)。研究表明,ERK信號(hào)通路的激活促進(jìn)細(xì)胞生長(zhǎng)、分化、遷移和存活[17]。JNK和p38的激活涉及細(xì)胞分化、凋亡和細(xì)胞存活的變化[18]。研究顯示,MAPK通路中,BRAF的突變及RET/ PTC重排能夠促進(jìn)甲狀腺濾泡細(xì)胞向乳頭狀甲狀腺癌的轉(zhuǎn)化,這種改變被認(rèn)為是甲狀腺癌發(fā)生和進(jìn)展的早期表現(xiàn)[19]。據(jù)Nucera等[20]報(bào)道,根據(jù)甲狀腺癌的遺傳學(xué)變異,有28%~86%的患者伴隨BRAF基因突變。其中BRAF V600E突變占甲狀腺乳頭狀癌的45%[19]。Zhang等[21]研究顯示BRAF基因激活的非編碼RNA(BRAF-activated non-coding RNA,BANCR)通過(guò)激活ERK-MAPK信號(hào)通路進(jìn)而對(duì)乳頭狀甲狀腺癌細(xì)胞增殖和遷移產(chǎn)生影響。
MAPK還可通過(guò)調(diào)節(jié)上皮-間質(zhì)轉(zhuǎn)化(epithelial mesenchymal transformation EMT)信號(hào)通路發(fā)揮作用,上皮-間質(zhì)轉(zhuǎn)化被認(rèn)為是癌細(xì)胞從原發(fā)部位向遠(yuǎn)處組織或淋巴結(jié)轉(zhuǎn)移過(guò)程中的一個(gè)重要步驟,通過(guò)該過(guò)程上皮細(xì)胞逐漸獲得間充質(zhì)特征并增強(qiáng)遷移和侵襲的特性。甲狀腺乳頭狀癌的多灶性病變顯示出淋巴結(jié)轉(zhuǎn)移傾向[22],PTC的淋巴結(jié)轉(zhuǎn)移導(dǎo)致預(yù)后不良的結(jié)果,研究顯示EMT參與了PTC細(xì)胞的局部轉(zhuǎn)移過(guò)程。EMT的分子特征包括將極化上皮表型標(biāo)志物(如E-cadherin)轉(zhuǎn)換為間充質(zhì)標(biāo)志物(如N-cadherin、纖連蛋白等)。轉(zhuǎn)錄因子(如Snail、Twist、ZEB1和ZEB2等)的激活觸發(fā)EMT的發(fā)生。據(jù)報(bào)道,MAPK/ERK的激活會(huì)增加Snail、Slug和N-鈣黏蛋白的水平,并降低E-鈣黏蛋白的表達(dá)水平,從而導(dǎo)致EMT[23-25]。EMT通路已被廣泛證明在腫瘤進(jìn)展和轉(zhuǎn)移中起關(guān)鍵作用,可作為甲狀腺癌的臨床治療靶點(diǎn)[15,26]。本研究顯示AC005479.2可能通過(guò)MAPK通路,改變細(xì)胞黏附狀態(tài),形成EMT環(huán)境,促進(jìn)PTC的淋巴結(jié)轉(zhuǎn)移,導(dǎo)致PTC的進(jìn)展。
綜上所述,本研究基于TCGA甲狀腺乳頭狀癌及癌旁組織的基因數(shù)據(jù),顯示AC005479.2在甲狀腺乳頭狀癌和癌旁組織中的表達(dá)差異有統(tǒng)計(jì)學(xué)方法意義,而且通過(guò)GO和KEGG分析其可能通過(guò)MAPK通路、脂肪因子通路,調(diào)節(jié)EMT及凋亡的發(fā)生,從而參與甲狀腺乳頭狀癌的發(fā)生發(fā)展過(guò)程,為驗(yàn)證AC005479.2的作用提供理論依據(jù)。

