以驅動壓為導向個體化滴定式呼氣末正壓通氣在老年腹腔鏡結腸癌患者中的應用效果*
閉玉華,黃俊萍
(廣西醫科大學附屬武鳴醫院麻醉科,南寧 530199)
全身麻醉過程中,患者將吸入高濃度氧氣,同時因使用鎮靜藥物、肌肉松弛藥物等,均會導致術后呼吸相關并發癥,尤其是肺不張。其不但延長患者住院時間,甚至增加患者臨床病死率[1]。老年人群其呼吸功能存在退行性改變,尤其是氧儲備能力與肺順應性均下降,被認為是全身麻醉后肺部并發癥發生的高危人群[2]。對于接受腹腔鏡下結直腸癌根治術患者,其麻醉手術時間長,應用二氧化碳氣腹機制特殊的Trendelenburg體位,可能引起患者功能性殘氣量和肺順應性進一步下降,出現呼吸道阻力增加、二氧化碳蓄積而影響通氣-血流比值,加重肺不張[3]。故針對老年腹腔鏡下結直腸癌根治術患者,如何有效降低麻醉對患者呼吸功能的影響,減少肺不張等術后呼吸相關并發癥是麻醉醫師關注的重點。
機械通氣過程中,往往因潮氣量過大引起肺容積性損傷,同時肺泡周期性開放與閉合而出現的肺組織剪切傷也會導致呼吸功能損傷[4]。小潮氣量的通氣能降低機械通氣對肺容積性的損傷程度,但在降低呼吸剪切傷方面則效果甚微,故需要結合有效的呼氣末正壓通氣。研究證實,有效的肺保護性通氣對于降低全身麻醉患者術后肺部并發癥發生率、改善患者預后有積極作用[5]。其中,需要根據不同患者機體狀況、藥物選擇、疾病病情等綜合考慮,選擇適應的呼氣末正壓,并非既定數據可以達到理想效果。以往滴定式呼氣末正壓參數設定方法多應用于重癥監護室,本研究針對腹腔鏡下結腸癌老年患者,以驅動壓為導向滴定式設定呼氣末正壓參數,取得一定效果,現報道如下。
1 資料與方法
1.1 一般資料
選取2020年1月至2021年10月本院收治的全身麻醉氣管插管下行腹腔鏡結腸癌根治術患者80例作為研究對象。患者入組前均簽署入組同意書并申報醫院倫理委員會批準。納入標準:術前通過病理組織活檢確診;年齡60~80歲;美國麻醉醫師協會(ASA)分級Ⅱ級和Ⅲ級;性別不限;精神狀況正常;均于術后順利拔除氣管導管。排除標準:肺部感染;肺大泡;呼吸功能衰竭;既往曾行肺部和(或)胸部手術史者;嚴重心、肝、腎等重要臟器功能障礙者;既往吸煙史者;肺部間質性病變者;拒絕簽字入組者。按照隨機數字表法分為觀察組和對照組,每組各40例。觀察組中,男25例,女15例;年齡61~80歲,平均(73.3±5.1)歲;ASA分級,Ⅱ級者13例,Ⅲ級者27例;手術持續時間90~150 min,平均(123.5±25.4)min;麻醉持續時間120~200 min,平均(155.5±16.9)min;術中失血50~300 mL,平均(120.5±15.0)mL;氣管插管即刻氣道平臺壓9~15 cm H2O(1 cm H2O=0.098 kPa),平均(12.1±1.3)cm H2O。對照組中,男24例,女16例;年齡60~79歲,平均(73.0±5.5)歲;ASA分級,Ⅱ級者12例,Ⅲ級者28例;手術持續時間90~150 min,平均(123.0±25.0)min;麻醉持續時間120~200 min,平均(155.0±16.0)min;術中失血50~300 mL,平均(121.4±15.4)mL;氣管插管即刻氣道平臺壓9~15 cm H2O,平均(11.8±1.4)cm H2O。兩組一般資料比較,差異均無統計學意義(P>0.05)。
1.2 方法
所有患者均接受氣管插管全身麻醉,先給予持續10 min內靜脈泵注右美托咪定1 μg/kg,隨后術中維持泵注速度為0.2 μg·kg-1·h-1,結合鎮痛藥物舒芬太尼0.5 μg/kg、肌肉松弛藥物順阿曲庫銨0.15 mg/kg、鎮靜藥物依托咪酯0.2 mg/kg,術中實施靜吸復合麻醉,藥物為七氟醚1%~3%,丙泊酚4~8 mg·kg-1·h-1,順阿曲庫銨0.02 mg·kg-1·h-1,并每間隔1 h靜脈給予5 μg舒芬太尼,術中維持患者生命體征數據在基礎值20%左右,結合手術操作刺激、患者生命體征等及時調整麻醉藥物用量。在手術結束前15 min,停止順阿曲庫銨、右美托咪定和吸入七氟醚,縫合皮膚完成后停用丙泊酚。術后均采取靜脈自控鎮痛,藥物為舒芬太尼1 μg/kg聯合0.9%生理鹽水配置成100 mL。對照組設定麻醉機呼吸參數為:潮氣量6 mL/kg,呼氣末正壓4 cm H2O,呼吸頻率12次/min,呼吸比設定為1∶2,吸入氧濃度調節為40%。觀察組以呼吸驅動壓為導向實施個體化的呼氣末正壓滴定,潮氣量、呼吸頻率、呼吸比和吸入氧濃度設定同對照組,在機械通氣5 min后即開始通過驅動壓為導向的個體化呼氣末正壓滴定,由2 cm H2O逐漸升高,每次在經過10個呼吸循環升高1 cm H2O,同時記錄最近1次的驅動壓水平。如果驅動壓隨呼氣末正壓升高而升高,則停止并下調呼氣末正壓,直到獲得最低驅動壓后維持此參數進行通氣支持。一旦出現血氧飽和度低于90%、心率超過140次/min、心率低于50次/min、平均動脈壓低于65 mm Hg(1 mm Hg=0.133 kPa)或危及生命心律失常等情況則及時停止滴定動作。其中,本研究的驅動壓指潮氣量進入肺泡所需要的壓力,具體上計算公式為,驅動壓=氣道平臺壓-呼氣末正壓。
1.3 觀察指標
比較兩組全身麻醉過程中肺部超聲評分變化,統計干預后30 min、拔管前呼吸參數,麻醉前、拔管前機體炎癥細胞因子和抗氧化因子水平,全身麻醉過程中氧合指數變化情況,統計兩組術后呼吸相關并發癥發生情況。
1.4 評定標準
驅動壓為平臺壓與呼氣末正壓的差值。肺部超聲評分:針對雙側肋間間隙實施超聲檢查,并以胸骨旁線、腋前線、腋后線為縱軸,膈肌上及平乳頭處為橫軸,將胸部劃分為12個區,針對各區超聲提示肺不張情況實施肺部超聲評分。其中0分為肺部超聲提示其滑動度正常,B線低于3個;1分為存在3條及以上的單發B線;2分為可見融合B線;3分為可見胸膜下實變聲像。統計有所12區域肺部超聲分值之和,分值越高提示肺通氣功能越差,肺不張越嚴重。炎癥細胞因子主要觀察超敏C反應蛋白(hs-CRP),采用酶聯免疫吸附試驗(ELISA),正常參考值為低于100 ng/L。抗氧化因子主要觀察超氧化物歧化酶(SOD),采用ELISA,正常參考值為0.242~0.620 μU/mL。氧合指數=動脈血氧分壓/吸入氧濃度×100%,正常值為400~500 mm Hg,如低于300 mm Hg則提示呼吸功能障礙,低于200 mm Hg提示急性呼吸窘迫綜合征。
1.5 統計學處理
2 結 果
2.1 兩組全身麻醉過程中肺部超聲評分比較
兩組麻醉前肺部超聲評分比較差異無統計學意義(P>0.05),機械通氣后5 min、干預后30 min及拔管前,觀察組肺部超聲評分均低于對照組(P<0.05)。見表1。

表1 兩組全身麻醉過程中肺部超聲評分比較分)
2.2 兩組干預后30 min和拔管前呼吸參數比較
觀察組干預后30 min和拔管前平臺壓均低于對照組,觀察組拔管前平臺壓低于干預后30 min,對照組拔管前平臺壓高于干預后30 min,觀察組拔管前呼氣末正壓增加水平大于干預后30 min,對照組拔管前呼氣末正壓增加水平小于干預后30 min,觀察組干預后30 min和拔管前呼氣末正壓增加水平大于同期對照組,差異均有統計學意義(P<0.05)。見表2。

表2 兩組干預后30 min和拔管前呼吸參數比較
2.3 兩組全身麻醉過程中氧合指數變化比較
麻醉前兩組氧合指數比較差異無統計學意義(P>0.05)。機械通氣后5 min、干預后30 min及拔管前,觀察組氧合指數均明顯高于對照組,差異均有統計學意義(P<0.05)。見表3。

表3 兩組全身麻醉過程中氧合指數變化比較
2.4 兩組麻醉前和拔管前機體炎癥細胞因子和抗氧化因子水平比較
麻醉前兩組hs-CRP和SOD水平比較差異均無統計學意義(P>0.05)。拔管前觀察組hs-CRP低于麻醉前和拔管前對照組,SOD水平高于麻醉前和拔管前對照組,差異均有統計學意義(P<0.05)。見表4。
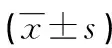
表4 兩組麻醉前和拔管前機體炎癥細胞因子和抗氧化因子水平比較
2.5 兩組術后呼吸相關并發癥比較
術后觀察組發生低氧血癥、氣胸、肺部感染、肺不張和胸腔積液的總比例顯著低于對照組,差異有統計學意義(P<0.05)。見表5。

表5 兩組術后呼吸相關并發癥比較
3 討 論
全身麻醉過程中應用的鎮靜藥物及肌肉松弛藥物等將對呼吸機功能與形態造成影響,出現肺組織壓縮,肺泡通氣不足;加之麻醉過程中胸膜壓力增高、肺組織塌陷,尤其是肺尖出現肺不張,甚至發生大面積肺不張[6]。腹腔鏡手術過程中,尤其是長時間的腹腔鏡手術者,因氣腹壓力,皮下二氧化碳吸收等,導致腹壓顯著增高,往往超過氣道壓力后加重膈肌上抬,進一步加重肺組織的塌陷[7]。同時,氣腹還將導致肺順應性降低,影響機體氧合。以上多因素綜合作用后加重了患者呼吸相關并發癥的發生率[8]。尤其是老年患者一旦出現術后肺不張,肺組織順應性顯著降低,肺小動脈阻力升高,加重機體炎性反應同時導致機體抗氧化能力降低,且術后肺不張往往持續時間較長,進而導致肺部感染的發生,增加術后拔管困難和入住重癥監護室概率,延長患者住院時間,甚至導致患者臨床死亡[9]。尤其對于老年接受腹腔鏡下結腸癌根治術者,手術時間、麻醉時間均較長,加之可能存在的術前肺功能退行性改變、慢性肺部感染、小面積肺不張等,進而加大術后發生呼吸相關并發癥可能的風險。此類患者如未能接受合適的機械通氣,將進一步導致機械性肺損傷,發生肺部感染、肺不張等嚴重并發癥[10]。
針對老年接受腹腔鏡下結腸癌根治術患者,本研究觀察組以驅動壓為導向進行滴定式個體化呼氣末正壓通氣,同時納入常規既定呼氣末正壓通氣者,比較兩組全身麻醉過程中肺部超聲評分變化情況。機械通氣后5 min、干預后30 min及拔管前,觀察組肺部超聲評分均低于對照組,提示針對老年接受腹腔鏡下結腸癌根治術患者,行以驅動壓為導向進行滴定式個體化呼氣末正壓通氣,對改善肺組織通透性,減少肺不張,進而改善肺部超聲評分有一定價值。比較兩組干預后30 min和拔管前呼吸參數發現,觀察組干預后30 min和拔管前平臺壓均低于對照組且拔管前平臺壓低于干預后30 min,觀察組拔管前呼氣末正壓增加水平大于干預后30 min,干預后30 min和拔管前呼氣末正壓增加水平大于同期對照組,說明實施以驅動壓為導向進行滴定式個體化呼氣末正壓通氣30 min后及拔除氣管導管前,可在并不增加平臺壓基礎上,有效提高呼氣末正壓水平。近年來,肺保護性通氣理念越來越受到臨床重視,且已廣泛在老年、長時間手術患者圍手術期應用,其目的在于最大限度地提高肺泡復張,但避免肺泡過度擴張,進而減少呼吸機相關性肺損傷[11]。其中,呼氣末正壓調節是目前肺保護性通氣中最關鍵的參數,選擇最佳呼氣末正壓可為患者提供最大氧合與最佳肺順應性,并最大限度地降低肺泡死腔量,維持通氣/血流比在0.84左右,改善患者呼吸功能,減少術后呼吸相關并發癥[12-13]。
同時比較兩組全身麻醉過程中氧合指數變化發現,機械通氣后5 min、干預后30 min及拔管前,觀察組氧合指數均明顯高于對照組,證明實施以驅動壓為導向進行滴定式個體化呼氣末正壓通氣5 min開始直至干預結束前,均可有效改善患者機體氧合功能。比較兩組麻醉前和拔管前機體炎癥細胞因子和抗氧化因子水平發現,拔管前觀察組hs-CRP低于麻醉前和拔管前對照組,SOD水平高于麻醉前和拔管前對照組,提示行以驅動壓為導向進行滴定式個體化呼氣末正壓通氣干預,能有效降低機體炎癥細胞因子水平,提高機體抗氧化能力。
比較兩組術后呼吸相關并發癥發現,術后觀察組發生低氧血癥、氣胸、肺部感染、肺不張和胸腔積液的總比例顯著低于對照組,進一步說明以驅動壓為導向進行滴定式個體化呼氣末正壓通氣的干預,對降低腹腔鏡下結腸癌根治術患者術后肺部相關并發癥有積極意義。以驅動壓為導向個體化滴定式呼氣末正壓通氣能有效減少肺泡萎陷,降低驅動壓,改善機體氧合與肺順應性[14]。研究認為,低驅動壓通氣,以“功能性肺容積”實施機械通氣,可確保機體通氣時肺組織體積,進而減少術后肺部并發癥[15-16]。綜上所述,以驅動壓為導向的滴定式個體化呼氣末正壓通氣,可有效改善老年腹腔鏡下結腸癌根治術患者呼吸功能,降低通氣平臺壓,提高呼氣末正壓水平,減輕機體炎性反應,提高抗氧化能力,減少術后呼吸相關并發癥。

