基于高密度傳感器的舌癌組織邊界三維電阻抗成像方法
胡松佩 徐德洪 李彥 劉凱 韓偉 姚佳烽*
1(南京航空航天大學機電學院,南京210016)
2(南京工業職業技術大學,南京 210023)
3(南京大學醫學院附屬口腔醫院,南京 210008)
口腔舌癌是頭頸部常見的惡性腫瘤之一,惡性程度高,大多表現為口舌鱗狀細胞癌(Oral tongue squamous cell carcinoma,OTSCC)。近年來,18~44 歲的年輕個體OTSCC 的發病率呈上升趨勢,年輕女性OTSCC 的年度變化百分比顯著增加[1]。吸煙與酗酒是舌癌最常見的誘因,相較于吸煙與酗酒,大約60%~70%的舌癌都與人乳頭瘤病毒(Human papilloma virus,HPV)感染有關[2]。由于HPV 的流行,HPV感染近年也成為了舌癌發病的主要誘因之一,舌癌的發病率顯著增加[3]。
目前,舌癌最常見的治療方法有手術治療、化療[4]與光熱療[5]等方法,其中,手術治療是依靠組織病理學診斷及病變大小完整地切除癌組織,是舌癌的主要治療方法[6]。癌組織切除不完整會導致舌癌二次復發,降低患者的存活率,完整地檢測出舌癌組織的邊界是癌組織完整切除的前提。組織病理學診斷是舌癌手術中重要的輔助檢測方法,需要臨床醫生切取病變組織樣本,再對樣本切片進行分析以觀測組織是否殘存癌組織,分析時間長且極大地依靠醫生的診斷經驗。其它輔助檢測方法如核磁共振成像[7]、計算機斷層成像[8]和口腔超聲成像[9]等雖然能夠檢測出整個病變組織的全貌,但是對于腫瘤的具體邊界需要富有經驗的醫生進行評估,實時性差、操作不便,并會對人體會產生輻射傷害。因此,有必要建立一種實時、便捷和無輻射的舌癌邊界臨床輔助檢測方法。
電阻抗成像(Electrical impedance tomography,EIT)技術是通過被測物表面呈圓環狀或方形狀分布的電極以相鄰激勵相鄰采集等激勵模式向目標物激勵電流,采集表面上的電壓測量值,計算其二維平面的電導率分布并成像。組織發生病變時,內部細胞的生理結構、細胞數量和功能等發生巨大變化,表現出的電學特性即電導率也會有顯著差異,因此,該技術可應用于生物醫療領域。Wu 等[10]提出了用于肺健康監測的EIT 成像方法,通過帶有一圈16 個電極的電極繃帶實現對人體肺健康狀況的監測[10];Mansouri 等[11]提出了用于乳腺癌早期檢測的EIT 成像方法,基于40 個電極系統與動態模式獲得了最佳的成像效果;Murphy 等[12]提出了用于前列腺癌成像的EIT 檢測方法,有望改善前列腺癌的診斷。
單平面電極的EIT 有很多局限性,由于電流的擴散,EIT 對電極上方和下方的區域敏感,對距離電極較遠的區域不敏感,即單平面EIT 對于目標物的垂直信息不敏感[13]。許多研究者采用三維(3D)EIT 解決此問題。Wicaksono 等[14]通過將pH 轉換模型(pH-Conversion model,pH-CM)集成到3D EIT 中,對胃中的酸度進行監測,仿真和實驗評估的平均pH 誤差分別為15.8%和8.5%;Yang 等[15]提出了用于細胞培養的3D EIT 成像技術,基于16 個電極的微型平面EIT 傳感器完成了高質量的3D 細胞培養成像,可實時、非侵入地監測培養細胞,以便于細胞培養過程中生物行為及細胞動力學的研究;Javaherian 等[16]將稀疏重建梯度投影(Gradient projection for sparse reconstruction,GPSR)應用于3D EIT 成像算法中,解決了因3D EIT 成像體素過多導致的存儲空間大以及重建時間長的問題,實現了肺功能的3D EIT 實時監測。
本研究建立了基于高密度傳感器的舌癌組織邊界3D EIT 方法,設計了底部中心1 個接地電極、頂部均勻布置16 個激勵電極的高密度傳感器。通過傳感器的兩層平面電極實現被檢測組織的3D EIT 圖像重建,并可對組織任一高度的切面進行2D EIT 圖像繪制,有望應用于舌癌組織被切除手術中癌組織邊界的實時檢測,輔助醫生實時評估癌組織的邊界并規劃其切緣。
1 傳感器結構設計與3D EIT成像方法研究
1.1 高密度傳感器結構設計
本研究提出了平面3D EIT 成像方法,設計了如圖1 所示的高密度傳感器,用于對嵌于正常組織內部的癌組織進行邊界識別。高密度傳感器由頂蓋、彈簧、支撐柱、壓板、底板和底座構成,頂蓋、支撐柱、壓板與底座均由樹脂3D 打印加工而成。其中,支撐柱用于支撐底座和頂蓋,并套在彈簧中支撐彈簧。彈簧的兩端分別卡在頂蓋與壓板中,壓板借助于支撐柱和彈簧可以上下移動。將被檢測的組織置于壓板與底板之間,以實現3D EIT 成像所需的兩層平面電極,壓板的高度取決于檢測物的厚度。在壓板上設置有4×4 的電極陣列即激勵電極,其中,電極直徑為2 mm,電極間距為6 mm,構成了22 mm×22 mm方形檢測場域。選取彈簧探針作為激勵電極,該探針由針頭、彈簧和針管構成。其中,針頭由黃銅制成,其表面經過鍍金處理,將彈簧放置于針管內部以實現針頭的伸縮,使得激勵電極在檢測凹凸不平的組織時可與組織表面緊密貼合。底板由PCB 加工而成,其中心處有一個直徑為2 mm 的接地電極,對該電極進行了沉金處理,電極厚度為0.05 μm。接地電極為電流激勵的負端,壓板上的電極陣列均與該電極進行兩電極激勵。在進行電流激勵時,電流可從組織表面流到底面,貫穿整個組織。層板與底板的其余區域均進行鋪銅處理,以提高傳感器的屏蔽效果,減小噪音干擾。
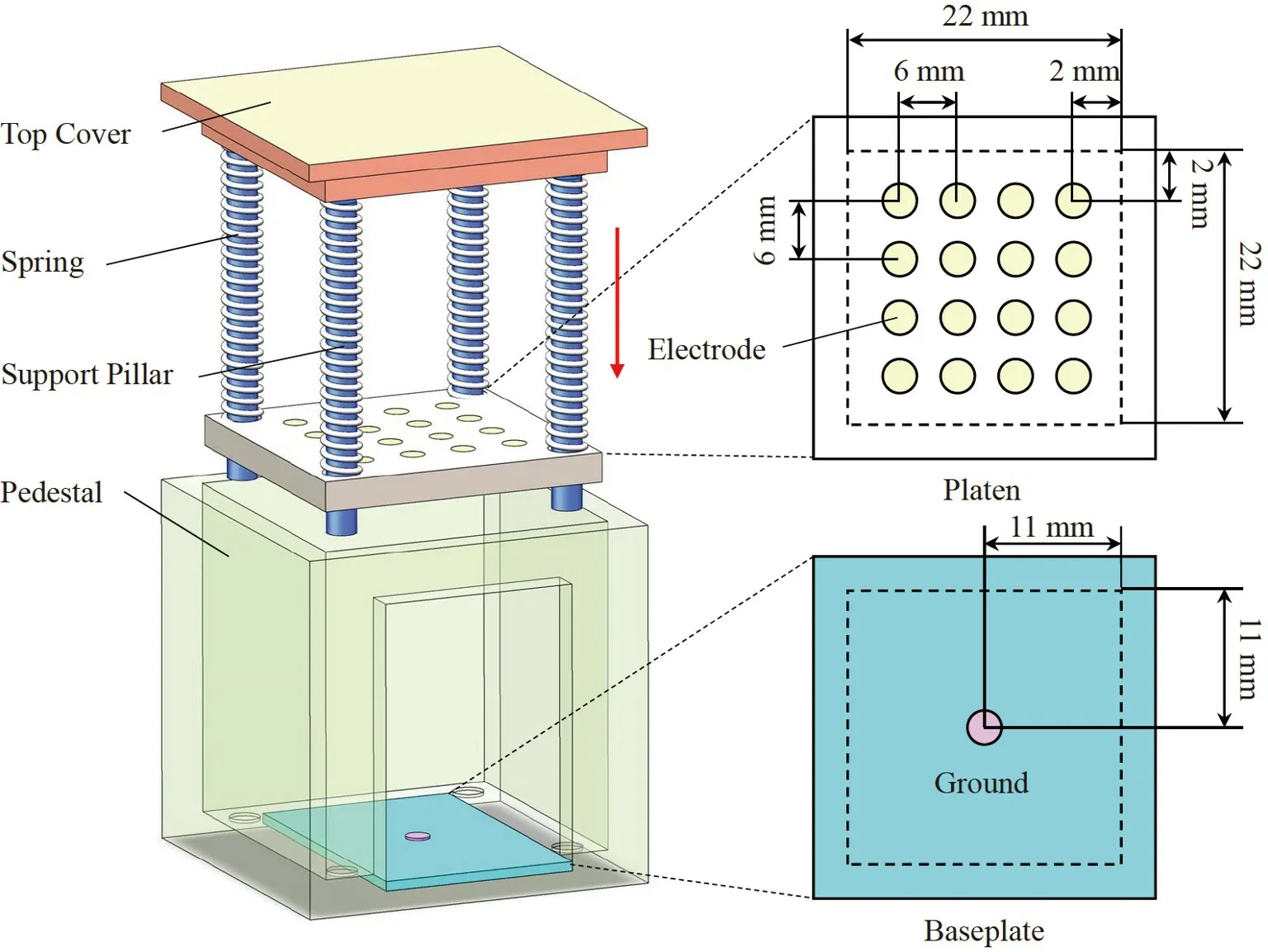
圖1 高密度傳感器的結構圖Fig.1 Structure diagram of high-density sensor
1.2 3D EIT成像方法
圖2 為3D EIT 檢測流程圖,將待測組織置于高密度傳感器中的壓板與底板之間,進行3D EIT 檢測。通過傳感器壓板上的16 個激勵電極分別與底板的接地電極激勵,每次激勵時依次采集其余15 個電極的電勢,共采集16 × 15=240 個電勢值,用于計算場域的電導率分布。其中,3D EIT 成像滿足公式(1):

圖2 三維電阻抗成像(3D EIT)檢測流程圖Fig.2 Detection flow chart of three dimensional electrical impedance tomography (3D EIT)
其中,Ω是測量域,(x,y,z)是測量域的點坐標,(x,y,z)是在點(x,y,z)處的電導率,(x,y,z)是在點(x,y,z)處的電勢。每個電極施加的總電流邊界條件如公式(2)所示:
其中,是第l個電極,L是電極個數,是電極間隙,n表示場域Ω的外單位法向量,s是電極表面,Il是第l個電極注入的電流。為了保證解(x,y,z)的存在且唯一性,應該滿足邊界條件即公式(3)~(5):
當激勵電流為定值時,3D EIT 成像即為探索場域Ω的電導率分布σ與邊界電勢V的關系,可以表示為公式(6):
其中,是邊界電勢變化的向量,是電導率變化的向量,J是雅可比矩陣。J由公式(7)計算得到[17]:
其中,Ji,j是J的元素,i表示場域第i個有限元網格,j表示第j次一對電極激勵時的獨立測量,u與v是第j次一對電極分別注入電流時的電勢分布。因此,可采用計算得到的J與測量得到的邊界電勢變化根據公式(8)逆向求解場域中的電導率變化:
其中,R() 是正則化項,λ是正則化因子。在成像方面,由改進的Tikhonov 正則化算法以逆向求解整個三維場域的電導率變化矩陣,按公式(9)計算:
其中,kt和kn為正則化系數,I為單位矩陣,D為對角矩陣,為邊界電勢變化,即用高密度傳感器測得的240 個邊界電勢變化。通過有限元法對整個22 mm×22 mm×H方形場域進行網格劃分,由8416 個網格點將場域劃分成45337 個自由四面體網格,然后仿真計算整個場域的雅可比矩陣J,用于每個網格點的電導率計算,最終根據電導率變化矩陣繪制3D EIT 圖像,并且通過3D EIT 仿真成像確定了本成像方法的空間分辨率,即目標物的最長邊與場域的最長邊之比不低于13.6%。
2 傳感器3D EIT成像性能研究
2.1 舌體組織厚度對傳感器3D EIT成像的影響
自然狀況下,人的舌體厚度H約為6 mm[18]。為探究舌體厚度H對高密度傳感器進行3D EIT 成像的影響,通過有限元的方法進行了3D EIT 成像仿真。仿真的背景域為舌體的正常組織,該域是高密度傳感器檢測的22 mm×22 mm×H的方體場域,其電導率為0.1 S/m。在場域中放入半徑為2.5 mm、高為2 mm 的圓柱幻影作為舌癌組織,其電導率為0.01 S/m。對舌體厚度H分別為4、5、6、7 和8 mm 中的舌癌組織進行3D EIT 仿真實驗,并選取傳感器角落處P1、中心處P2以及邊界處P33 個特殊位置研究了腫瘤組織在傳感器不同位置的成像能力。3D EIT 圖像重建結果如圖3 所示,每兩行展示了正常組織中的癌組織分別位于高密度傳感器P1、P2和P3這3 處位置的3D EIT 圖像重建結果,其中包括3D EIT 成像結果的俯視圖與3D 視圖。圖3 中第一列為幻影的真實分布,后5 列為組織厚度H分別為4、5、6、7 和8 mm 時的3D EIT 圖像重建結果。3D EIT 圖像展示了場域中1/3 最大電導率變化值的等值面。成像結果表明,通過電導率的差異可捕捉癌組織的位置并呈現其輪廓,其中,P1、P2及P3位置的癌組織均可被正確評估,并能完整地展現出整個舌癌組織的邊界。

圖3 不同厚度舌體中的舌癌組織在高密度傳感器P1、P2 與P3 處的3D EIT 重建圖像Fig.3 3D EIT reconstruction images of tongue cancer in tongue tissue with different thickness at P1,P2 and P3 of high-density sensor
與圖3 中3D EIT 重建圖像相對應的圖像相關系數(Image correlation coefficient,ICC)如表1 所示。ICC 按照公式(10)計算:

表1 3D EIT圖像重建結果的圖像相關系數(ICC)Table 1 Image correlation coefficient (ICC) of 3D EIT image reconstruction results
其中,是第i個網格點處真實的電導率變化量,是真實的平均電導率變化量,是3D EIT 重建的第i個網格點處的電導率變化量,是3D EIT 重建的平均電導率變化量,M是場域劃分的網格點數量。ICC 值用于反映3D EIT 重建圖像與幻影真實圖像之間的相關程度,取值范圍為0~1,ICC 值越大,說明3D EIT 重建圖像與真實圖像的吻合程度越高,圖像重建質量越好。
為了更直觀地探究傳感器P1、P2及P33 個位置處的3D EIT 圖像重建能力以及舌體組織厚度對3D EIT 圖像重建的影響,繪制了不同厚度的舌體組織在P1、P2及P3處3D EIT 圖像重建的ICC 分布折線圖以及平均ICC 柱狀圖。如圖4 所示,隨著舌體厚度H增加,ICC 先增大后減小,舌體厚度對傳感器P2處的圖像重建質量無明顯影響,P2處的圖像重建質量明顯高于P1和P3處的圖像重建質量。此外,通過P1、P2及P3處圖像重建的平均ICC 柱狀圖可以看出在H=6 mm 時平均ICC 值最高,表明舌體厚度為6 mm 時高密度傳感器整體的3D EIT 重建效果優于其它厚度組織的重建效果,相對于6 mm 厚度的舌體,4 和8 mm 厚度舌體的3D EIT 成像誤差小于3.3%。

圖4 不同厚度舌體組織的3D EIT 圖像重建ICC 分布Fig.4 ICC distribution of 3D EIT image reconstruction of tongue tissue with different thickness
為探究高密度傳感器P2處的3D EIT 重建圖像相較于P1和P3更加接近真實圖像的原因,探究了傳感器進行3D EIT 成像時整個檢測場域的敏感度(S)分布,其中,S矩陣中的元素Sij可由公式(11)計算得到:
其中,I為激勵電流,Ω為測量場域,i為有限元網格的個數,j為第j次獨立測量,σi為第i個網格處的電導率,Uj為第j次獨立測量的電勢,u與v是第j次一對電極分別注入電流時的電勢分布。
繪制了高密度傳感器檢測場域為22 mm×22 mm×6 mm 時的敏感度分布。如圖5 所示,顏色條由藍色漸變到紅色,表明敏感度從低到高。以接地電極為中心呈圓弧狀的紅色區域是敏感度高的區域,從該區域往外敏感度逐漸降低。其中,P1、P2和P3處的敏感度分別為8.62×104、4.83×106和3.03×105。P2位置的敏感度大于P1與P3,與圖3 高密度傳感器3 個位置的3D EIT 重建能力相符,即傳感器P2位置處圖像重建能力最好。
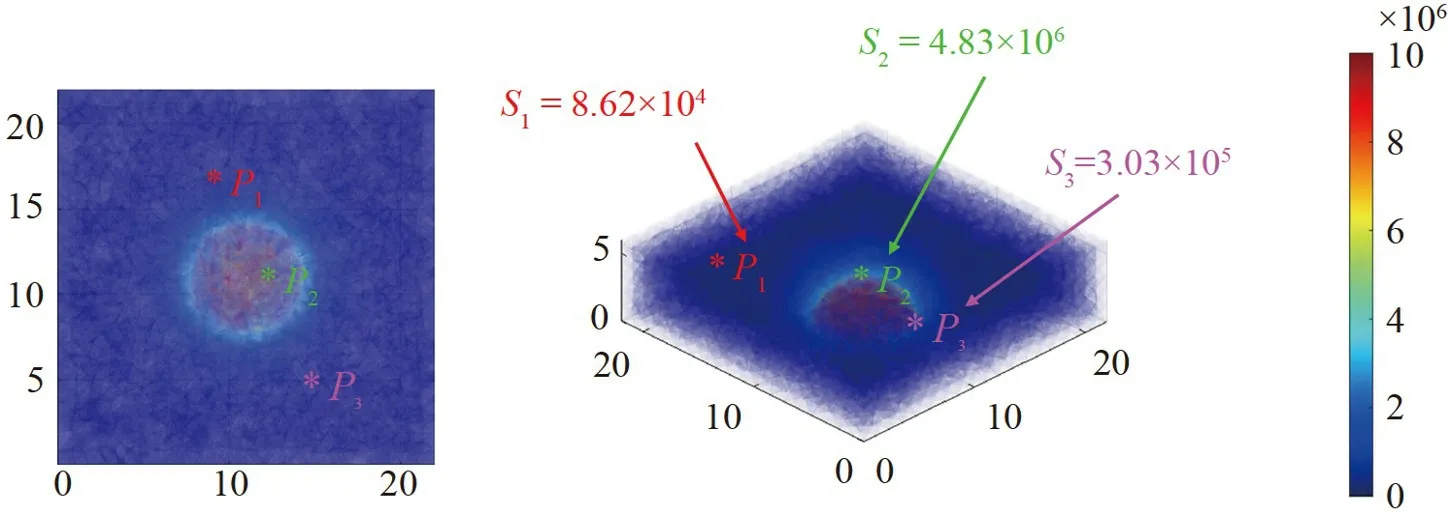
圖5 高密度傳感器檢測場域的敏感度(S)分布Fig.5 Sensitivity (S) distribution of detection field of high-density sensor
2.2 不同浸潤深度的舌癌組織的3D EIT成像性能
對高密度傳感器P2處的不同浸潤深度Ht的舌癌組織進行3D EIT 仿真,以探究高密度傳感器對不同浸潤深度的舌癌組織的3D EIT 成像能力。不同浸潤深度下舌癌組織的3D EIT 圖像重建結果如圖6 所示,分別以側視圖和3D 視圖兩個視角展示了舌癌組織浸潤深度2.0、3.5 和5.0 mm 時的3D EIT 成像結果,相應的圖像相關系數分別為0.9109、0.9260 和0.9063,表明高密度傳感器能夠很好地捕捉到場域中癌組織深度的電導率變化,根據電導率變化正確評估癌組織的浸潤深度及其三維邊界。
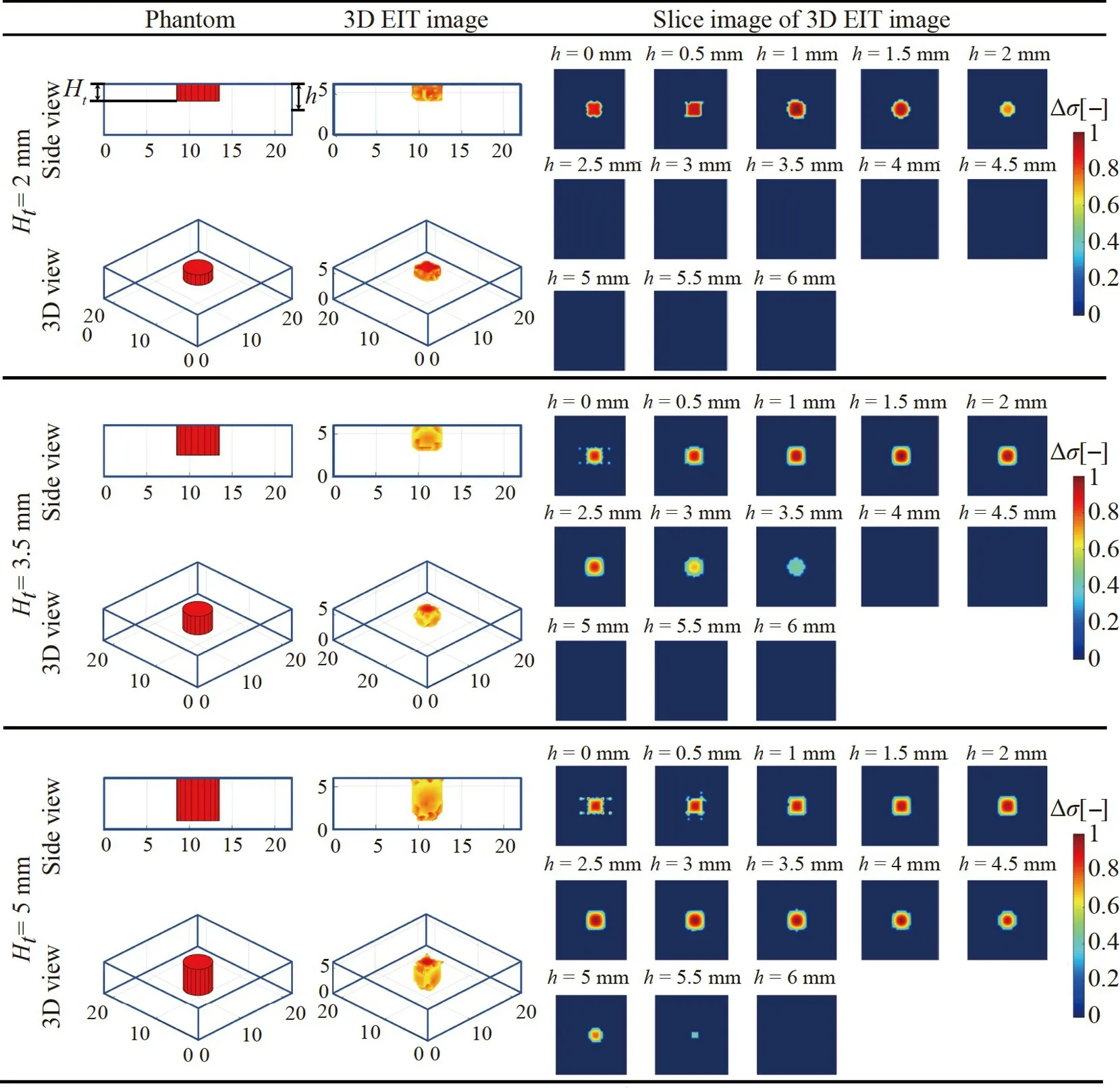
圖6 不同浸潤深度癌組織的3D EIT 重建圖像Fig.6 3D EIT reconstruction images of cancer tissues with different depths of invasion
3D EIT 圖像的切片圖展示了從高密度傳感器檢測場域的頂部到底部的水平切面圖,其中包括h為0、0.5、1、…、5、5.5 和6 mm 所在高度的2D EIT 截面。2D 的EIT 圖像清晰地展示了癌組織每一層所在的區域大小,并在相應深度下的切片圖像能捕捉到癌組織,通過3D EIT 圖像的切片圖能夠更直觀地確定癌組織的浸潤深度。上述結果表明,高密度傳感器以及3D EIT 成像方法可以評估舌體中癌變組織引起的電導率變化,進而呈現出整個舌癌組織的3D 邊界。
3 高密度傳感器的3D EIT實驗
3.1 實驗設備
實驗設備如圖7 所示,包括筆記本電腦(PC)、IM3570 阻抗分析儀(日本HIOKI 公司)、34980A 數據采集儀(Keysight)、17 通路選通開關和高密度傳感器。阻抗分析儀持續發出幅值為0.1 A 的交流電信號傳輸給數據采集儀,電腦向數據采集儀發出控制信號,控制數據采集儀選通17 通道選通開關,實現激勵的電流信號與高密度傳感器的傳輸,同時采集待測組織的響應電壓信號。17 通路選通開關控制高密度傳感器的16 個激勵電極與數據采集儀的選通,1 個電極激勵、同時依次采集其余15 個電極的電勢,再進行1 個電極激勵、同時依次采集其余15 個電極的電勢,依次循環,直到最后1 個電極激勵時其余電極的電勢采集完成后,測量結束。數據采集儀共采集240 個響應電勢值,最終將響應電勢值傳輸給電腦,進行3D 場域的電導率計算及成像。

圖7 實驗設備圖Fig.7 Diagram of experimental equipment
3.2 舌體模型制備
在之前的研究中,浸潤在正常舌體組織中的舌癌組織的阻抗值大于周邊正常組織[19]。因此,為了模擬發生癌變的舌體,選取電導率較大的牛肉組織制備舌體的正常組織,選取電導率較低的豬脂肪組織制備生長在舌體中的舌癌組織。切取厚度為10 mm 的方形牛肉塊作為舌體中的正常組織,再用不同直徑的圓形刀具在每塊牛肉的中間位置切除厚度為5 mm 的牛肉組織,用不同直徑的圓形刀具切出相應大小的豬脂肪組織作為舌癌組織,將豬脂肪組織填充進牛肉塊中制備舌體模型。
選取5 塊厚度均為10 mm 的牛肉塊制備5 種舌體模型,再用直徑分別為3、4.5、6、7.5 和9 mm 的圓形道具制備大小不同的舌癌組織。在舌體模型制備過程中,由于牛肉與豬脂肪均為軟組織,將豬脂肪填充進牛肉后并不能保證豬脂肪仍是一個完整的圓柱體,因此,最終制成了5 種最大直徑(dmax)分別為3、4.5、6、7.5 和9 mm 的舌體模型,如圖8 所示。
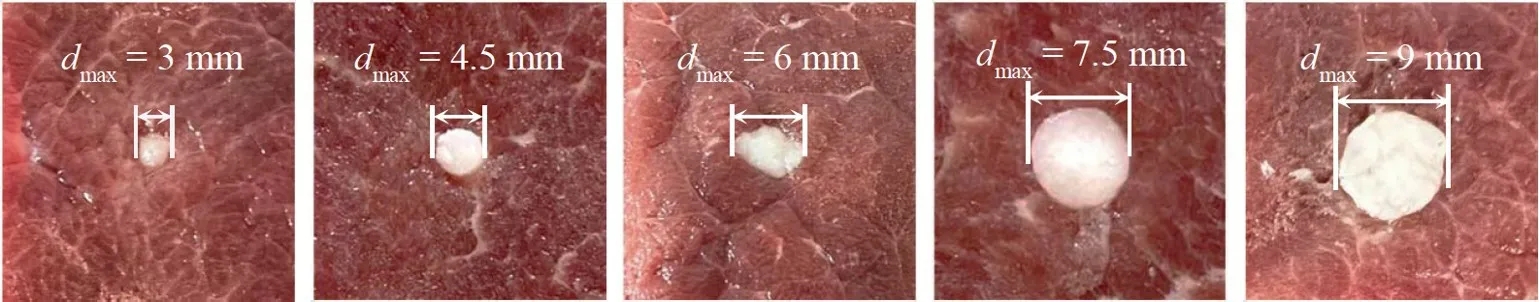
圖8 5 種不同尺寸的舌體模型Fig.8 Tongue cancer tissue models with five different dimensions
4 結果與討論
4.1 3D EIT成像結果
對制備的5 個舌體模型分別進行了3D EIT 檢測實驗,5 個舌體模型中的癌組織dmax分別為3、4.5、6、7.5 和9 mm。將這5 個舌體模型分別放進高密度傳感器進行檢測,3D EIT 成像結果以及成像的切片圖如圖9 所示。3D EIT 圖像呈現了場域中最大電導率變化值2/5 的等值面,等值面構成的區域則是舌癌組織,其中虛線圓柱輪廓是舌癌組織的理想邊界,通過3D EIT 重建圖像能夠檢測出嵌于舌體中的舌癌組織,并大致呈現其邊界。從3D EIT 成像的切片圖中可以清楚地判斷舌癌組織的浸潤深度,切片圖展現了舌癌組織處于1、2、3、4、5 和6 mm 浸潤深度下的2D 邊界。其中,圓形的虛線框為舌癌組織所在截面應有的2D 邊界,不同截面下的2D EIT 圖像可以呈現出舌癌組織的2D 邊界。
4.2 成像結果差異分析
通過組織之間的電導率差異可以識別dmax分別為3、4.5、6、7.5 和9 mm 的舌癌組織及其邊界。對于尺寸較小(3 和4.5 mm)的舌癌組織,3D EIT 重建的邊界有偏差,并不能正確識別舌癌組織的浸潤深度,在截面高度為4 和5 mm 處未重建出舌癌組織真實的2D 邊界,這是由于這兩個尺寸的舌癌組織相較于全部檢測的3D 場域而言體積過小,與3D 場域的最大面積比僅為1.86%和4.18%。
對于dmax分別為6、7.5 和9 mm 的舌癌組織,通過3D EIT 切片圖像能夠正確識別舌癌組織的浸潤深度。在截面高度為1~4 mm 時的2D EIT 圖像能正確評估舌癌組織的2D 邊界;在截面高度為5 mm 時,EIT 成像呈現的邊界小于理想邊界。dmax為3 和4.5 mm 的舌癌組織在截面高度為1~3 mm 時的2D EIT圖像能夠正確評估舌癌組織的2D 邊界;在截面高度為4~5 mm 時,EIT 成像呈現的邊界小于理想邊界,甚至未重建出舌癌組織的真實邊界。與仿真成像結果相比,本研究的3D EIT 重建圖像未能正確評估出舌癌組織的真實浸潤深度,并且在接近場域上表面的截面0~1 mm 處未能重建出組織的真實2D 邊界,可能是實驗設備之間信號的傳輸不穩定或者信號受到了噪聲干擾,使得測得的邊界電勢不均勻,因而造成圖像重建誤差偏高。
5 結論
提出了用于舌癌組織邊界檢測的3D EIT 成像方法,設計了高密度傳感器,并利用其對舌體模型進行了3D EIT 成像。首先,有限元仿真實驗結果證明了個體間的舌體厚度差異不會對3D EIT 成像產生影響,當人舌體厚度為6 mm 時,傳感器的整體成像性最好。其次,高密度傳感器能夠很好地捕捉到場域中癌組織深度的電導率變化,并且通過3D EIT 圖像的切片圖能夠展示癌組織每一層所在的區域大小,有助于臨床診斷時更直觀地確定癌組織的浸潤深度。最后,通過對舌體模型進行的3D EIT 成像實驗驗證了3D EIT 重建方法的可行性,但是對實驗設備之間信號的穩定傳輸以及噪聲的處理還需要進一步改善,以更好地應用于臨床中舌癌邊界的檢測。綜上,本方法有望應用于舌癌組織臨床手術中,為臨床診斷和治療提供一種舌癌組織邊界的實時檢測方法,輔助醫生更精準地劃定癌組織切緣,從而盡可能完整地切除舌癌組織,降低舌癌復發率。