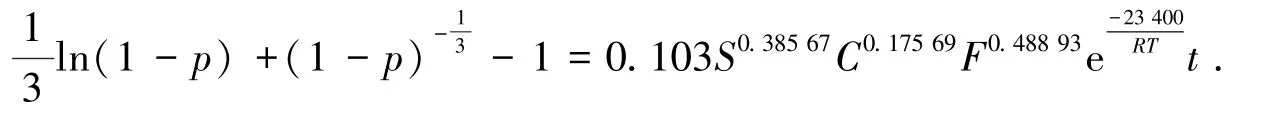瓦斯灰協同氧催化脫硫體系中鋅的浸出動力學研究
鐘瑩瑩 謝兵華 楊學金 王 訪 高冀云 馬林轉劉天成 賈麗娟
(1.云南民族大學化學與環境學院,云南 昆明 650504;2.云南省高校民族地區資源清潔轉化重點實驗室,云南 昆明 650504)
瓦斯灰和SO2分別為鋼鐵企業生產過程中排放的固體廢棄物和大氣污染物[1-3],對人體健康和生態系統產生嚴重危害[4-5],其資源化利用制約著鋼鐵企業的可持續發展。瓦斯灰通常含有鐵、鋅及錳等過渡金屬[6],具有顆粒較細、比表面積大、表面活性強的特征[7],在金屬鋅的資源回收和SO2的高效脫除方面具有潛在價值。高爐瓦斯灰回收鋅的方法主要包括火法[8-9]、濕法[6,10]和火法富集—濕法分離[11-12]等,其中瓦斯灰濕法回收鋅是當前最具有前景的處理方法[13]。目前瓦斯灰脫硫體系均在高溫條件下進行,通過還原氣化脫硫或生成穩定的硫酸鹽,系統能耗偏高,工藝復雜,至今無法大面積工業化推廣及應用[14-18]。
筆者所在課題組利用瓦斯灰漿液在氧氣存在的條件下催化脫除SO2,發現瓦斯灰漿液進行脫硫反應10 h后,其脫硫率幾乎保持在100%,但其僅將瓦斯灰漿液作為脫硫劑,對含鋅高爐瓦斯灰脫硫過程中浸出的有價金屬未進行充分利用,瓦斯灰的附加值并不高[19]。實踐表明,低濃度的SO2不利于鋅浸出,而高濃度的SO2則可能導致脫硫不達標。為實現瓦斯灰高效脫硫的同時最大程度地浸出有價金屬,提高其利用價值,本研究重點考察了反應溫度、進氣流量、攪拌速度、進口SO2濃度等因素對有價金屬鋅浸出效果的影響,以滿足高脫硫率和高浸鋅率的工藝要求;基于收縮核模型建立了瓦斯灰浸出動力學模型,探索瓦斯灰中金屬鋅的浸出機理,為瓦斯灰的二次資源化利用提供可靠的理論依據。
1 試驗原料及儀器
浸出試驗所用的瓦斯灰原料取自云南省某鋼鐵企業,其化學元素分析結果見表1。

表1 瓦斯灰化學元素分析結果Table 1 Results of chemical elements analysis for the gas ash %
從表1可以看出:該瓦斯灰中主要有價元素Zn、Fe的含量分別為46.332%、34.477%,具有回收價值。瓦斯灰中主要組分有CaZn8(SO4)2(OH)12Cl2·9H2O、Mn6.927Si6O15·(OH)8、ZnO、Fe2O3和Fe3O4。鋅主要來源于CaZn8(SO4)2(OH)12Cl2·9H2O和ZnO,且均能溶于酸性體。
其他試驗原料包括去離子水、N2(體積分數99.999%)、O2(體積分數99.5%)、SO2(10 004.8 mg/m3)、高錳酸鉀(分析純)、氫氧化鈉(分析純)。
試驗儀器包括質量流量控制器D07系列、流量顯示儀D08-4F、恒溫加熱磁攪拌器DF-101S、煙氣分析儀MRU 5、原子吸收光譜儀NovAA800D。
2 試驗方法
本試驗將鋼氣瓶中的SO2、O2和N2按照一定比例混合來模擬工業煙氣,通過質量流量計調節煙氣流量,然后通入模擬煙氣到反應器中進行氣液吸收反應,SO2氣體和瓦斯灰漿液在不同溫度、SO2濃度和進氣流量等條件下進行瓦斯灰脫硫,未反應煙氣先后通入K2MnO4和NaOH溶液凈化排出,浸出液中鋅的濃度用原子吸收光譜儀器測定,計算鋅的浸出率。鋅浸出率計算式:
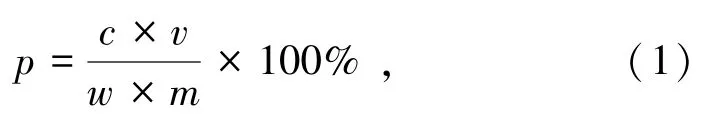
式中:p為鋅的浸出率,%;c為浸出液中Zn的濃度,mg/L;v為浸出液的體積,L;w為瓦斯灰中Zn、Fe元素的含量百分比,%;m為瓦斯灰質量,mg。
3 試驗結果與討論
3.1 瓦斯灰漿液脫硫條件試驗
3.1.1 反應溫度對鋅浸出率的影響
將0.5 g瓦斯灰轉移至三口燒瓶中,按固液比1.67 g/L加入去離子水,控制進氣流量400 mL/min,氧含量10%,進口SO2濃度3.0 g/m3,攪拌速度600 r/min,考察反應溫度對鋅浸出率的影響,結果見圖1。
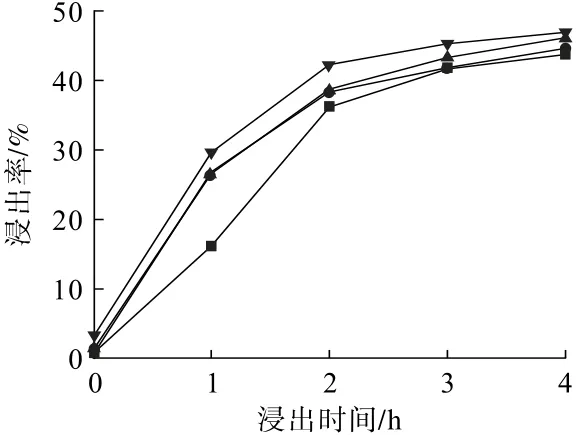
圖1 反應溫度對鋅浸出率的影響Fig.1 Influence of reaction temperature on zinc leaching rate
從圖1可以看出:浸出時間越長,鋅的浸出率越高,這是因為隨著反應的進行,SO2不斷地進入液相,反應液的酸性增大,鋅的浸出率升高。浸出時間由0增加至2 h時,鋅的浸出率提升明顯;在浸出反應進行2 h后,鋅的浸出率提升緩慢。提高反應溫度,鋅的浸出率增加,這是因為升溫加速了反應物和生成物的擴散速率[20],SO2氣體進入液相,生成H+的速率增快且瓦斯灰表面的活性位點增加,提高了H+和瓦斯灰有效成分碰撞的概率,從而有利于鋅的浸出。因此,本試驗選擇反應溫度40 ℃。
3.1.2 進口SO2濃度對鋅浸出率的影響
控制反應溫度40 ℃,固液比1.67 g/L,氧含量10%,進氣流量400 mL/min,攪拌速度600 r/min,考察進口SO2濃度對鋅浸出率的影響,結果見圖2。
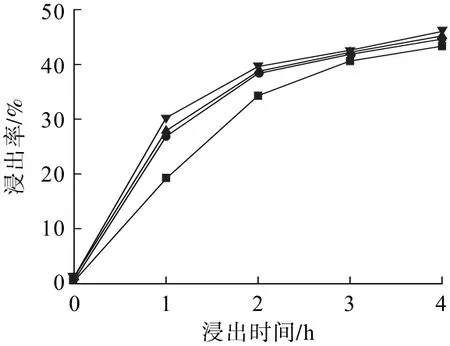
圖2 進口SO2濃度對鋅浸出率的影響Fig.2 Influence of SO2 concentration in entrance on zinc leaching rate
從圖2可以看出:進口SO2濃度越高,鋅的浸出率也越高。一定時間內,隨著進口SO2濃度增大,溶液中SO2吸收氧化成硫酸的量越多,溶解瓦斯灰的濃度越大,從而強化了有價金屬鋅的浸出。當反應進行至2 h時,進口SO2濃度為2.5 g/m3,鋅的浸出率為34.28%,進口SO2濃度為4.0 g/m3時,鋅的浸出率為39.60%,提高了5.32個百分點。而當反應進行至4 h時,進口SO2濃度為2.5 g/m3,鋅的浸出率為43.32%,進口SO2濃度為4.0 g/m3時,鋅的浸出率為46.01%,僅提高了2.69個百分點。這是因為SO2的溶解過程是可逆的,隨著反應的進行,溶液中H+濃度逐漸增大,SO2從氣相進入液相的量減小,導致脫硫率的降低和鋅的浸出率增加變慢。綜合考慮,本試驗選擇進口SO2濃度3.0 g/m3。
3.1.3 進氣流量對鋅浸出率的影響
控制進口SO2濃度3.0 g/m3,反應溫度40 ℃,固液比1.67 g/L,氧含量10%,攪拌速度600 r/min,考察進氣流量對鋅浸出率的影響,結果見圖3。
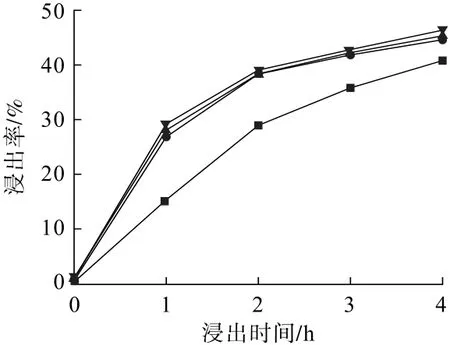
圖3 進氣流量對鋅浸出率的影響Fig.3 Influence of inlet flow rate on zinc leaching rate
從圖3可以看出:進氣流量越大,鋅的浸出率越高。這是因為當進口SO2濃度不變時,進氣流量越大,同一時間內通入的SO2越多,瓦斯灰浸出的鋅也越多[21]。當反應進行至3 h時,進氣流量從200 mL/min升至400 mL/min,鋅的浸出率從35.80%增加到41.83%,而當進氣流量從400 mL/min升至600 mL/min時,鋅的浸出率從41.83%增加到42.80%,僅增加了近一個百分點。這是因為隨著進氣流量的增加,O2和SO2在液相中的停留時間減短,SO2被瓦斯灰漿液協同氧催化生成硫酸的量減少,即進氣流量的增大沒有顯著影響鋅的浸出率。因此,本試驗選擇進氣流量400 mL/min。
3.1.4 攪拌速度對鋅浸出率的影響
控制進氣流量400mL/min,反應溫度40 ℃,固液比1.67 g/L,氧含量10%,進口SO2濃度3.0 g/m3,考察攪拌速度對鋅浸出率的影響,結果見圖4。
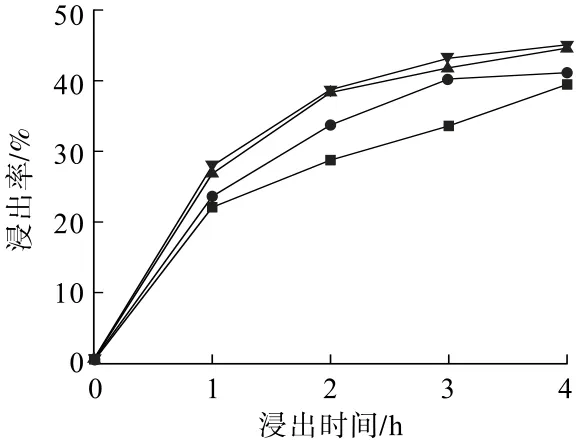
圖4 攪拌速度對鋅浸出率的影響Fig.4 Influence of stirring speed on zinc leaching rate
從圖4可以看出:攪拌速度越快,鋅浸出率越高。這是因為當攪拌速度加快時,液體流速增快,SO2與液體接觸面積增大,硫酸生成速度加快,硫酸與瓦斯灰接觸面積也增大了,瓦斯灰脫硫過程中鋅的浸出率得到有效提高。當反應進行至3 h時,攪拌速度從200 r/min升至400 r/min,鋅浸出率從33.60%增至40.24%,而攪拌速度從600 r/min升至800 r/min,鋅浸出率僅增加了一個百分點。這是因為攪拌速度的增加可以減小擴散層厚度,增快傳質速度,但無法破壞固相和液相之間吸附作用[22],所以增加攪拌速度不能大幅度提高鋅浸出率。因此,本試驗選擇攪拌速度600 r/min。
3.2 瓦斯灰脫硫過程鋅浸出動力學研究
3.2.1 浸出動力學模型的選擇
建立浸出動力學模型是為了更好地研究瓦斯灰中金屬的浸出規律,從而提高金屬浸出率。在浸出過程中,SO2首先從氣相擴散到液相然后被氧化成硫酸,接著生成的硫酸與瓦斯灰反應,從而浸出瓦斯灰中的鋅,在反應過程中瓦斯灰顆粒逐漸減少,但反應停止時瓦斯灰未完全溶解,說明瓦斯灰惰性的固體成分包裹未反應的收縮核,因此采用收縮核模型來描述瓦斯灰脫硫過程中鋅的浸出行為[23]。收縮核模型提出控制過程受界面化學反應、固相生成層擴散以及溶液邊界層擴散速率的影響[24]。瓦斯灰浸出過程中SO2氣體首先溶解于溶液,此過程所需時間很短,可忽略不計,所以不考慮溶液邊界層擴散速率對浸出過程的影響。受界面化學反應速率影響的收縮核模型(模型1),浸出劑與未反應的瓦斯灰內核界面的反應速度最小,此時浸出速率方程如式(2)[25]所示。受固相生成層擴散速率影響的收縮核模型(模型2),浸出劑擴散穿過固相生成層的速度最小,此時浸出速率方程如式(3)[26]所示。當浸出反應速率都能被界面化學反應速率和固相生成層擴散速率明顯影響(模型3)時,表明浸出過程受混合控制,其浸出速率方程如式(4)[27]所示。
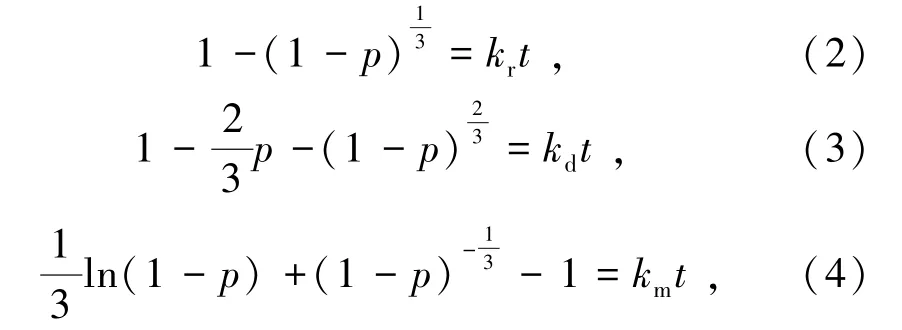
式中:p為浸出率,%;t為浸出時間,min;kr為受界面化學反應控制時的速率常數;kd為受固相生成層擴散控制時的速率常數;km為受混合控制時的速率常數。
瓦斯灰脫硫過程鋅浸出動力學試驗在以下條件進行:反應溫度(25、40、50、60 ℃),固液比1.67 g/L,進口SO2濃度3.0 g/m3,進氣流量400 mL/min,攪拌速度為600 r/min,含氧量10%。試驗所得鋅浸出率分別代入浸出動力學公式(2)、(3)和(4)用于計算動力學,結果如圖5、表2所示。
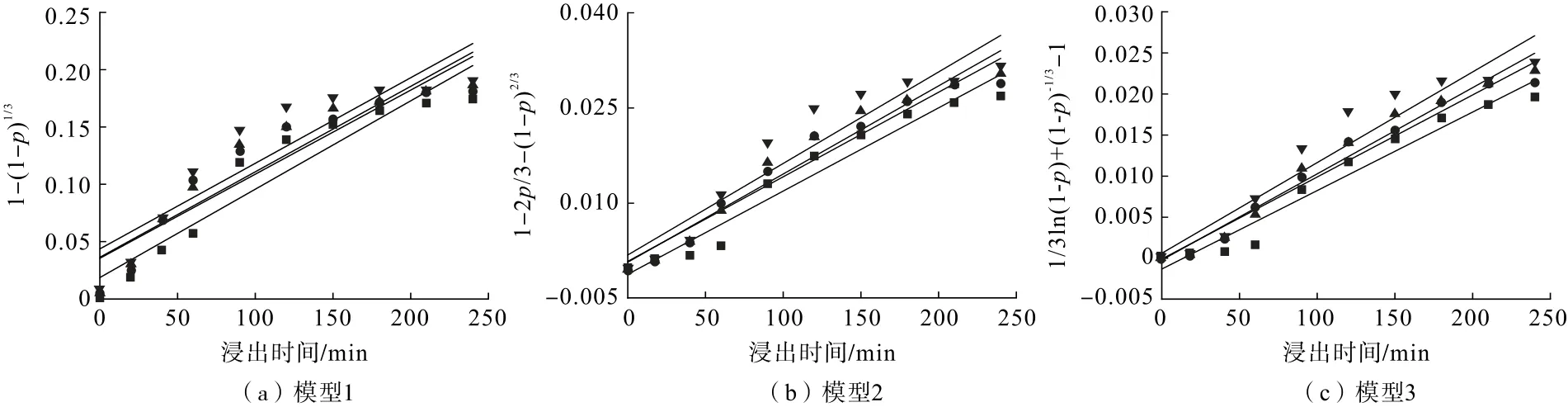
圖5 不同溫度下浸出動力學模型與浸出時間的關系Fig.5 Relationship between leaching kinetics model and leaching time at different temperatures
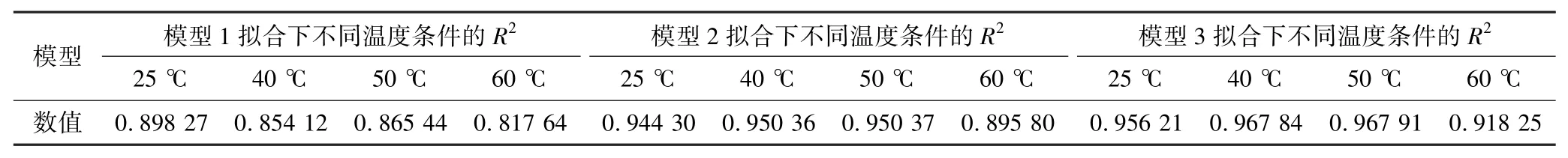
表2 浸出動力學模型擬合結果Table 2 Results of leaching kinetics model fitting
由圖5及表2可知:不同溫度下,瓦斯灰在浸出過程中反應速度受混合控制的收縮核模型所得擬合度是最高的,表明本試驗中瓦斯灰的浸出過程受混合控制。
3.2.2 鋅浸出表觀活化能
阿倫尼烏斯公式可用于描述速率常數k與溫度T的關系,通過該公式可計算出反應的表觀活化能,計算公式如下[28]:
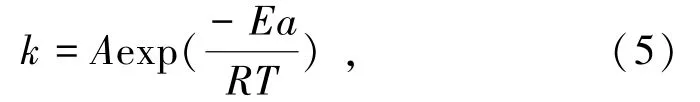
式中:k為速率常數,min-1;A為指數因子,min-1;Ea為反應活化能,kJ/mol;R為理想氣體常數,8.314 J/(mol·K);T為浸出溫度,K。兩邊同時取自然對數,得到lnk與1/T的關系式(6),以lnk對1/T作圖,所得直線的斜率為-Ea/(kJ/mol),如圖6所示。
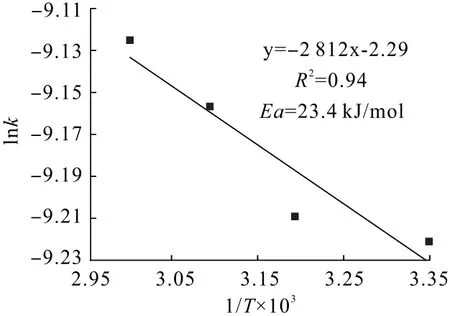
圖6 lnk與1/T×103的關系Fig.6 Relationship diagram of lnk with 1/T×103
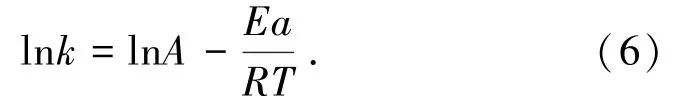
通過計算可知:瓦斯灰浸出過程的表觀活化能為23.4 kJ/mol,表觀活化能介于12~42 kJ/mol,通過經驗表明該浸出過程受混合控制[29]。
指數因子A=0.103 min-1,則鋅的浸出過程模型函數為:
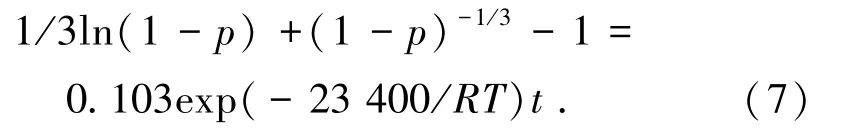
3.2.3 半經驗動力學模型建立
為了更好地揭示攪拌速度、進口SO2濃度和進氣流量對該浸出反應速率常數的影響,本文采用半經驗方程來描述該浸出反應,這些影響因素的反應級數可通過下式表示[23]:
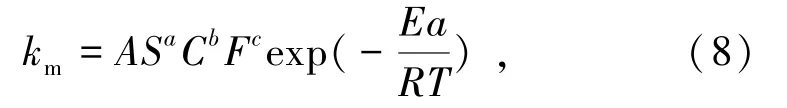
式中:S為攪拌速度,r/min;C為進口SO2濃度,g/m3;F為進氣流量,mL/min;a、b、c分別為攪拌速度、進口SO2濃度、進氣流量的表觀反應級數。
將式(4)與式(8)聯立得瓦斯灰脫硫體系中鋅浸出過程的半經驗動力學方程:
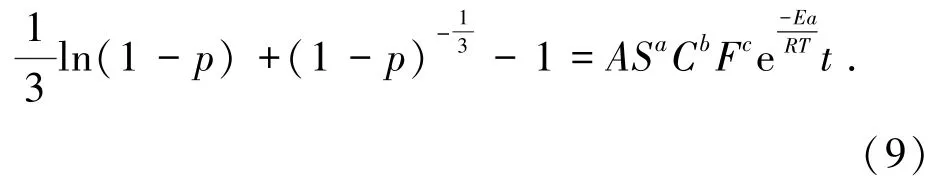
前面通過溫度條件下的動力學方程擬合得知該浸出過程符合混合控制模型,因此可用混合控制模型計算3個影響因素的速度常數,本文在不同攪拌速度、進口SO2濃度和進氣流量條件下作1/3ln(1-p)+(1-p)-1/3-1與浸出時間t的關系曲線,如圖7所示,得到不同浸出條件下的速率常數k1、k2、k3,其中曲線相關擬合度R2(表3)可判斷浸出過程中反應速率的控制因素,R2均大于0.95,進一步驗證了鋅在瓦斯灰脫硫體系中受混合控制及說明鋅的經驗反應速率與上述的浸出參數有依賴關系。
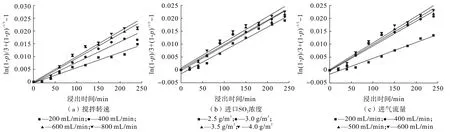
圖7 不同單因素條件下與浸出時間t的關系圖Fig.7 Relationship diagram with leaching time under different single factor conditions
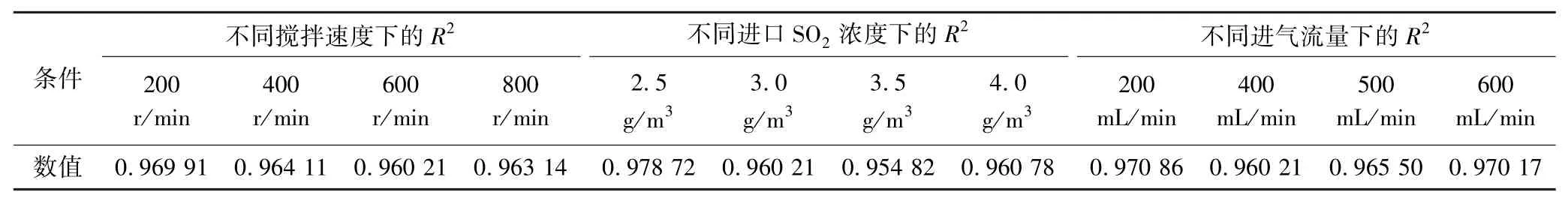
表3 半經驗動力學方程擬合結果Table 3 Results of semi-empirical dynamical equation fitting
以lnk1對lnS(攪拌速度)、lnk2對lnC(進口SO2濃度)及lnk3對lnF(進氣流量)作圖,如圖8所示,擬合得到的直線方程斜率即為半經驗動力學方程中攪拌速度、進口SO2濃度及進氣流量的表觀反應級數,分別為0.385 7、0.175 69及0.488 93。將其表觀反應級數、表觀活化能及指數因子代入方程(9)中,得出該浸出反應的半經驗動力學方程:
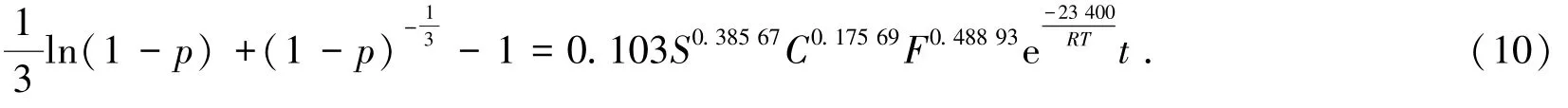
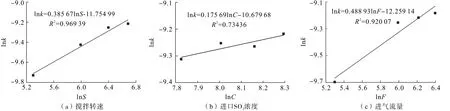
圖8 lnk對lnS、lnC和lnF的關系曲線Fig.8 Relation curve of lnk to lnS,lnC,and lnF
4 結 論
(1)利用瓦斯灰漿液在氧氣存在的條件催化脫除SO2并高效浸出鋅,單因素試驗確定反應條件為:反應溫度40 ℃,進氣流量400 mL/min,進口SO2濃度3.0 g/m3,攪拌速度600 r/min,在此條件下可得鋅的最大浸出率為44.6%。
(2)浸出溫度、攪拌速度、進口SO2濃度、進氣流量均與鋅的浸出為正相關關系,增加浸出溫度、進口SO2濃度、進氣流量及攪拌速度均能提高鋅的浸出率。
(3)該浸出過程在25~60 ℃內符合收縮核模型,浸出反應速率受混合控制,同時計算得到鋅浸出行為的表觀活化能為23.4 kJ/mol,鋅的半經驗浸出動力學方程為: